circPTPRA与miR-1252在胃癌中的表达及其对细胞生物学行为的影响
吉鸿,索丹,赵耀,李顺乐,徐心,常帅
由于胃癌患者早期缺乏临床特征,导致多数患者被确诊时已发展为进展期胃癌,因此错失最佳治疗时机,预后较差[1]。因此,探究胃癌发生及发展的分子机制或寻找相关生物标记物将有助于胃癌的诊断及治疗。环状RNA(circular RNA,circRNA)是一种由反式剪接形成的非编码RNA,主要由外显子环化合成。circRNA与胃癌的发生及发展密切相关,并有可能作为胃癌治疗的靶点[2-4]。已知circPTPRA在膀胱癌中表达下调,其表达上调可抑制细胞增殖及转移[5],但与胃癌的相关研究报道较少。生物信息学分析预测显示,circPTPRA与miR-1252存在结合位点,后者在胃癌中表达上调,且可通过PAK3途径抑制胃癌的进展[6]。因此,circPTPRA可能通过靶向miR-1252参与胃癌的发生及发展。有鉴于此,本研究对circPTPRA与miR-1252在胃癌中的表达情况及其对胃癌细胞增殖、迁移及侵袭的影响进行研究,以探讨circPTPRA/miR-1252分子轴在胃癌中的可能作用。
1 材料与方法
1.1 材料与试剂
选取2019年1月至2020年3月间西安交通大学第二附属医院收治的42例胃癌患者作为研究对象,其中男22例,女20例;年龄55~69岁,平均年龄(62.74±4.31)岁。取术中切除的胃癌组织与癌旁组织(距癌组织>5 cm处的组织)于-80 ℃冰箱内保存。本研究获本医院伦理委员会审批。
人胃癌细胞HGC-27购自上海通派生物;DMEM购自美国Gibco;Lipofectamine2000、Trizol购自美国Invitrogen;逆转录与荧光定量PCR试剂购自北京天根生化;pcDNA购自上海远慕生物;pcDNA-circPTPRA购自美国Invitrogen(图1);si-NC、si-circPTPRA、miR-NC、miR-1252 mimics、anti-miR-NC、anti-miR-1252均购自广州锐博生物;CCK-8试剂、Transwell小室、Matrigel基质胶购自北京索莱宝;兔抗人MMP-2抗体(批号EPR1184、货号ab92536)、兔抗人MMP-9抗体(批号EP1255Y、货号ab137867)与二抗购自美国Abcam。
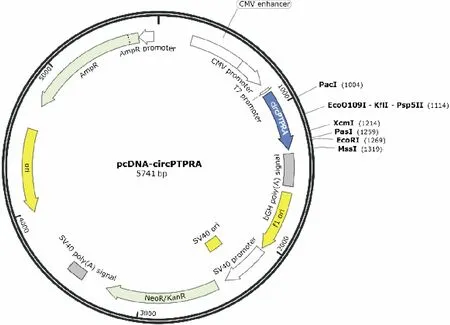
图1 pcDNA-circPTPRA质粒示意图
1.2 方法
1.2.1 实验分组
取对数期HGC-27细胞,用0.25%胰蛋白酶消化制备细胞悬液(1×104个/mL),取200 μL细胞悬液加入6孔板,待细胞生长汇合至70%时将培养液更换为不含胎牛血清的培养基,按照Lipofectamine2000说明书分别转染pcDNA、pcDNA-circPTPRA、si-NC、si-circPTPRA、anti-miR-NC、anti-miR-1252、共转染pcDNA-circPTPRA和miR-NC、共转染pcDNA-circPTPRA和miR-1252 mimics至HGC-27细胞中,并分别命名为pcDNA组、pcDNA-circPTPRA组、si-NC组、si-circPTPRA组、anti-miR-NC组、anti-miR-1252组、pcDNA-circPTPRA+miR-NC组、pcDNA-circPTPRA+miR-1252组。转染6 h后更换为DMEM完全培养基继续培养48 h用于后续检测。
1.2.2 qRT-PCR检测circPTPRA、miR-1252的表达水平
采用qRT-PCR实验检测胃癌组织、癌旁组织及HGC-27细胞中circPTPRA、miR-1252的表达水平。其中RNA提取与反转录过程均参照试剂盒说明书操作。PCR反应体系:SYBR Green Master Mix 10 μL,正反向引物0.8 μL,cDNA 2 μL,ddH2O补足体系至20 μL。反应条件:95 ℃预变性2 min,95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,共40次循环。circPTPRA以GAPDH为内参,miR-1252以U6为内参,用2-ΔΔCt法计算目的基因相对表达量。
circPTPRA正向引物5′-ACACACACACACACACACAC-3′,反向引物5′-CTGCTCACAAGACCTACCCA-3′;GAPDH正向引物5′-AACGGATTTGGTCGTATTG-3′,反向引物5′-GGAAGATGGTGATGGGATT-3′;miR-1252正向引物5′-ATTGGAACGATACAGAGAAGATT-3′,反向引物5′-GGAACGCTTCACGAATTTG-3′;U6正向引物5′-ATTGGAACGATACAGAGAAGATT-3′,反向引物5′-GGAACGCTTCACGAATTTG-3′。
1.2.3 CCK-8实验检测细胞增殖
收集各组HGC-27细胞接种于96孔板(3×103个/孔),于37 ℃培养箱内培养48 h,随后向各孔中加入10 μL CCK-8试剂,于37 ℃孵育1 h,在波长450 nm处检测吸光度值(OD)。每组3复孔,实验重复3次。
1.2.4 流式细胞仪检测细胞周期
收集各组HGC-27细胞接种于6孔板(1×104个/孔),加入750 mL/L的乙醇于4 ℃下孵育24 h,1 000 g转速离心5 min,弃乙醇,PBS洗涤,加入50 μg/mL PI和100 g/mL RNaseA,于37 ℃下染色30 min,用FACS Calibur流式细胞仪及Flowjoe软件分析细胞在G0/G1期、S期、G2/M期所占细胞比例。每组3个复孔,实验重复3次。
1.2.5 Transwell实验检测细胞迁移、Transwell Matrigel体外侵袭实验检测细胞侵袭
迁移实验:各组HGC-27细胞按照每孔1×104个的密度分别接种于24孔板Transwell小室的上室,24 h后弃培养基,用甲醇固定细胞20 min,然后用0.5%结晶紫染色液染色15 min,擦拭未能迁移或侵袭的细胞,用200倍显微镜随机选取5个视野观察并分析结果。
侵袭实验:使用预冷培养液和Matrigel基质胶制备Matrigel基质胶稀释液,加入Transwell小室的上室后于培养箱内孵育5 h以实现预包被;后续实验步骤同迁移实验。
1.2.6 双荧光素酶报告基因检测circPTPRA与miR-1252的靶向关系
将HGC-27细胞按照每孔8×103个的密度接种于24孔板,共转染circPTPRA野生型或突变型的psiCHECK2荧光素酶载体WT-circPTPRA或MUT-circPTPRA(美国Promega)各100 ng和miR-NC(100 nmol/L)或miR-1252 mimics(100 nmol/L),转染48 h后用酶标仪检测细胞相对荧光素酶活性。
1.2.7 Western blot检测MMP-2、MMP-9蛋白表达
收集HGC-27细胞,加入RIPA裂解液提取细胞总蛋白,100 g/L SDS-PAGE电泳分离蛋白(40 μg/孔),电泳后转移至PVDF膜,用封闭液封闭1 h,分别加1∶1 000稀释的MMP-2、MMP-9、GAPDH抗体,4 ℃孵育过夜,加入HRP标记的山羊抗兔IgG二抗(1∶2 000),室温孵育1 h,ECL化学发光试剂盒显影,用ImageJ软件分析各条带灰度值。
1.3 统计学处理

2 结果
2.1 circPTPRA与miR-1252在胃癌组织中的表达
与癌旁组织比较,胃癌组织中circPTPRA的相对表达量显著降低、miR-1252的相对表达量显著升高,差异均有统计学意义(P<0.05)。见表1。
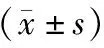
表1 circPTPRA与miR-1252在胃癌组织中的表达
2.2 circPTPRA过表达对HGC-27细胞增殖及细胞周期的影响
转染pcDNA-circPTPRA后,HGC-27细胞中circPTPRA的相对表达量较pcDNA组显著升高,差异有统计学意义(P<0.05)。与pcDNA组比较,pcDNA-circPTPRA组细胞活力显著降低,G0/G1期细胞比例显著升高,S期细胞比例显著降低,差异均有统计学意义(P<0.05);但G2/M期细胞比例无统计学差异(P>0.05)。见图2、表2。

图2 circPTPRA过表达对HGC-27细胞周期的影响
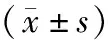
表2 circPTPRA过表达对HGC-27细胞增殖及细胞周期的影响
2.3 circPTPRA过表达对HGC-27细胞迁移及侵袭的影响
与pcDNA组比较,pcDNA-circPTPRA组HGC-27细胞的迁移数及侵袭数均显著减少,MMP-2、MMP-9蛋白的表达水平均显著降低,差异均有统计学意义(P<0.05)。见表3、图3。
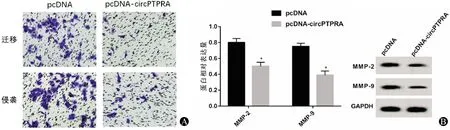
图3 circPTPRA过表达对HGC-27细胞迁移、侵袭及MMP-2、MMP-9蛋白表达的影响 A:细胞迁移,细胞侵袭;B:MMP-2、MMP-9蛋白表达情况(与pcDNA组比较,*P<0.05)
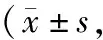
表3 circPTPRA过表达对HGC-27细胞迁移及侵袭的影响个)
2.4 circPTPRA靶向调控miR-1252
由Circular RNA Interactome预测可见circPTPRA与miR-1252存在结合位点,见图4A。转染miR-1252 mimics可显著降低野生型载体WT-circPTPRA的荧光素酶活性(P<0.05),而对突变型载体MUT-circPTPRA的荧光素酶活性无显著影响(P>0.05),见图4B。与pcDNA组比较,pcDNA-circPTPRA组miR-1252的相对表达量显著降低(P<0.05);与si-NC组比较,si-circPTPRA组miR-1252的相对表达量显著升高(P<0.05),见图4C。
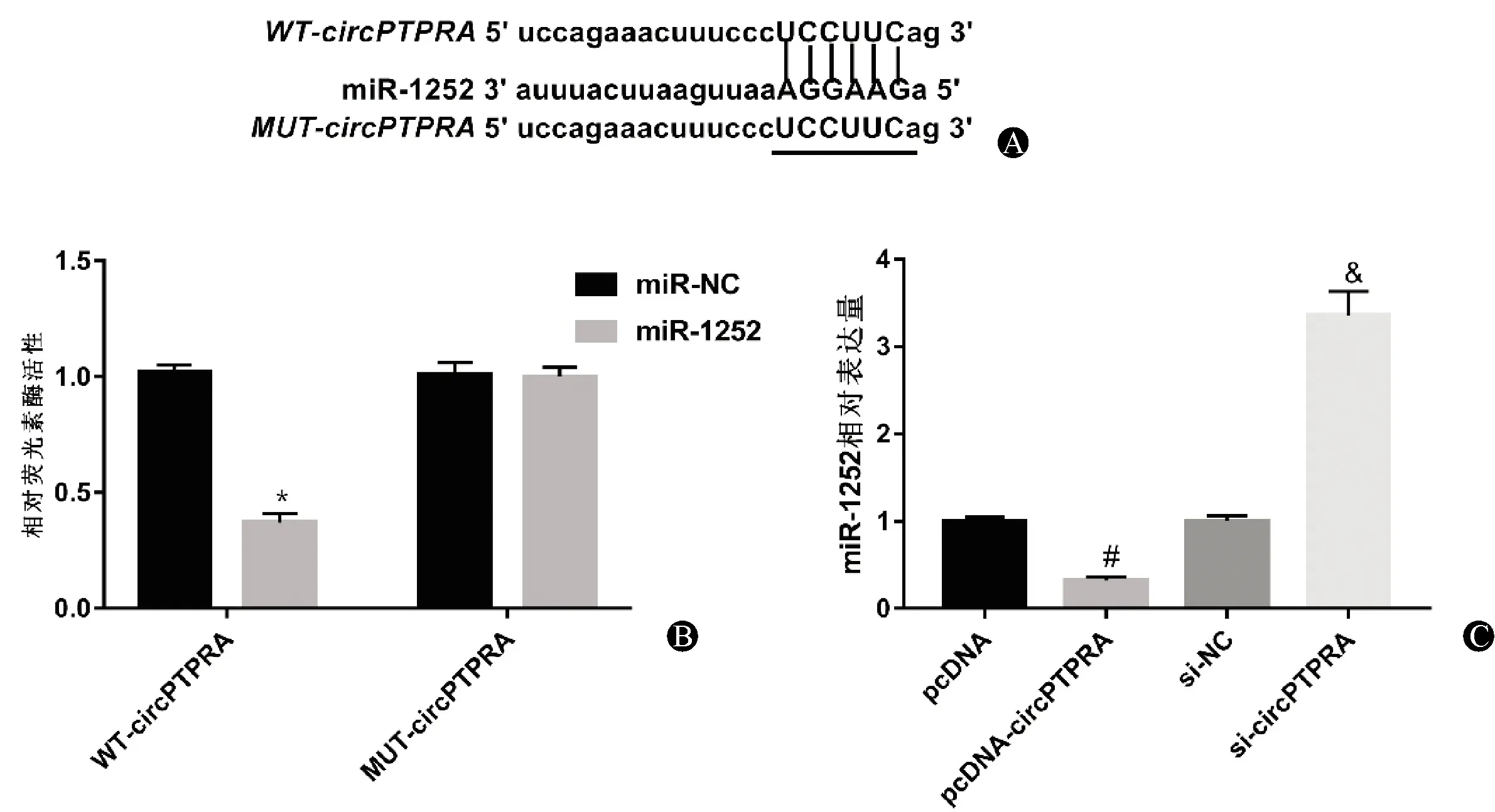
图4 circPTPRA靶向调控miR-1252 A:circPTPRA与miR-1252存在结合位点;B:双荧光素酶报告基因实验;C:circPTPRA负向调控miR-1252的表达。与miR-NC组比较,*P<0.05;与pcDNA组比较,#P<0.05;与si-NC组比较,&P<0.05
2.5 抑制miR-1252表达对HGC-27细胞增殖、细胞周期及迁移和侵袭的影响
转染anti-miR-1252后,HGC-27细胞中miR-1252的相对表达量较anti-miR-NC组显著降低,差异有统计学意义(P<0.05)。与anti-miR-NC组比较,anti-miR-1252组细胞活力显著降低,G0/G1期细胞比例显著升高,S期细胞比例显著降低,迁移及侵袭细胞数显著减少,MMP-2、MMP-9蛋白表达水平显著降低,差异均有统计学意义(P<0.05);但G2/M期细胞比例无统计学差异(P>0.05)。见表4、图5。

图5 抑制miR-1252表达对HGC-27细胞迁移、侵袭、细胞周期及MMP-2、MMP-9蛋白表达量的影响 A:细胞迁移;B:细胞侵袭;C:细胞周期;D:MMP-2、MMP-9蛋白表达情况(与anti-miR-NC组比较,*P<0.05)
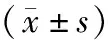
表4 抑制miR-1252表达对HGC-27细胞增殖、细胞周期及迁移和侵袭的影响
2.6 miR-1252过表达逆转circPTPRA过表达对HGC-27细胞增殖、细胞周期及迁移和侵袭的作用
共转染pcDNA-circPTPRA和miR-1252 mimics后,HGC-27细胞中miR-1252的相对表达量较pcDNA-circPTPRA+miR-NC组显著升高,差异有统计学意义(P<0.05)。与pcDNA-circPTPRA+miR-NC组比较,pcDNA-circPTPRA+miR-1252组细胞活力显著升高,G0/G1期细胞比例显著降低,S期细胞比例显著升高,迁移及侵袭细胞数显著增多,MMP-2、MMP-9蛋白表达水平显著升高,差异均有统计学意义(P<0.05);但G2/M期细胞比例无统计学差异(P>0.05)。见表5、图6。
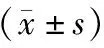
表5 miR-1252过表达逆转circPTPRA过表达对HGC-27细胞增殖、细胞周期及迁移和侵袭的作用

图6 miR-1252过表达对circPTPRA过表达的HGC-27细胞迁移、侵袭、细胞周期及MMP-2、MMP-9蛋白表达量的影响 A:细胞迁移;B:细胞侵袭;C:细胞周期;D:MMP-2、MMP-9蛋白表达情况(与pcDNA-circPTPRA+miR-NC组比较,*P<0.05)
3 讨论
circRNA主要存在于细胞质中,与传统线性RNA不同,circRNA缺乏5′端帽子结构与3′端polyA尾巴结构,因此不易被核酸外切酶降解;且circRNA基因序列上富含miRNA应答元件,可与miRNA结合而发挥海绵作用,从而解除miRNA对靶基因的抑制作用进而正向调控靶基因表达。circRNA虽广泛分布于人体内各种细胞内,但具有组织特异性与时序特异性,近年来,越来越多的研究表明,circRNA在胃癌中表达异常,可作为胃癌诊断及治疗的潜在标记物,如:circ_0000267可通过充当miR-503-5p的海绵分子进而调节HMGA2表达并促进胃癌进展[7];circRNA_LARP4可通过充当miR-424-5p的海绵分子进而调节LATS1表达从而抑制胃癌细胞增殖和侵袭[8];circRNA_0005075可通过调节miR-431/p53上皮间质转化轴进而抑制胃癌的发生[9]。另外,circPSMC3可抑制胃癌的增殖和转移[10];circMRPS35也可抑制胃癌的进展[11]。
circPTPRA在非小细胞肺癌细胞中呈低表达,上调其表达可抑制非小细胞肺癌细胞转移[12],但circPTPRA在胃癌中的表达情况尚不清楚。本研究结果显示,胃癌组织中circPTPRA的表达量显著降低,而过表达circPTPRA可显著降低胃癌细胞活力、增加G0/G1期细胞比例、减少S期细胞比例,提示circPTPRA低表达可能参与了胃癌的发生及发展,而circPTPRA过表达则能诱导细胞周期阻滞进而抑制胃癌细胞增殖。另外,本研究还发现,circPTPRA过表达后胃癌迁移及侵袭细胞数显著减少,且MMP-2、MMP-9蛋白表达水平也显著降低,提示circPTPRA过表达可抑制胃癌细胞的转移。由于目前已证实MMP-2、MMP-9在胃癌中表达上调,可进一步通过降解细胞外基质沉积进而促进细胞转移[13-16],因此提示circPTPRA抑制胃癌转移的作用可能是通过抑制MMP-2、MMP-9蛋白表达进而实现的。
通过生物信息学分析以及双荧光素酶报告基因等实验,我们进一步证实胃癌细胞中circPTPRA能够靶向负调控miR-1252;胃癌组织中miR-1252的表达量较癌旁组织显著升高,抑制miR-1252表达可显著降低胃癌细胞活力、增加G0/G1期细胞比例、减少S期细胞比例,并可降低胃癌细胞迁移及侵袭能力,与过表达circPTPRA的作用结果一致;而过表达miR-1252可逆转circPTPRA过表达对胃癌细胞增殖、细胞周期及迁移和侵袭的作用,进一步提示circPTPRA可通过靶向负调控miR-1252进而减缓胃癌的生长及转移。另外,抑制miR-1252表达可显著降低MMP-2、MMP-9蛋白表达水平,而miR-1252过表达可逆转过表达circPTPRA所导致的MMP-2、MMP-9蛋白表达水平下调,均提示MMP-2、MMP-9蛋白可能是circPTPRA/miR-1252的下游效应分子。有研究表明,miR-1252在非小细胞肺癌中表达上调,可通过FOXR2信号轴促进非小细胞肺癌细胞的增殖和迁移[17],而抑制其表达可促进细胞凋亡[18];miR-1252在甲状腺乳头状癌中表达上调,可通过FSTL1信号通路调节癌细胞的增殖及凋亡[19]。然而,circPTPRA靶向负调控miR-1252进而最终调控胃癌细胞增殖、细胞周期、迁移和侵袭以及MMP-2、MMP-9蛋白表达水平,是否通过上述通路进而实现,仍需进一步研究。
综上所述,胃癌组织中circPTPRA的表达量显著降低,而miR-1252的表达量显著升高,过表达circPTPRA可通过靶向抑制miR-1252的表达进而抑制细胞增殖、迁移、侵袭并诱导细胞周期阻滞,circPTPRA/miR-1252分子轴在胃癌生长及转移过程中可能发挥了重要的调控作用。因此,circPTPRA可能是胃癌靶向治疗的潜在靶点,而我们下一步将通过体内动物实验进一步验证circPTPRA与miR-1252在胃癌发生及发展进程中的作用。

