槲皮素对口腔癌Tca-8113 细胞增殖、迁移和侵袭的影响及PI3K/AKT 信号通路的调控作用
肖兰飞高继萍闫晓如王晓堂续国强宋国华
(1.山西医科大学实验动物中心,实验动物与人类疾病动物模型山西省重点实验室,太原 030001;2.山西医科大学附属精神卫生医院,太原 030001)
口腔癌是世界上最常见的恶性肿瘤之一,死亡率高,预后差[1]。 尽管口腔癌的预后和治疗取得了很大的进展,但其 5 年生存率仍低于 63%[2]。 因此,寻找疗效确切的抗口腔癌药物,可能成为提高口腔癌治愈率的重要研究方向。 近年来,已有研究表明传统中医药在肿瘤治疗中发挥着重要的作用[3]。 槲皮素是广泛存在于我们日常饮食中一种植源性黄酮类化合物,它通过促凋亡作用和抑制多种癌症的发生发展显示出抗癌潜能[4]。 研究发现,槲皮素可通过线粒体和内质网信号通路诱导人口腔癌SAS 细胞凋亡[5]。 也有研究表明,槲皮素在体外实验可有效抑制口腔癌SCC-25 细胞生长、迁移和侵袭,其分子机制是通过细胞周期阻滞和线粒体介导的凋亡实现的[6]。 PI3K/AKT 与癌细胞增殖和凋亡、周期调控、侵袭转移以及化放疗抗拒密切相关,在肿瘤的发生发展中起关键作用[6-8]。 目前尚无PI3K/AKT 信号通路在槲皮素对口腔癌细胞生物学行为中作用的研究。 因此,本研究探讨了槲皮素对口腔癌Tca-8113 细胞增殖、迁移和侵袭功能的影响及对PI3K/AKT 信号通路的调控作用,旨在为口腔癌的治疗提供理论依据。
1 材料和方法
1.1 实验细胞
本实验所使用的人口腔癌细胞系Tca-8113 购自武汉博士德生物公司。
1.2 主要试剂与仪器
槲皮素购自上海Acmec 公司;CCK-8 试剂盒购自上海翊圣公司;Transwell 小室与Matrigel 基底膜基质均购自美国Corning 公司;TRIzol、PrimeScriptTMRT Master Mix (Perfect Real Time)与TB GreenTMPremix Ex TaqTMⅡ (Tli RNaseH Plus)均购自日本TaKaRa 公司;RIPA 增强型裂解液、BCA 蛋白定量试剂盒、SDS-PAGE 凝胶试剂盒均购自武汉博士德生物公司;anti-PTEN、anti-AKT 和 anti-FOXO1 一抗均购自 Proteintech 公司; anti-p-AKT 和 anti-p-FOXO1 购 自 Wanleibio 公 司;anti-BCL2L11 和 βactin 均购自美国CST 公司,货号分别为:22034-1-AP、10176-2-AP、18592-1-AP、WLP001a、WL03634、2933、4970 T。 CO2细胞培养箱购自日本 Sanyo 公司;微孔分光光度计Epoch 购自美国Bio-tek 公司;实时荧光定量PCR 仪Step One Plus 购自美国ABI公司;普通PCR 仪和蛋白垂直电泳仪购自美国Bio-Rad 公司;化学发光成像仪购自英国Yngene 公司。
1.3 实验方法
1.3.1 细胞系的选择
选用3 种不同分化类型的口腔癌细胞系进行了槲皮素处理预实验。 与其余两种细胞系相比,Tca-8113 作为一种低分化的口腔癌细胞系,其对于槲皮素的处理更加敏感,因此我们选用Tca-8113 作为实验对象。 此外,Tca-8113 作为经典的细胞系也在口腔癌研究中被广泛应用[9]。
1.3.2 细胞的培养与处理
将Tca-8113 细胞培养在添加有10%胎牛血清,100 U/mL 青霉素和 100 μg/mL 链霉素的 DMEM 培养基中,培养温度为37℃,二氧化碳含量为5%。 将细胞分为对照组和槲皮素处理组,槲皮素处理组细胞依据文献报道,选择槲皮素的最佳作用浓度为50 μmol/L[10],不做任何处理的细胞(即0 μmol/L 槲皮素)作为对照组。
1.3.3 细胞增殖检测
胰酶消化细胞后,调整细胞个数为5×104/mL。用移液器吸取100 μL 细胞悬液加入96 孔板中,药物处理24、48、72 h,每组设置 5 个复孔。 处理结束后每孔加入CCK-8 溶液10 μL 后置于37℃培养箱孵育 2 h。 酶标仪检测 450 nm 光吸收度(optical density, OD),细胞增殖能力根据下述公式计算:细胞增殖能力=[(实验孔-空白孔)/(对照孔-空白孔)]×100%。
1.3.4 Transwell(添加基质胶)检测细胞的迁移(侵袭)能力
用PBS 洗涤两次经处理的细胞,胰蛋白酶消化离心后用不含FBS 的培养基重悬细胞,调整细胞个数为 5×103/mL。 用移液器移取 200 μL 细胞悬液加入 Transwell 小室中,700 μL 含有 10% FBS 的培养基加入24 孔板中,共培养24 h。 培养结束后,用棉签从小室中除去未迁移的细胞,PBS 洗涤一次,4%多聚甲醛固定30 min,随后0.1%结晶紫染液染色15~30 min,PBS 缓慢轻柔的洗涤一次。 每个小室随机选取5 个视野进行统计学分析。
1.3.5 qRT-PCR 检测相关mRNA 表达情况
将培养在六孔板中药物处理后的细胞加入TRIzol 裂解,裂解完成后提取总RNA,测定浓度与纯度后根据反转录试剂盒的说明将总RNA 反转录成cDNA,最后取反转录完成的 cDNA 进行 qRTPCR 反应,以GAPDH作为内参。 引物序列见表1。

表1 各基因引物序列Table 1 Primer sequences of genes
1.3.6 Western blot 检测处理前后相关蛋白表达情况
将培养在六孔板中药物处理后的细胞加入RIPA裂解,裂解完成后离心取上清,使用BCA 试剂盒检测每组细胞的蛋白浓度,每组取15 μg 蛋白进行SDSPAGE 凝胶电泳,电泳结束后将其转移至NC 膜,封闭液封闭后加入一抗于4℃孵育过夜,一抗孵育结束后二抗室温孵育1 h,然后在曝光仪中进行曝光,Image J分析蛋白的表达量,以β-actin 作为内参。
1.4 统计学方法
采用SPSS 19.0 进行统计学分析,以平均数±标准差()表示结果。 采用单因素方差分析(ANOVA)进行组间比较,以P<0.05 认为差异有统计学意义。
2 结果
2.1 槲皮素可抑制口腔癌细胞的生长
图1 结果显示,在槲皮素刚作用于Tca-8113 细胞系时,对照组与槲皮素组具有相似的细胞增殖能力;给药后24 h 细胞的增殖能力较对照组出现下降,直到 48 h 达到最低(P<0.01)。 给药后 72 h,细胞增殖能力出现一定上升,但与48 h 相比没有差异(P>0.05),这种现象可能是与随着药物作用时间的增加药效出现降低有关。 从以上数据可以得出,槲皮素对Tca-8113 的增殖可能具有抑制作用,且在48 h 时效果较好,所以据此选用处理48 h 作为后续实验的作用时间。
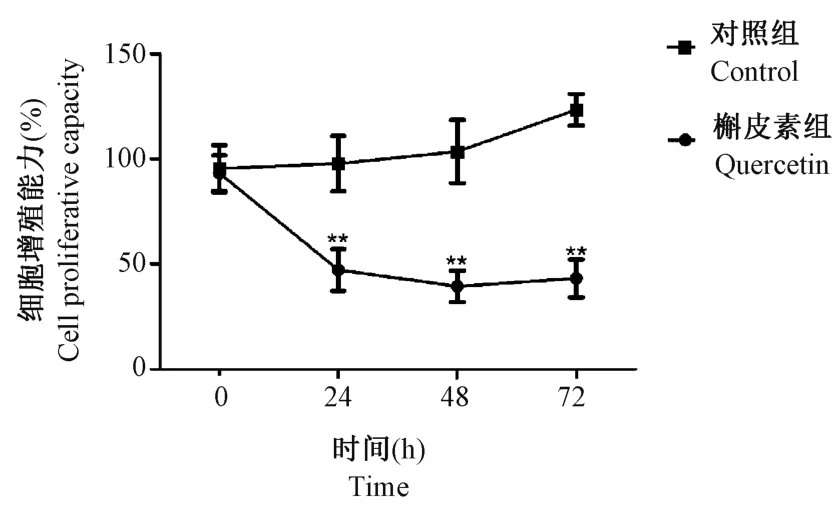
图1 CCK-8 实验检测槲皮素对Tca-8113 细胞增殖的影响Figure 1 CCK-8 assay was used to detect the effect of quercetin on Tca-8113 cell proliferation
2.2 槲皮素可抑制口腔癌细胞迁移和侵袭
图2A 显示,与对照组相比,槲皮素处理组Tca-8113 细胞迁移的数目减少,说明细胞的迁移能力显著降低(P<0.001);图2B 侵袭结果显示,槲皮素处理组Tca-8113 细胞侵袭的数目也出现下降,说明槲皮素也抑制细胞的侵袭能力(P<0.001),此结果表明槲皮素可以抑制Tca-8113 细胞的迁移与侵袭。
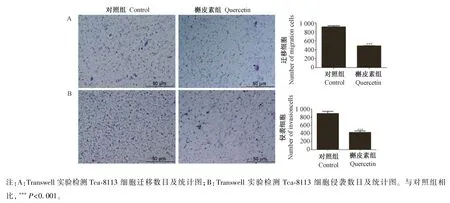
图2 Transwell(添加基质胶)检测Tca-8113 细胞的迁移(侵袭)能力Note. A, Transwell assay was used to detect the migration cell number and its statistics of Tca-8113. B, Transwell assay was used to detect the invasion cell number and its statistics of Tca-8113. Compared with control,***P<0.001.Figure 2 Transwell (add matrigel) to detect migration (invasion) ability of Tca-8113 cell
2.3 槲皮素处理前后细胞 PTEN、AKT、FOXO1、BCL2L11 的表达
如图3A 结果显示,与对照组相比,槲皮素处理组PTEN和BCL2L11 mRNA 表达水平均显著上调(P<0.05),但AKT和FOXO1 mRNA 表达水平无显著差异。 图3B 和3C 结果显示槲皮素处理组PTEN和BCL2L11 蛋白表达水平均显著上调(P<0.05),FOXO1 和AKT 磷酸化水平显著下调(P<0.01)。
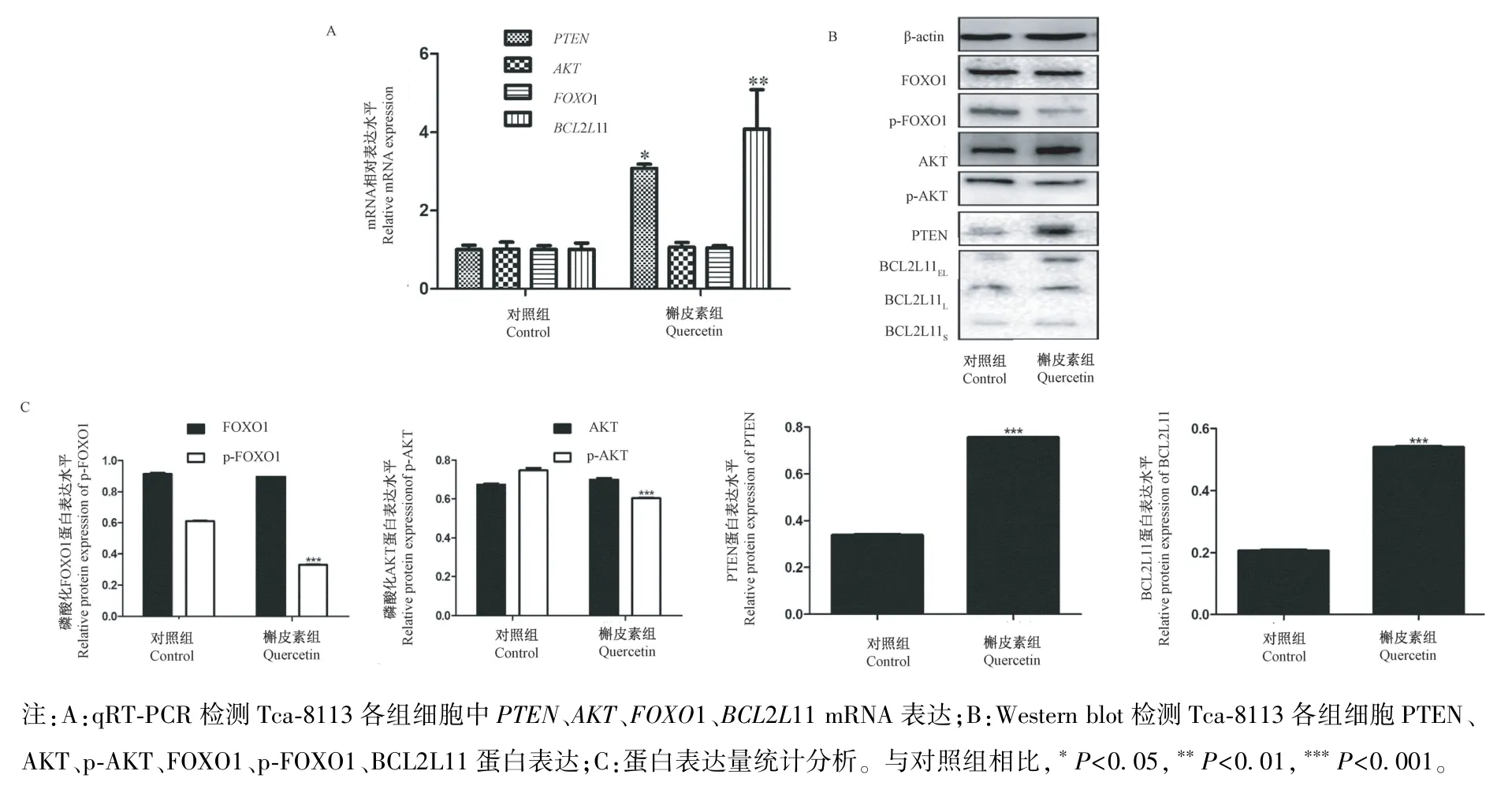
图 3 PTEN、AKT、FOXO1、BCL2L11 在 Tca-8113 各组细胞中的表达Note. A, The Tca-8113 cell mRNA expression of PTEN、AKT、FOXO1、BCL2L11 determined by qRT-PCR. B, The Tca-8113 cell potein expression of PTEN、AKT、p-AKT、FOXO1、p-FOXO1、BCL2L11 determined by Western blot. C, Statistical analysis of protein expression.Compared with control,*P<0.05,**P<0.01,***P<0.001.Figure 3 Expression of PTEN、AKT、FOXO1、BCL2L11 in Tca-8113 cell
3 讨论
口腔鳞状细胞癌(OSCC)是口腔癌中最为常见的一种类型,由于其发病部位位于口腔,通过外科手术切除病变会严重影响患者的美观,所以亟需一种合理的治疗方式[11]。 槲皮素是研究较多的一种中药单体,具有抗癌的潜力,已成为一种潜在的抗癌治疗剂[12]。 槲皮素被认为可以诱导包括口腔癌细胞在内的许多癌细胞的生长抑制和细胞死亡[5,10]。 本研究通过探讨槲皮素对口腔癌细胞生物学行为的影响,发现槲皮素可以显著抑制Tca-8113细胞的增殖、迁移及侵袭,以上研究与以往研究结果一致。
PTEN作为 PI3K/AKT 信号通路重要调控因子,是PI3K/AKT 信号通路的负调控蛋白,能够抑制PIP3 去磷酸化转变为PIP2,进而抑制AKT及其下游分子活化,阻止PI3K/AKT 通路激活[13-14]。 已有文献表明槲皮素可以调控PTEN的表达以及调控PI3K/AKT 通路诱导细胞凋亡[7,15]。 本研究利用qRT-PCR 和 Western blot 检测了PTEN和AKTmRNA 和蛋白水平表达,结果显示在槲皮素处理组中,口腔癌Tca-8113 细胞中PTENmRNA 和蛋白表达均上调,相反,AKT磷酸化水平显著下调。
FOXO1 属于叉形头转录因子的O 亚型,充当肿瘤抑制因子,调节许多涉及凋亡反应、细胞周期调控、细胞分化和细胞代谢的生物学过程[16]。 作为主转录因子,FOXO1 通过PI3K/AKT 信号通路进行调节,然后活化的AKT 促使FOXO1 S256 位点处磷酸化(p-FOXO1),从而驱动自身与14-3-3 二聚体结合,最后FOXO1 从细胞核输出到细胞质[17-18]。 本研究结果显示,槲皮素处理组中,FOXO1 在mRNA水平上无显著差异,但FOXO1 磷酸化水平显著降低,与 AKT 表达相一致。BCL2L11 是BCL2 家族近年来颇受关注的一个含有BH3 结构域的成员,该结构域对促进凋亡有重要作用,在许多抗肿瘤药物引起的肿瘤细胞凋亡中都观察到BCL2L11 表达的升高[19]。 有研究表明磷酸化FOXO1 负调控BCL2L11的表达,当位于BCL2L11 启动子附近的两个保守的FOXO1 结合位点发生突变以防止FOXO1 结合时,这一点就基本消失了,证明了BCL2L11 基因是FOXO1 直接的靶标[20-22]。 本研究结果显示槲皮素处理组BCL2L11 mRNA 和蛋白水平表达均显著上调。 这提示我们槲皮素对PI3K/AKT 信号通路具有负调控作用。
综上所述,槲皮素可抑制口腔癌Tca-8113 细胞增殖、迁移及侵袭能力,其机制可能是通过上调PTEN的表达,负调控PI3K/AKT 通路减弱FOXO1的磷酸化水平,进而引起BCL2L11 的表达增加实现的。

