葛根素减轻辐射诱发的大鼠急性肠黏膜损伤的实验研究
左振魁韩佳瑞*计树灵贺璐璐段晓宇范 飒祝康杰
(1.河南省中医院(河南中医药大学第二附属医院)肛肠科,郑州 450000;2.河南中医药大学,郑州 450000)
放疗是恶性肿瘤治疗的最重要的策略之一,大约有一半的癌症患者接受放疗[1]。 尽管放疗对恶性肿瘤有确切的疗效,但放疗也会引起正常组织的毒性反应,这其中就包含了胃肠道消化系统、造血系统和脑血管系统的急性放射综合症[2-3]。 高剂量(≥9 Gy)的全身辐射会触发急性胃肠道毒性,甚至可能会导致患者的死亡[4-5]。 据报道[6-7],辐射可以引起正常细胞氧化应激损伤和炎症反应,并甚至导致正常细胞坏死。 肠道对放射线高度敏感,因此放射线导致的肠道上皮和内皮损伤在急性放射反应的发展中起重要作用[8]。
葛根素(puerarin,Pue)是从葛根的根茎中提取的具有药理活性的化合物[9]。 Pue 具有包括缓解胰岛素抵抗、抗氧化应激、抗炎、抗心肌损伤等广泛的生物活性,并已被当作替代药物来治疗各种代谢性、炎症性和心血管疾病[10-12]。 先前已有报道[13],Pue 对大鼠的电离辐射损伤具有保护作用,其保护机制可能与其抗氧化性有关。 然而,Pue 在辐射诱发的肠道损伤的具体作用机理仍不清楚。 因此,本研究的目的是对Pue 在保护大鼠免于辐射诱发的肠道损伤中的作用以及潜在的分子机制进行进一步的评估。
1 材料和方法
1.1 实验动物
24 只 7 周龄 SPF 级雄性 SD 大鼠(190~210)g购自河南省实验动物中心[SCXK(豫)2017-0001],将大鼠饲养在温度(20℃~25℃)和湿度(50% ~65%)的河南省中医院SPF 级动物房[SYXK(豫)2016-0008]的饲养笼中,每天进行明暗12 h/12 h循环,可自由获得食物和水。 所有动物实验步骤均经过河南省中医院动物伦理委员会批准(2016060101),并符合实验大鼠的3R 原则。
1.2 主要试剂与仪器
葛根素注射液(浙江康恩贝制药股份有限公司生产)购自本院门诊药房;血小板内皮细胞粘附分子1(platelet endothelial cell adhesion molecule 1,PECAM1)抗体(sc-1506)和 β 微管蛋白(β-tubulin)抗体(sc-8035)购于美国Santa Cruz Biotechnology公 司; 抗 原 Ki-67 ( Ki-67 antigen, Ki67) 抗 体(DRM004)购于美国Acris Antibodies 公司;闭合蛋白-1(Claudin-1)抗体(ab15098)购于美国Abcam 公司;闭锁小带蛋白-1(zonula occludens protein-1,ZO-1)抗体(21773-1)购于美国Proteinteck 集团公司武汉三鹰生物技术分公司;丙二醛(malonyldialdehyde,MDA)检测试剂盒(S0131) 和超氧化物歧化酶(superoxide dismutase,SOD)活性试剂盒(S0103)购自上海碧云天生物科技有限公司。 Clinac 2100C/D型线性加速器(Varian 公司,美国);Eclipse 80i 型荧光显微镜(Nikon 公司,日本);I170-4500 型垂直电泳电转仪(Bio-Rad 公司,美国)。
1.3 实验方法
1.3.1 实验分组与处理
适应性饲养3 d 后,将大鼠随机分为对照组(control,Con)、单纯辐射组(radiation,RT)和辐射+葛根素组(RT+Pue),每组8 只大鼠。 通过单剂量12 Gy 下腹部照射构建辐射诱发的大鼠肠损伤模型,步骤简述如下:将大鼠固定在手术板上(不使用麻醉剂),用遮板(钻一个直径3 cm 圆孔,用于暴露大鼠下腹部)覆盖大鼠,并利用Clinac 2100C/D 型线性加速器(6 MV X 射线,剂量率4 Gy/min,源距100 cm)单剂量12 Gy 照照放射大鼠下腹部。 对照组大鼠使用遮板完全覆盖身体,单纯辐射组和辐射+葛根素组大鼠采用上述照射方式进行辐射。 辐射结束后,辐射+葛根素组大鼠采用尾静脉注射15 mg/(kg·d)(临床实践中人用药剂量通过体表转换所得)葛根素,连续给药7 d;对照组和单纯辐射组大鼠采用相同方式在相同时间段通过尾静脉注射等体积的生理盐水。
1.3.2 样品采集
第8 天,麻醉大鼠后,断头处死,收集大鼠小肠的空肠段。 根据实验设计,空肠组织被分为两个部分。 一部分空肠组织固定在10%的中性缓冲多聚甲醛中,制作石蜡包埋组织,被制备4 μm 厚的空肠组织切片,以用于后续组织学和免疫组化检测;另一部分空肠组织直接冻存在-70℃,以用于后续免疫印迹分析。
1.3.3 病理形态学观察
取空肠石蜡切片,经脱蜡、再水化后,行常规苏木精-伊红(hematoxylin-eosin,HE)染色。 每只大鼠任取4 个不同的空肠切片在Eclipse 80i 显微镜白光视野下观察,并采用随机视野拍照。 通过Image J 软件计数空肠横断面中的隐窝计数和杯状细胞密度数并测量肠绒毛长度。
1.3.4 免疫组化染色
每只大鼠任取4 个不同的空肠切片,经脱蜡、再水化、3% H2O2阻断内源性过氧化物酶和封闭非特异性蛋白后,室温孵育一抗(PECAM1,1 ∶100 稀释;Ki67,1 ∶200 稀释)2 h,甩干并用 PBS 洗 5 min × 5次,室温孵育二抗30 min,甩干并用PBS 洗5 min ×5 次,DAB 显色5 min,苏木精复染15 s,0.1% HCl分化、蓝化、脱水干燥和透明后,Eclipse 80i 显微镜白光视野下观察,并采用随机视野拍照,用Image J软件统计阳性信号值。
1.3.5 免疫印迹分析
通过蛋白印迹法检测紧密连接(tight junction,TJ)蛋白 claudin-1 和ZO-1 的表达。 取空肠组织并用RIPA 裂解液在4℃下匀浆。 匀浆液在4℃下以1.4×105r/min 离心 15 min 后,收集总蛋白。 蛋白定量后,取25 mg 蛋白在10% SDS 聚丙烯酰胺凝胶行电泳分离,并电转移到PVDF 膜上。 用5%脱脂奶粉封闭膜后,将膜与一抗(Claudin-1,1 ∶1000 稀释;ZO-1,1 ∶2000 稀释;β-tubulin,1 ∶5000 稀释)在室温下孵育 2 h,洗涤后,将膜用 HRP 偶联的二抗(1 ∶4000 稀释)在室温下孵育1.5 h,洗涤后,用化学发光法对蛋白条带显影。 用Image J 软件对条带进行光密度值测定,并将目标蛋白的光密度值相对于β-tubulin光密度值进行标准化。
1.3.6 SOD 活性和MDA 水平测定
取空肠组织并用RIPA 裂解液在4℃下匀浆。取匀浆液进行蛋白定量后,按照试剂盒说明书步骤,进行测量组织中的SOD 活性和MDA 水平。 反应结束后,用酶标仪测量波长450 nm(SOD)和530 nm(MDA)处的吸光度值,并根据预制的标准曲线计算单位重量(mg)蛋白含量的SOD 活性和MDA 水平,表示为 U/mg 蛋白(SOD) 和 nmol/mg 蛋白(MDA)。
1.4 统计学方法
2 结果
2.1 葛根素对辐射下的空肠病理形态学改变的影响
如图1 所示,对照组绒毛排列整齐且较长(图1A、1J),在绒毛底部有大量隐窝(图1D、1K)且隐窝内杯状细胞数正常(图1D、1L)和基底层正常(图1G);与对照组比较,单纯辐射组绒毛排列紊乱且长度明显缩短(P<0.001)(图1B、1J)、隐窝数明显减少(P<0.01)(图1E、1K)且隐窝内杯状细胞数明显增加(P<0.001)(图 1E、1L)和基底层增厚(图1H);与单纯辐射组比较,辐射+葛根素组绒毛排列趋向整齐且长度明显增加(P<0.01)(图1C、1J)、隐窝数明显增加(P<0.01)(图1F、1K)且隐窝内杯状细胞数明显减少(P<0.01)(图1F、1L)和基底层变薄(图1I)。

图1 葛根素改善辐射造成的空肠病理学改变Note. A-I, Representative HE staining images in various groups. J-L, Statistical results of villus length (J), crypt count (K) and goblet cell count in crypt (L). n= 8. Compared with control (Con) group,##P<0.01,###P<0.001. Compared with radiation (RT) alone group,**P<0.01.Figure 1 Puerarin improves the pathological changes of jejunum caused by radiation
2.2 葛根素对辐射下空肠中Ki-67 分布与表达的影响
如图2A 显示,对照组大多数隐窝中观察到弱的K-i67 染色;单纯辐射组仅有少部分隐窝显示少量K-i67 阳性染色;辐射+葛根素组显示大量隐窝中有较强的Ki-67 染色。 与对照组比较,单纯辐射组空肠中Ki-67 表达明显降低(P<0.001);与单纯辐射组比较,辐射+葛根素组空肠中Ki-67 表达明显增加(P<0.001),见图2B。

图2 葛根素促进辐射下空肠组织中Ki-67 表达并改善其分布Note. A, Representative immunohistochemical staining images of Ki-67 in various groups. B, Relative gray values of Ki-67 expression. n= 8. Compared with control (Con) group, ###P<0.001. Compared with radiation (RT) alone group,***P<0.001.Figure 2 Puerarin promotes the expression and improves the distribution of Ki67 in jejunum tissues under radiation
2.3 葛根素对辐射下空肠绒毛中PECAM1 分布与表达的影响
如图3A 显示,对照组显示绒毛上皮细胞的表面结构正常,显示单个柱状完整上皮(即:PECAM1只在上皮细胞中大量表达);单纯辐射组显示绒毛上皮结构破坏、上皮细胞大量丢失,且上皮细胞渗入固有层(即:上皮细胞标记物PECAM1 在固有层表达);辐射+葛根素组显示绒毛上皮结构趋向正常,上皮细胞数增多,渗入固有层中的上皮细胞数降低(即:固有层中PECAM1 阳性细胞数减少)。 与对照组比较,单纯辐射组空肠中PECAM1 表达明显降低(P<0.001);与单纯辐射组比较,辐射+葛根素组空肠中PECAM1 表达明显增加(P<0.001),见图3B。

图3 葛根素改善辐射诱发的空肠绒毛上皮结构紊乱Note. A, Representative immunohistochemical staining images of PECAM1 in various groups. B, Relative gray values of PECAM1 expression. n = 8. Compared with control (Con) group,###P<0.001. Compared with radiation (RT) alone group,***P<0.001.Figure 3 Puerarin improves the structure disorder of villous epithelium in jejunum induced by radiation
2.4 葛根素对辐射所致肠粘膜损伤的影响
蛋白免疫印迹结果显示,与对照组比较,单纯辐射组空肠中Claudin-1(图4A、4B)和ZO-1(图4A、4C)蛋白表达均明显降低(P<0.001);与单纯辐射组比较,辐射+葛根素组空肠中 Claudin-1(图4A、4B)和 ZO-1(图4A、4C)蛋白表达明显增加(P<0.001)。 进一步检查了葛根素对辐射所致肠组织氧化应激水平的影响,结果显示,与对照组比较,单纯辐射组空肠中SOD 活性明显降低(图4D)(P<0.001)和MDA 水平明显升高(图4E)(P<0.001);与单纯辐射组比较,辐射+葛根素组空肠中SOD 活性明显升高(图4D)(P<0.001)和MDA 水平明显降低(图4E)(P<0.01)。
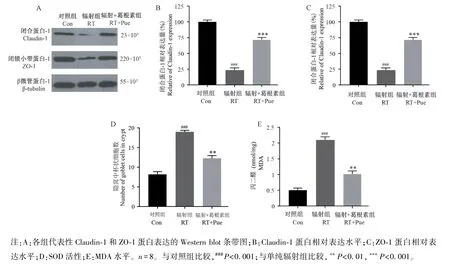
图4 葛根素改善辐射所致肠粘膜损伤Note. A, Western blot band images of the expression of Claudin-1 and ZO-1 proteins in various groups. B, Relative expression level of Claudin-1 protein. C, The relative expression level of ZO-1 protein. D,SOD activity. E,MDA level. n=8. Compared with control(Con) group,###P<0.001. Compared with radiation (RT) alone group,**P<0.01,***P<0.001.Figure 4 Puerarin improves intestinal mucosal damage caused by radiation
3 讨论
尽管放疗能使肿瘤患者获益,但放疗造成的正常组织损伤也不可忽视,并且,放疗损伤也是制约肿瘤放疗效果的主要问题之一[14]。 肠道对辐射高度敏感,胸、腹部和全身放疗均有可能引起肠道放疗综合症的发生[2-3]。 因此,缓解放疗造成的肠道粘膜损伤,不仅能减少放疗的肠道副作用,还可能增加肿瘤患者序贯放疗的治疗效果。 虽然,目前临床针对防治放疗造成的肠道损伤的药物颇多,但总体效果并不令人满意[15]。 因此,目前急需开发针对辐射后肠损伤新的有效的药物。
天然中草药提取物因效果显著且毒副作用低,引起了众多研究者的注意。 葛根素是从葛根的根茎中提取的具有药理活性的化合物[9],因其具有安全有效性而被临床广泛用作代谢性、炎症性和心血管疾病的替代药物[10-12]。 且先前的研究[13]表明,葛根素对实验大鼠的全身电离辐射损伤具有保护作用,但具体机制并不清晰且研究指标偏少,很多作用并不明确。 另外大量研究[16-17]提示,葛根素还具有潜在的抗肿瘤效应。 因此,推测葛根素可能是潜在的抗辐射损伤的优良防护剂。 因此,本研究进一步细致的观察葛根素对辐射造成的肠道损伤的影响并分析了其潜在的机制。 本研究结果显示,葛根素能增加辐射条件下的空肠组织的绒毛长度和隐窝数,并减少了隐窝中杯状细胞的密度。 为进一步解释葛根素能减少辐射造成空肠隐窝丢失的原因,本研究用免疫组化检测了空肠中增殖标志物Ki-67 的表达和分布。 由于肠干细胞和增殖性隐窝细胞位于隐窝[18]中,因此本研究通过隐窝中Ki-67 的表达来评估肠受损后的再填充活性,结果显示,葛根素治疗后,大量隐窝中有较强的Ki-67 表达,提示葛根素能促进辐射损伤的空肠的隐窝细胞再生。另外,本研究还利用PECAM1 标记内皮细胞观察了葛根素对辐射造成空肠绒毛上皮结构紊乱的影响,结果发现,葛根素能维持辐射条件下绒毛上皮结构,降低绒毛上皮损伤并减少绒毛上皮细胞丢失。以上结果充分显示了,葛根素能改善辐射造成的肠粘膜病理形态改变,保护绒毛外在和内在结构完整性和减少辐射造成的隐窝丢失并促进隐窝再生,促进损伤后黏膜恢复。
TJ 蛋白是细胞旁通透性的主要决定因素,它反映了组织中TJ 的完整性[18]。 肠损伤会导致肠内TJ蛋白的表达和分布发生变化,这也被称为功能性TJ(屏障功能)缺陷,且屏障完整性的丧失的最主要的特征正是TJ 的蛋白分解[18-21]。 有研究发现,X 射线诱发的大鼠回肠损伤后肠屏障功能减退主要体现在辐射导致 TJ(Claudin-1 和 ZO-1)的破坏[19]。本研究结果也体现了辐射后造成空肠Claudin-1 和ZO-1 表达降低,提示辐射造成肠屏障功能减退,使得肠道黏膜通透性增加;而葛根素能显著恢复辐射诱导的Claudin-1 和ZO-1 蛋白表达的降低,这进一步证实了葛根素对辐射诱导的肠损伤的保护作用。氧自由基的破坏是辐射引起的组织损伤的重要机制,MDA 水平和SOD 活性是组织过氧化程度的重要指标[22]。 本研究发现大鼠腹部辐射后,空肠组织MDA 水平升高,而SOD 活性显著下降,提示辐射造成肠道过氧化应激损伤;而葛根素治疗能增加空肠组织SOD 活性,并降低MDA 水平,提示葛根素能降低辐射造成肠道氧化应激损伤。 因此,葛根素减少氧化的作用可能在抑制辐射诱发的肠损伤和改善生存优势方面起重要作用。
这项研究表明葛根素可以通过促进TJ 蛋白(Claudin-1 和ZO-1)表达而维持肠道屏障完整性、减少氧化应激损伤、促进隐窝细胞再生和维持肠绒毛上皮结构完整性的作用来保护大鼠免受辐射诱发的肠道损伤。 因此,葛根素可能是预防辐射诱发的肠道损伤的有希望的候选药物。

