牡荆苷对MPTP 诱导的帕金森病模型小鼠行为学、神经递质及脑黑质多巴胺能神经元凋亡的影响
黄 鑫杨增艳黎 丽陈少锋
(广西国际壮医医院(壮瑶医药研究实验室,广西现代壮医药工程研究中心),南宁 530200)
帕金森病(parkinson’s disease,PD)是一种好发于中老年人群中的进行性神经系统疾病,主要临床表现为运动功能障碍、静息震颤、僵硬,且伴随抑郁、乏力、睡眠障碍,给患者身心健康造成极大影响[1]。 2018 年,全球共有 PD 患者近 11 亿人,男性高于女性。 据统计,我国65 岁以上老年人群中,PD的发病率约为1.7%,且随年龄增长其发病率也呈增加趋势[2]。 目前,包括美多芭、苯海索、恩他卡朋等西药是PD 患者常用的治疗药物,但这些药物只能减缓症状,并不能根治疾病,短期内疗效较好,但长期用药容易疗效减退,故而寻找治疗PD 的新药物显得尤为迫切。
PD 致病因素较多,发病机制也极为复杂,而氧化应激在PD 发病过程中扮演极为关键的作用[3]。氧化应激是机体受到刺激后,活性氧自由基(reactive oxygen species,ROS)大量生成,打破了机体氧化和抗氧化系统平衡,从而对组织和细胞产生损伤的反应过程。 由于脑组织富含对自由基敏感的多不饱和脂肪酸,故而容易发生脂质过氧化反应。 研究证实,脑内氧化应激产生的ROS 过度蓄积,可引起中脑黑质纹状体系统多巴胺(dopamine,DA)能神经元凋亡,DA 数量的减少,引起了脑内神经递质DA 分泌减少,从而产生一系列运动障碍症状[4]。 因此,抑制氧化应激可能会对脑内DA 神经元凋亡保护取得一定效果。
牡荆苷是分布于金莲花、布渣、山楂、光果甘草等多种植物中的黄酮碳苷类化合物,具有保护心脑血管、抑制神经炎症、抑制骨溶解和抗肿瘤等多种药理学作用[5-6]。 但迄今为止,尚未见牡荆苷对PD的研究报道。 研究报道,牡荆苷在急性脑缺血再灌注、异氟醚诱导的神经元凋亡模型、肺损伤中均有抗氧化应激的作用[4,7-8]。 那么牡荆苷能否通过抑制氧化应激,从而对PD 神经元凋亡损伤产生保护作用值得深入研究。 为此,本研究制备PD 模型小鼠,探讨牡荆苷对小鼠行为学、脑内黑质DA 能神经元和氧化应激损伤的保护作用,为牡荆苷的应用提供研依据。
1 材料和方法
1.1 实验动物
32 只 SPF 级雄性 C57BL/6 小鼠,体重22~24 g,2~ 3 月龄,购于广西医科大学实验动物中心[SCXK(桂)2019-0002]。 小鼠在广西国际壮医医院明秀分院实验动物房分笼饲养和取材[SYXK(桂)2019-0001],允许自由饮水,普通饲料喂养,饲养温度为(20±2)℃,相对湿度36%,12 h 昼夜节律。本次动物实验研究经广西国际壮医医院伦理委员会审批通过(GZL2020-019),并按实验动物使用的3R 原则给予人道的关怀。
1.2 主要试剂与仪器
超氧化物歧化酶(superoxide dismutase,SOD,批号:A001-3-2)、丙二醛(malondialdehyde,MDA)、谷胱甘肽-过氧化物酶(Glutathione peroxidase,GSHPx,批号:A003 - 1 - 1)、5-羟色胺(5-HT,批号:H104)、DA(批号:H170)、神经元特异性烯醇化酶(neuron specific enolase,NSE,批号:H240)、原位末端标记(TdT-mediated dUTP nick and labeling,TUNEL,批号:G002-1-2)试剂盒均购自南京建成生 物 工 程 研 究 所; 二 羟 基 苯 乙 酸( dihydroxyphenylacetic acid, DOPAC, 批 号:kt21794)、高香草酸(Homovanillic acid,HVA,批号:kt21801)、 胱 抑 素 C (cystatin C, Cys-C, 批 号:kt30088)ELISA 检测试剂盒购自武汉默沙克生物科技有限公司;B 淋巴细胞瘤-2(B cell lymphoma-2,Bcl-2,批号:ab194583)、凋亡相关因子Bcl-2 相关X蛋 白 ( Bcl-2 associated X protein, Bax, 批 号:ab182733)、半胱氨酸天冬氨酸蛋白酶-3(Cysteine aspartic acid protease-3,Caspase-3,批号:ab184787)和β-肌动蛋白(β-actin,批号:ab6276)单克隆抗体均购自英国Abcam 公司;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate.polyacrylamide gel electmphoresis,SDS-PAGE,批号:P0670)凝胶配置试剂盒、二喹啉甲酸(Bicinchoninic acid,BCA)蛋白浓度测定试剂盒(批号:P0012S)和聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF,批号:FFP24)均购自江苏碧云天生物公司;牡荆苷(HPLC≥95%,批号:11027-63-7)、1-甲基-4-苯基-1,2,3,6-四氢吡啶 ( 1 - methyl-4 - phenyl-1, 2, 3, 6 -tetrahydropyridine,MPTP,批号:5063820001) 购于Sigma 公司;美多芭片(批号:981969),上海罗氏制药有限公司生产。
1.3 实验方法
1.3.1 分组、造模及药物干预
32 只小鼠随机分为空白组、模型组、阳性药物(美多芭)组、牡荆苷组,每组8 只。 空白组注射生理盐水,其余各组均按30 mg/kg 剂量腹腔注射MPTP(40 mg/mL),连续7 d。 建模成功后,美多芭组灌胃1.67 mg/kg 美多芭片,牡荆苷组灌胃20 mg/kg 牡荆苷,空白组、模型组灌胃等量生理盐水,连续治疗30 d。
1.3.2 行为学检测
在造模前,造模后、治疗后分别对各组小鼠的以下行为学进行检测。 每只小鼠测试之前每天训练 3 次,连续 3 d。
(1)爬杆实验
制作一个直径为1 cm、长0.6 m 的光滑不锈钢杆,在杆中央做一条标记线,将杆垂直固定于一水平平面,将小鼠头向下放置在杆的顶部,使其沿杆自然爬下,对小鼠下滑行为进行评分,爬杆实验评分标准:0 分,四肢并用,一次顺利从杆上爬下;0.5 分,一次性从杆上爬下,但后肢出现滑行;1分,上杆后停顿数次后爬下;1.5 分,滑行后滑落,有轻微震颤;2 分,震颤明显,四肢僵直,不能抓杆,直接掉落;2.5 分,连续震颤,四肢麻痹,不能活动或死亡[9]。
(2)游泳实验
在长90 cm,宽80 cm 的玻璃水箱中注入水,使水深达到20 cm,水温为(25±2)℃,进行1 min 游泳实验。 游泳实验评分标准:3 分,期间持续游泳;2.5分,期间大部分时间游泳;2 分,期间一般以上时间在游泳;1.5 分,偶尔游泳;1 分,偶尔用后肢游泳;0.5 分,出现连续震颤,不能活动或死亡[9]。
1.3.3 组织取材
行为学观察结束后,小鼠用2%戊巴比妥钠按1.5 mL/kg 剂量腹腔注射麻醉,取外周血后,脱颈椎处死小鼠,取含脑黑质的脑组织,置于4%多聚甲醛中固定,部分大脑黑质置于-80℃保存备用。
1.3.4 酶联免疫吸附法(ELISA)测定血清Cys-C、NSE 和脑组织中神经递质含量
将各组小鼠外周血在4℃条件下,以3000 r/min离心10 min,分离血清。 取小鼠脑组织进行组织匀浆,超声破碎,在4℃条件下,以10000 r/min 离心20 min,去上清。 严格按照试剂盒操作说明,采用ELISA 法检测血清中Cys-C、NSE 含量,以及脑组织中 DA、DOPAC、HVA、5-HT 含量。
1.3.5 分光光度法检测脑组织中SOD、MDA、GSHPx 含量
取分离得到的脑组织匀浆上清,根据试剂盒操作说明检测脑黑质匀浆上清液中 MDA、SOD 及GSH-Px 的水平。
1.3.6 Tunel 染色检测脑黑质中DA 能神经元细胞凋亡水平
取固定脑组织,梯度乙醇脱水,石蜡包埋,行4 μm 切片,常规脱蜡至水,滴加 20 μg/mL 现配的蛋白酶K,37℃孵育20 min,PBS 洗涤,1%山羊血清封闭30 min,使TdT 酶反应液覆盖载玻片,37℃孵育20 min,辣根过氧化物酶(HRP)孵育,PBS 洗涤,滴加DAB 染色1 min,流水冲洗,苏木素复染、二甲苯脱水透明,中心树胶封片,在400 倍显微镜下观察采集图像,细胞核呈棕色表示阳性细胞。 在6 个视野下计数计算平均阳性率。
1.3.7 蛋白免疫印迹法(Western blot)检测脑黑质中 Bcl-2、Bax、Caspase-3 蛋白表达
取小鼠脑组织,用预冷的裂解液提取总蛋白,BCA 法对各组蛋白样品进行定量,取50 μg 蛋白样品进行SDS-PAGE 电泳,电泳结束后,将蛋白湿转至PVDF 膜,5%脱脂牛奶室温封闭2 h,用 Bcl-2(1 ∶2000)、Bax(1 ∶1000)、Caspase-3(1 ∶2000) 抗体于4℃孵育过夜,TBST 洗涤,用HRP 标记的二抗室温孵育1 h,TBST 洗涤后,化学发光显影,凝胶图像处理系统分析数据。
1.4 统计学方法
使用SPSS 20.0 软件进行数据处理,结果以平均数±标准差()表示,多组间比较采用单因素方差分析,两组之间比较采用独立样本t检验(LSD-t)。P<0.05 为差异有统计学意义。
2 结果
2.1 牡荆苷对小鼠行为学的影响
各组小鼠造模前爬杆实验和游泳实验评分比较,均无统计学差异(P>0.05);造模后,与空白组相比,模型组、美多芭组、牡荆苷组小鼠爬杆实验评分显著升高(P<0.05),游泳实验评分显著降低(P<0.05);治疗后,与模型组相比,牡荆苷组小鼠爬杆实验评分显著降低(P<0.05),游泳实验评分显著升高(P<0.05),与美多芭组相比,牡荆苷组小鼠爬杆实验和游泳实验评分无显著差异(P>0.05),见图1。

图1 牡荆苷对小鼠行为学的影响(,n=8)Note. A, Climbing experiment score. B, Swimming experiment score. Compared with control group,**P<0.01. Compared with model group,#P<0.05.Figure 1 Effect of vitexin on the behavior of mice
2.2 牡荆苷对小鼠血清中Cys-C 和NSE 水平的影响
ELISA 实验结果显示,与空白组相比,模型组小鼠血清中Cys-C 水平降低,NSE 水平升高,差异有统计学意义(P<0.01);与模型组相比,美多芭组、牡荆苷组小鼠血清中Cys-C 水平升高,NSE 水平降低,差异有统计学意义(P<0.05);与美多芭组相比,牡荆苷组小鼠血清中Cys-C 和NSE 水平无显著性差异(P>0.05),见图 2。

图2 牡荆苷对小鼠血清中Cys-C 和NSE 的影响(,n=8)Note. A,Levels of Cys-C and NSE in mice serum. B,Levels of NSE in mice serum. Compared with control group,**P<0.01. Compared with model group,##P<0.01.Figure 2 Effect of vitexin on the the levels of Cys-C and NSE in mice serum
2.3 牡荆苷对小鼠脑黑质中 DA、DOPAC、HVA和5-HT 水平的影响
与空白组比较,模型组小鼠脑黑质中神经递质DA、OPAC、HVA 和 5-HT 水平降低,差异有统计学意义;与模型组比,美多芭组、牡荆苷组小鼠脑黑质中 DA、OPAC、HVA 和 5-HT 水平升高,差异均有统计学意义(P<0.05);与美多芭组相比,牡荆苷组小鼠脑黑质中5-HT 水平升高,差异有统计学差异(P<0.05),见表 1。
表1 牡荆苷对儿茶酚胺类神经递质水平的影响(,n=8)Table 1 Effects of vitexin on the levels of catecholamine neurotransmitters

表1 牡荆苷对儿茶酚胺类神经递质水平的影响(,n=8)Table 1 Effects of vitexin on the levels of catecholamine neurotransmitters
注:与空白组比,**P<0.01;与模型组比,##P<0.01,#P<0.05;与美多芭组比,&P<0.05。Note. Compared with control group,**P<0.01. Compared with model group,##P<0.01,#P<0.05. Compared with pramipexole group,&P<0.05.
组别 Groups DA(μg/L) DOPAC(μg/L) HVA(μg/L) 5-HT(μg/L)空白组 Control group 4.36±0.24 26.16±2.76 31.40±4.05 3.57±0.27模型组 Model group 1.96±0.52** 16.16±2.47** 21.00±2.22** 2.48±0.28**美多芭组 Pramipexole group 2.44±0.37# 18.18±1.35# 24.46±3.36# 2.80±0.15#牡荆苷组 Vitexin group 2.75±0.37## 18.96±1.42# 25.29±3.52# 3.12±0.29##&
2.4 牡荆苷对小鼠脑黑质中SOD、MDA、GSH-Px水平的影响
与空白组比,模型组小鼠脑黑质中 SOD 和GSH-Px 水平降低,MDA 水平升高,差异有统计学意义(P<0.01);与模型组比较,美多芭组、牡荆苷组小鼠脑黑质中SOD 和GSH-Px 水平升高,MDA 水平降低,差异均有统计学意义(P<0.01 或P<0.05);与美多芭组相比,牡荆苷组小鼠脑黑质中 SOD 和GSH-Px 水平升高,MDA 水平降低,差异有统计学差异(P<0.05),见表2。
表2 牡荆苷对氧化应激因子水平的影响(,n=8)Table 2 Effects of vitexin on the levels of oxidative stress factor

表2 牡荆苷对氧化应激因子水平的影响(,n=8)Table 2 Effects of vitexin on the levels of oxidative stress factor
注:与空白组比,**P<0.01;与模型组比,##P<0.01,#P<0.05;与美多芭组比,&P<0.05。Note. Compared with control group,**P<0.01. Compared with model group,##P<0.01,#P<0.05. Compared with pramipexole group,&P<0.05.
组别Groups SOD(U/mg) MDA(mmol/mg) GSH-Px(U/mg)空白组 Control group 184.37±9.30 2.15±0.19 74.97±3.19模型组 Model group 115.10±12.84** 6.34±0.58** 45.8±8.08**美多芭组 Pramipexole group 149.88±7.69## 4.65±0.60## 52.10±3.83#牡荆苷组 Vitexin group 163.83±15.81##& 4.08±0.38##& 57.02±7.17##&
2.5 牡荆苷对小鼠脑黑质中多巴胺能神经元凋亡率的影响
与空白组比,模型组小鼠脑黑质多巴胺能神经元凋亡率升高,差异有统计学差异(P<0.01);与模型组比,美多芭组、牡荆苷组小鼠脑黑质多巴胺能神经元凋亡率降低,差异均有统计学意义(P<0.01);与美多芭组比,牡荆苷组小鼠脑黑质多巴胺能神经元凋亡率降低,差异有统计学差异(P<0.05),见图3。
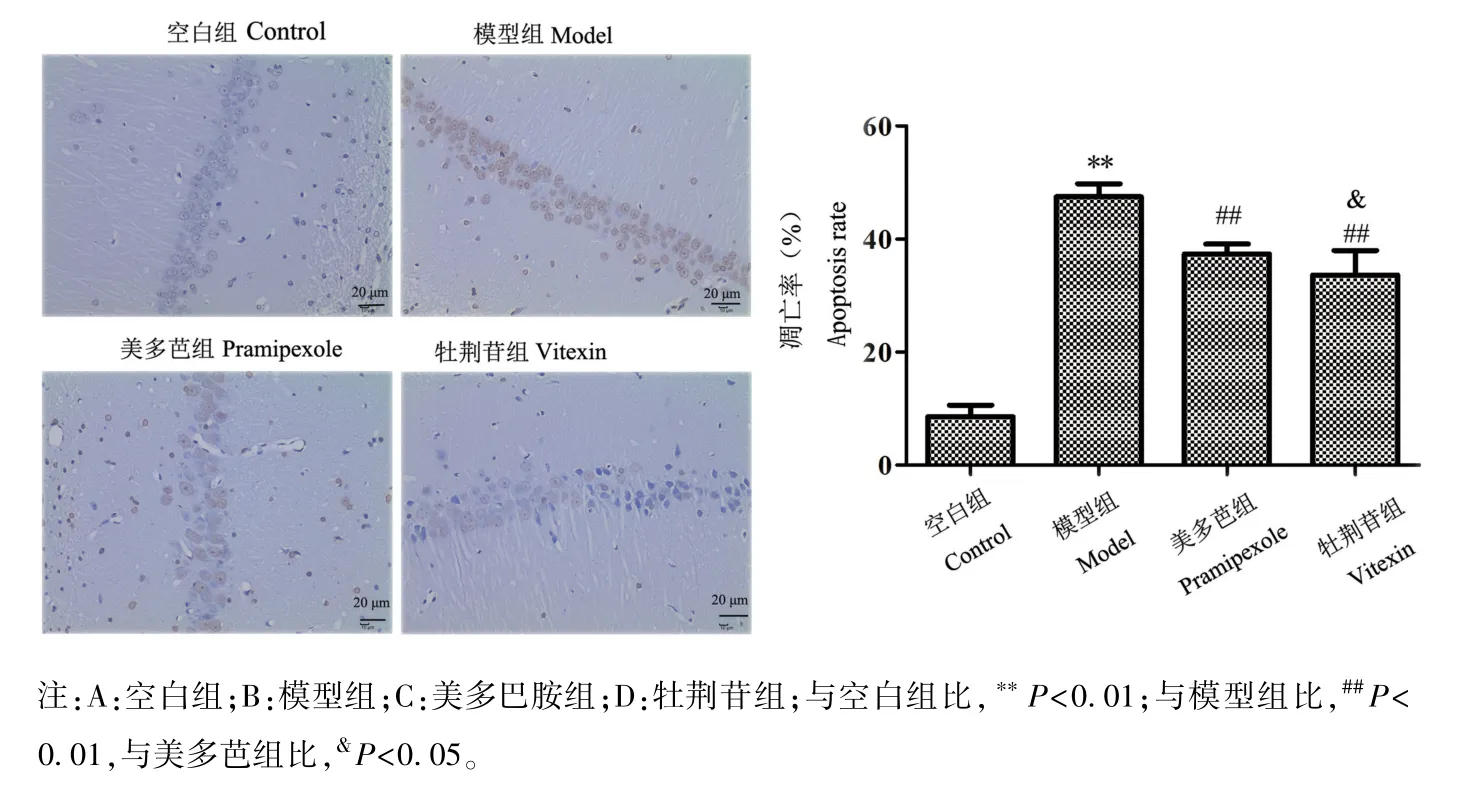
图3 牡荆苷对小鼠脑黑质中多巴胺能神经元凋亡率的影响(,n=8)Note. A, Control group. B, Model group. C, Pramipexole group. D, Vitexin group. Compared with control group,**P<0.01. Compared with model group,##P<0.01,#P<0.05. Compared with pramipexole group,&P<0.05.Figure 3 Effects of vitexin on the apoptosis rate of neurons in mice
2.6 牡荆苷对小鼠脑黑质中 Bcl-2、Bax、Cleaved caspase-3 蛋白表达的影响
与空白组比,模型组小鼠脑黑质中Bax、Cleaved caspase-3 蛋白表达量升高,降低,差异有统计学差异(P<0.01);与模型组比,美多芭组、牡荆苷组小鼠脑黑质中Bax、Cleaved caspase-3 蛋白表达降低,Bcl-2 蛋白表达量升高,差异均有统计学意义(P<0.01或P<0.05);与美多芭组比,牡荆苷组小鼠脑黑质中 Bax、Cleaved caspase-3 蛋白水平降低,Bcl-2 蛋白表达量升高,差异有统计学差异(P<0.05),见图4。表明美多芭和牡荆苷均能提高PD 模型小鼠脑黑质中 Bax、Cleaved caspase-3 蛋白表达,并降低 Bcl-2 蛋白表达量,且牡荆苷调控作用优于美多芭。

图4 牡荆苷对小鼠脑黑质中Bcl-2、Bax、Cleaved caspase-3 蛋白表达的影响(,n=8)Note. Compared with control group,**P<0.01. Compared with model group,##P<0.01. Compared with pramipexole group,&P<0.05.Figure 4 Effects of vitexin on the expression of Bcl-2, Bax and Cleaved caspase-3 proteins of neurons in mice
3 讨论
PD 是一种常见的神经退行性疾病,以震颤,僵直,运动迟缓和步态失调伴姿势不稳等运动障碍为主要临床表现。 美多芭是老年PD 患者的常用药,患者长期服用该药物后疗效会越来越差,且药物的不良反应明显。 因此,开发安全、有效的治疗PD 的药物迫在眉睫。 已有研究表明,牡荆苷对MPTP 诱导的人神经母细胞瘤细胞毒性和细胞增殖有抑制作用,并对急性脑缺血再灌注小鼠神经功能具有保护作用[10]。 然而牡荆苷对PD 引起的运动功能障碍和神经功能损伤的保护作用鲜有报道。 本实验着重探讨牡荆苷对MPTP 诱导PD 模型小鼠的保护作用以及机制。
爬杆实验和游泳实验是PD 动物模型最常用的行为学检测方法,对动物协调运动能力具有较好的检测效果。 研究证实MPTP 诱导的PD 小鼠模型由于纹状体DA 的特异性改变,可出现与人类PD 患者类似的运动障碍[11]。 本研究结果发现,模型组小鼠爬杆实验评分显著升高,游泳实验评分显著降低,说明PD 模型制备成功,符合PD 临床症状。 经过牡荆苷和美多巴干预后,爬杆实验评分降低,游泳实验评分升高,表明牡荆苷对PD 小鼠的运动功能障碍具有保护作用。
Cys-C 是半胱氨酸蛋白酶的抑制剂,属于半胱氨酸蛋白酶抑制剂超家族Ⅱ家族成员,其广泛存在于哺乳动物各种组织的有核细胞和体液中,其水平增加可以保护神经元免受外源性刺激造成的细胞毒性伤害[12]。 NSE 是烯醇化酶基因超家族成员之一,存在于神经元和神经内分泌细胞胞质内[13]。 神经元损伤后,神经细胞将NSE 分泌到细胞外,其水平随着神经退行性紊乱的进展而增加。 神经递质DA、DOPAC、HVA、5-HT 含量的变化是 PD 临床诊断的主要指标之一,也是评价治疗是否有效的客观指标。 PD 发生后纹状体中DA 的进行性下降是引起运动症状的主要原因,而HVA 和DOPAC 是DA的中间产物和最终产物,游离的HVA 和DOPAC 具有神经毒性,其可加重神经元细胞损伤[14]。 5-HT神经元胞体内神经纤维广泛分布,其可以吸收外源左旋多巴药物并转化为DA。 当5-HT 能系统传递功能发生障碍时将引起静息震颤并诱发运动障碍。为了进一步阐明牡荆苷对PD 的治疗效果,检测了各组小鼠上述指标的变化情况。 结果显示,与空白组小鼠相比,模型组小鼠血清Cys-C 含量显著减少,而NSE 含量显著增加,提示PD 模型的神经细胞受损明显。 用牡荆苷和美多巴治疗后,血清Cys-C 含量显著升高,NSE 含量显著降低,说明牡荆苷对PD模型小鼠神经元损伤具有一定的保护作用。 此外,模型组小鼠的 DA、DOPAC、HVA、5-HT 含量比正常小鼠显著减少,进一步说明PD 模型的神经细胞受损明显。 经过牡荆苷和美多巴干预后,DA、DOPAC、HVA、5-HT 水平升高。 以上实验结果表明牡荆苷对PD 模型小鼠神经递质变化有调节作用。
氧化应激损伤被认为是PD 中导致神经元退行性变的重要原因[15]。 在PD 患者病情进展中脑组织氧自由基大量产生和氧自由基清除系统的缺陷可导致多巴胺能神经元死亡。 MDA 是脂质过氧化醛类最终产物之一,可反映氧自由基水平和反映细胞损伤的程度。 SOD 和GSH-Px 是机体重要的抗氧化酶,能清除超氧阴离子自由基和脂质过氧化物,具有保护细胞免受氧化损伤的作用[16],其含量和活性降低可导致体内的氧自由基清除障碍,加剧其对神经的毒性作用。 本研究发现PD 小鼠MDA 水平比正常小鼠显著增加,而SOD 和GSH-Px 水平比正常小鼠显著减少,说明PD 小鼠的神经细胞受到了氧化应激损害。 给予PD 小鼠牡荆苷和美多巴后能提高脑黑质 SOD 和 GSH-Px 的含量,降低 MDA 水平,改善脑黑质多巴胺能神经元的氧化应激状态,从而起到保护脑的作用,提示牡荆苷通过改善氧化应激损伤对PD 产生治疗效应。
PD 发病过程与黑质内神经元细胞凋亡关系密切,过多的神经细胞凋亡则会导致神经功能受到影响。 Bcl-2 家族是已知细胞凋亡中最重要的调控因子,Bcl-2 基因表达上升可抑制细胞凋亡,而Bax 基因表达上升可诱导细胞凋亡。 此外,Caspase-3 作为Caspase 家族成员之一,是细胞凋亡的关键执行基因。 通常情况下,Caspase-3 以非活化形式存在,当细胞凋亡途径激活后,Caspase-3 磷酸化为Cleaved caspase-3,细胞凋亡进入不可逆阶段。 Bcl-2/Bax 的比值降低导致线粒体膜电位下降,破坏了线粒体膜完整性和功能,从而导致细胞色素c 等凋亡因子释放,激活下游Caspase-3[17]。 本实验结果可知,模型组小鼠脑黑质中多巴胺能神经元凋亡率比正常组显著增加,Cleaved caspase-3 和Bax 蛋白表达显著升高,Bcl-2 蛋白表达显著下降,说明PD 模型的神经细胞发生凋亡;经过牡荆苷和美多巴治疗后,小鼠多巴胺能神经元凋亡水平下降,推测牡荆苷和美多巴可能通过上调Bcl-2 蛋白表达,下调Bax 蛋白表达,从而减少Cleaved caspase-3 活化,抑制脑黑质中多巴胺能神经元凋亡,最终起抑制脑损伤作用。 此外,牡荆苷抗神经元凋亡作用显著优于美多巴,这进一步提示牡荆苷对PD 模型小鼠神经元凋亡具有保护作用。
综上所述,牡荆苷对MPTP 诱导的PD 模型小鼠具有一定的神经保护作用,体现为减缓运动功能障碍和调节神经递质变化,作用机制与抑制多巴胺能神经元氧化应激损伤和减少神经元凋亡有关,其可能成为防治PD 的有效药物。

