牛乳清蛋白源脂肪酶抑制肽的制备及影响因素研究
梁莎,畅姝怡,齐元锦,李志成
(西北农林科技大学食品科学与工程学院,陕西 杨凌712100)
0 引 言
乳源活性肽具有抗氧化、降血压、增强免疫力等作用[1],已成为科研工作者研究的一大热点。乳清蛋白具有抗衰老[2]、提高免疫力[3]、维持肾功能[4]和促进创伤愈合[5]等功效,同时有助于防治心脑血管疾病[6]和消化系统疾病[7]。另一方面,对于热爱运动的人来说,乳清蛋白是一种优质蛋白源,它具有抗氧化作用[8],并能促进骨骼肌蛋白质的合成,有助于运动员训练后的体能恢复[9]。
以乳清蛋白为原料制备的活性肽具有降胆固醇、ACE抑制、免疫调节、抗菌、抗氧化、降血糖等多种有益于人体健康的功效[10-15]。肥胖是由于能量代谢失调导致脂肪累积而引起的一种不利于人体健康的状态[16]。比较常见的减肥方式主要包括运动减肥[17-18]、药物减肥[19-20]和食疗减肥[21-22]。其中食疗减肥展现出了许多明显优势,已受到越来越多肥胖患者的青睐。牛乳作为日常饮品,其乳清蛋白具有较高的可接受度[23-24]。美国农业部Beltsville人类营养研究中心发现,相比于大豆蛋白以及同等能量的碳水化合物,乳清蛋白具有较好的减肥效果[25]。美国田纳西大学营养学院主任Michael B Zemel研究证实:乳品中的乳清蛋白有助于燃烧多余脂肪,合理的控制体重。乳清蛋白中的营养成分可刺激肌肉组织的构建,而此过程也是脂肪燃烧的过程[26]。Pilvi等人研究发现,给肥胖小鼠喂养不同组分的乳清蛋白,可显著降低体脂含量[27]。Dudgeon等人研究发现,在运动前、运动中以及运动后给16名男性补充乳清蛋白,与补充碳水化合物相比,减少了体内脂肪含量,维持体重并增强肌肉力量[28]。但是乳清蛋白的什么成分如何控制体重的并不清楚。因此,本文将从减肥的角度,以乳清蛋白为材料,通过酶工程技术制备牛乳清蛋白源活性肽,探究其对胰脂肪酶和α-淀粉酶的抑制作用、影响因素及其模拟胃肠道消化,为减肥功能产品的研发和应用提供理论依据。
1 材料与方法
1.1 材料与试剂
牛浓缩乳清蛋白粉(蛋白质含量80%),四川天吉康晟贸易有限公司;中性蛋白酶、碱性蛋白酶、木瓜蛋白酶、胃蛋白酶,西安热默尔生物科技有限公司;胰蛋白酶、胰脂肪酶、还原型谷胱甘肽、α-淀粉酶,北京索莱宝科技有限公司;阿拉伯胶、脱氧胆酸钠、对硝基苯酚、对硝基苯酚棕榈酸酯,上海阿拉丁科技股份有限公司;可溶性淀粉,四川省彭州市军乐化工厂等。
1.2 仪器与设备
HH-6数显恒温水浴锅,常州国华电器有限公司;Sartorius PB-10 p H计,德国Sartorius公司;H 1650高速离心机,湖南湘仪实验室仪器开发有限公司;SB-5200DTD超声波清洗机,宁波新芝生物科技股份有限公司;L5紫外分光光度计,上海仪电分析仪器有限公司。
1.3 方法
1.3.1 牛乳清蛋白活性肽的制备
将浓缩牛乳清蛋白粉(质量分数80%)溶于蒸馏水中,可加少量NaOH溶液助溶,制备蛋白质浓度分别为10、20、30 mg/mL的牛乳清蛋白溶液。分别按照表1所示的胰蛋白酶、中性蛋白酶、碱性蛋白酶、木瓜蛋白酶以及胃蛋白酶等5种蛋白酶的最适酶解条件,对牛乳清蛋白溶液进行酶解,酶解完成后,将酶解液置于90℃水浴中加热灭酶10 min,然后水浴冷却至室温,10 000 g离心20 min,取上清液进行测试或保存于-20℃冰箱中。
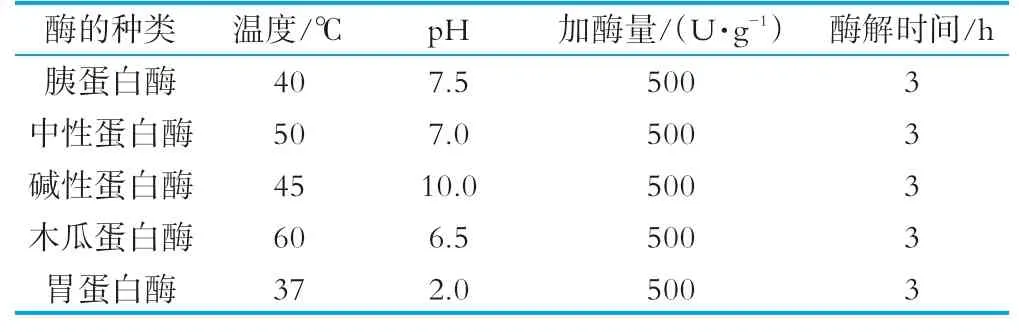
表1 5种蛋白酶的酶解条件
1.3.2 胰脂肪酶抑制率的测定
根据zheng[29]、Gupta[30]、李瑞霞[31]等人的方法以对硝基苯酚棕榈酸酯(PNPP)为底物采用分光光度法测定胰脂肪酶活性并计算抑制率。
1.3.3 α-淀粉酶抑制率的测定
根据让一峰[32]、Yang[33]等人的方法测定牛乳清蛋白源活性肽的α-淀粉酶的活性并计算抑制率。
1.3.4 牛乳清蛋白酶解工艺优化
以牛乳清蛋白源活性肽的胰脂肪酶抑制率为指标,筛选出酶解牛乳清蛋白效果最优的酶解温度、酶解时间和加酶量,进而确定脂肪酶抑制肽的酶解工艺。根据单因素试验结果,选择酶解温度、酶解时间和加酶量进行正交试验,确定牛乳清蛋白源活性肽的最佳制备工艺。
1.3.5 多肽含量的测定
根据鲁伟[34]的方法,并稍作修改。主要是将Gly-Gly-Tyr-Arg四肽修改为还原型谷胱甘肽(GSH),GSH的浓度与其溶液A540nm吸光度的曲线方程为y=10.03x-0.005(R2=0.9997),浓度范围为0~0.9 mg/mL。
1.3.6 乳清蛋白源活性肽抑制率的影响因素研究
将采用最优工艺制备的乳清蛋白源活性肽分别置于不同温度、pH值、光照、氧气和金属离子存在的条件下保持30 min,研究不同因素对乳清蛋白源活性肽活性的影响。
1.3.7 体外模拟胃肠液消化对乳清蛋白源活性肽抑制率的影响
根据Ruiz[35]等人的方法,并稍作修改。在20 mL乳清蛋白源活性肽溶液中加入3 mL 0.1 mg/mL模拟胃液,37℃水解2 h(模拟胃消化),用40%(w/w)的NaOH溶液调节p H到7.5,测定其对胰脂肪酶、α-淀粉酶的抑制率及多肽含量。同时取10 mL模拟胃消化之后的酶解液,在其中加入3 mL模拟肠液,37℃水解2.5 h(模拟小肠消化),沸水浴5 min后,冷却至室温,离心后测定其对胰脂肪酶、α-淀粉酶的抑制率及多肽含量。
1.4 数据处理
使用Excel 2016软件绘图,用SPSS 20.0统计软件进行数据处理,用最小显著性差异法进行多重比较,P<0.05表示差异显著。
2 结果与讨论
2.1 蛋白酶的筛选
由图1可知,当牛乳清蛋白溶液中蛋白质浓度为30 mg/m L时,五种常见蛋白酶的酶解液对胰脂肪酶都有一定的抑制作用,其中碱性蛋白酶酶解液对胰脂肪酶的抑制率为45.06±9.30%,均显著高于其他4种酶(P<0.05)。因此选择碱性蛋白酶进行后续试验。

图1 5种酶解液的胰脂肪酶抑制率
2.2 牛乳清蛋白浓度的选择
由图2可知,当牛乳清蛋白的浓度在20~60 mg/m L时,经碱性蛋白酶酶解所得的乳清蛋白源活性肽对胰脂肪酶和α-淀粉酶的抑制率随着蛋白质浓度的增加而增加,乳清蛋白浓度在60~80 mg/mL时抑制率稍有降低,浓度为60 mg/mL与100 mg/mL时抑制率较高。但试验过程中发现,当乳清蛋白质浓度为100 mg/m L时,酶解液基本呈现凝胶状,从节约资源,提高原料利用率的角度考虑,选择抑制率较高的60 mg/mL为乳清蛋白最适的酶解浓度。
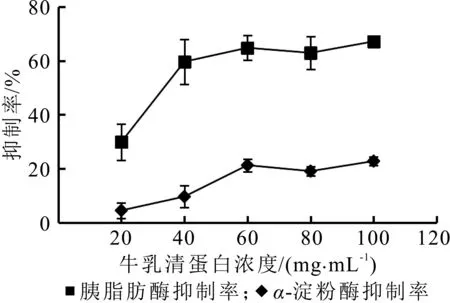
图2 牛乳清蛋白质浓度对酶抑制率的影响
2.3 酶解工艺优化
2.3.1 酶解温度
由图3可知,随着酶解温度的升高,牛乳清蛋白源活性肽对胰脂肪酶的抑制率先增加后降低,酶解温度为45℃时,胰脂肪酶抑制率最高,达到59.70±0.10%。温度较低时,酶解速率较慢,温度较高时,碱性蛋白酶的结构可能遭到破坏[36],因此选用45℃作为牛乳清蛋白最适酶解温度。

图3 酶解温度对胰脂肪酶抑制率的影响
2.3.2 酶解时间
由图4可知,当酶解时间为1~4 h时,随着酶解时间的延长,乳清蛋白源活性肽的抑制率逐渐增大,当酶解时间为4 h时达到最高为60.30±1.44%,可能是酶解物中对胰脂肪酶具有抑制作用的活性肽越来越多;当酶解时间为4~5 h,胰脂肪酶抑制率降低,可能是短链的多肽片段被继续水解为氨基酸[37]或其他没有胰脂肪酶抑制活性的肽段。因此,选择4 h为牛乳清蛋白的最适酶解时间。
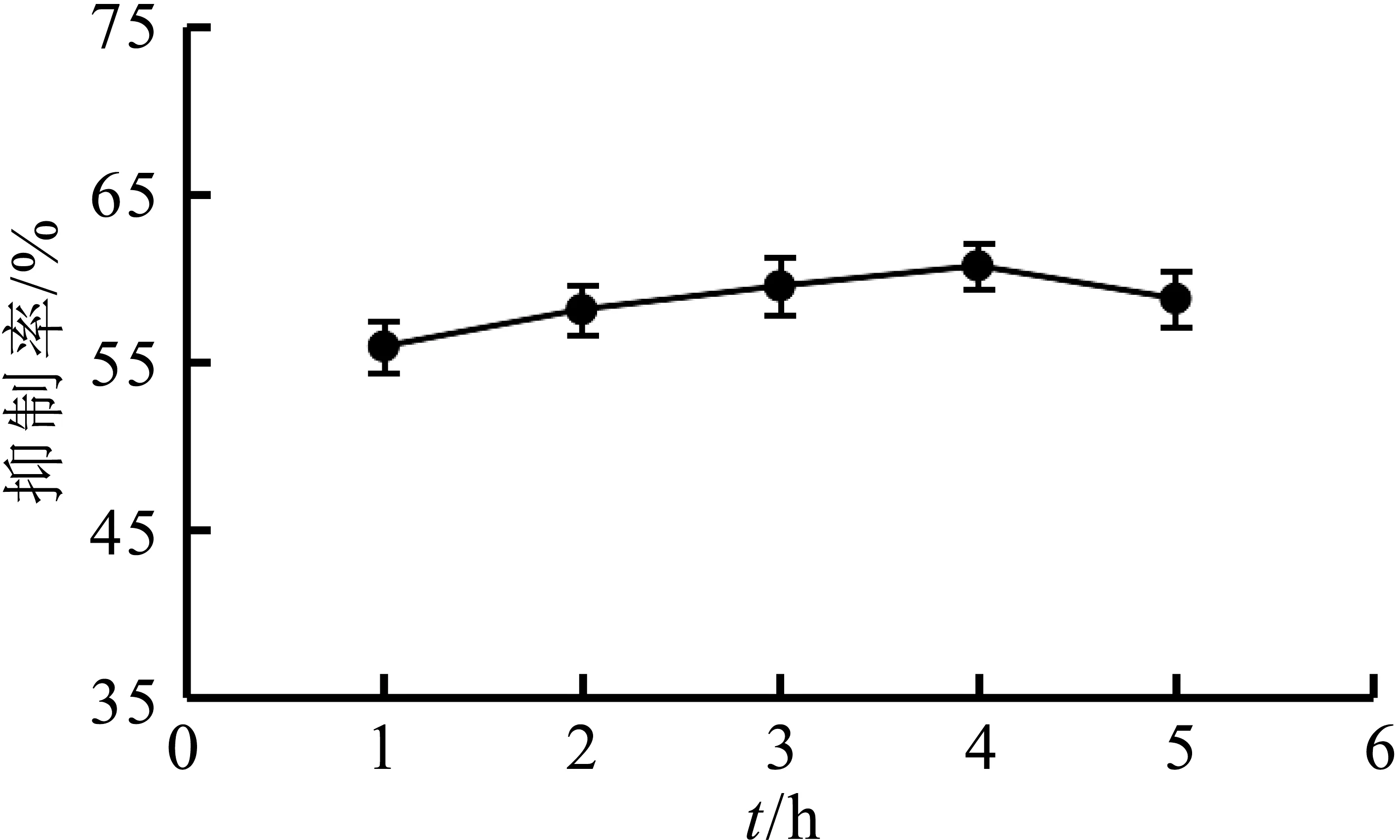
图4 酶解时间对胰脂肪酶抑制率的影响
2.3.3 加酶量
由图5可知,乳清蛋白源活性肽对胰脂肪酶的抑制率随着加酶量的增加先增大后减小,当加酶量为750 U/g时抑制率达到最大值60.43±2.35%。可能是因为在酶解初期,当底物浓度一定时,酶与底物的接触率随加酶量的增多而增高,体系反应速度也随之增大,这使得大部分大分子蛋白在短时间内被降解为具有抑制作用的小分子肽,但达到一定值后,随着底物的减少,酶与大分子蛋白的接触率降低,此时碱性蛋白酶水解的主要底物是乳清蛋白源活性肽,因此,随着加酶量的增大其对胰脂肪酶的抑制率会降低[38]。

图5 加酶量对胰脂肪酶抑制率的影响
2.3.4 牛乳清蛋白酶解条件的优化
利用正交试验,测定不同酶解温度、酶解时间和加酶量对脂肪酶活性的抑制率,优化碱性蛋白酶酶解乳清蛋白的酶解条件。
由表2可知,乳清蛋白源活性肽对胰脂肪酶抑制率影响的主次顺序为C>A>B,即加酶量影响最大,其次为酶解温度,酶解时间影响最小。抑制率较高的最佳组合为A2B3C2,即酶解温度45℃、酶解时间4 h、加酶量750 U/g。由于该组合不在正交试验中,因此进行验证试验,测得该条件下胰脂肪酶的抑制率为60.11±0.14%,符合预期。因此,乳清蛋白源活性肽的最佳制备条件为在60 mg/mL的乳清蛋白溶液中,加入750 U/g碱性蛋白酶,45℃酶解4 h,所得活性肽对胰脂肪酶的抑制率最高。

表2 牛乳清蛋白酶解条件正交试验设计及结果
按正交试验最佳酶解条件酶解,酶解物对α-淀粉酶的抑制率为20.88±0.66%。经测定,在最佳酶解条件下,60 mg/mL的乳清蛋白酶解后,酶解液中肽的含量为76.37 mg/mL,折算每毫克肽的胰脂肪酶抑制率为0.78±0.01%,α-淀粉酶的抑制率为0.27±0.01%。因此,利用本方法制备的乳清蛋白源活性肽既可以抑制胰脂肪酶的活性,也可以抑制α-淀粉酶的活性,也说明乳清蛋白是通过抑制胰脂肪酶和α-淀粉酶的活性而达到减肥作用的。
2.4 乳清蛋白源活性肽抑制率影响因素研究
2.4.1 温度对乳清蛋白源活性肽抑制率的影响
由图6可知,乳清蛋白源活性肽对胰脂肪酶的抑制率在95℃时最高,并显著高于25℃时的抑制率(P<0.05),对α-淀粉酶的抑制率在75℃时最高,并显著高于其他温度时的抑制率(P<0.05),但总体变化不大,说明温度会影响乳清蛋白源活性肽的活性,但影响不大,表明乳清蛋白源活性肽可接受常规杀菌及灭菌处理。
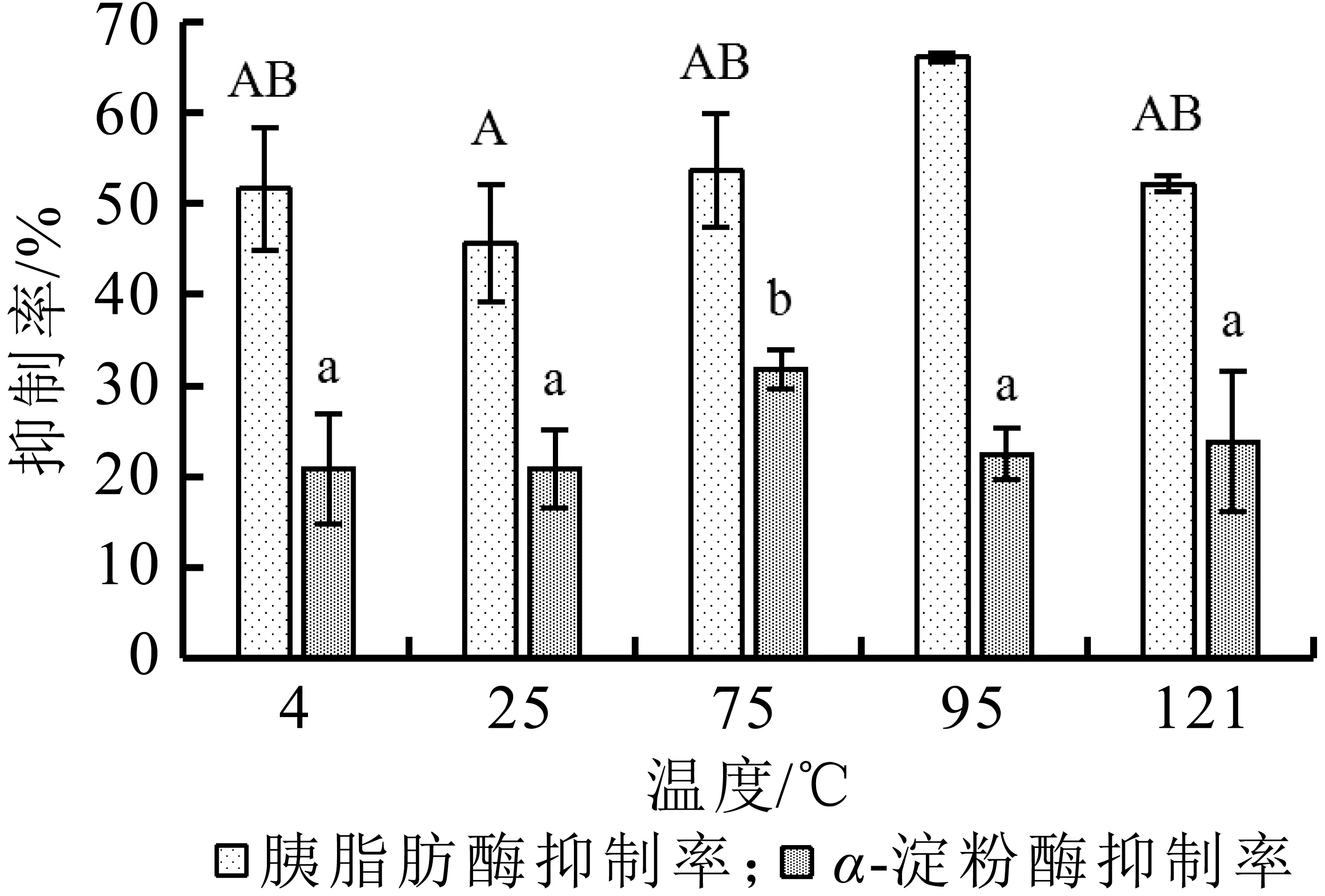
图6 温度对牛乳清蛋白源活性肽抑制率的影响
2.4.2 p H对乳清蛋白源活性肽抑制率的影响
由图7可知,pH过高或过低时,乳清蛋白源活性肽对胰脂肪酶和α-淀粉酶的抑制率均较低,说明过酸或过碱的环境可能会破坏牛乳清蛋白源活性肽的结构。p H=8时牛乳清蛋白源活性肽对α-淀粉酶的抑制率最高,p H=7时对胰脂肪酶的抑制率最高,因此,牛乳清蛋白源活性肽适宜保存在p H 7~8的环境中。
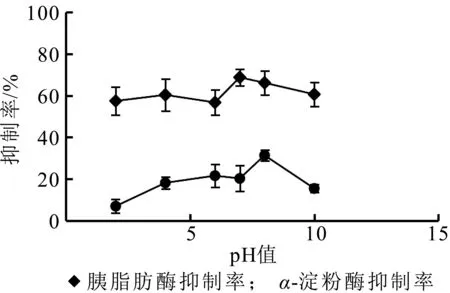
图7 pH值对牛乳清蛋白源活性肽的影响
2.4.3 光照对乳清蛋白源活性肽抑制率的影响
由图8可知,与避光贮藏相比,乳清蛋白源活性肽在经过日光和紫外线照射30 min后对胰脂肪酶的抑制率均显著增加(P<0.05)。经过紫外光条件处理后,乳清蛋白源活性肽对α-淀粉酶的抑制率显著增加(P<0.05),日光照射对α-淀粉酶的抑制率影响不显著(P>0.05)。总体来说,紫外线照射能使两种酶的抑制率保持较高水平。所以紫外光照射在短期内不会降低乳清蛋白源活性肽的功能特性,因此,在生产中,可考虑采用紫外线对乳清蛋白源活性肽进行薄膜式灭菌处理。
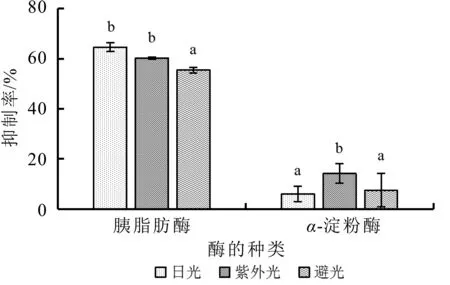
图8 光照对乳清蛋白源活性肽抑制率的影响
2.4.4 氧气对乳清蛋白源活性肽抑制率的影响
由图9可知,与对照相比,乳清蛋白源活性肽在持续通入洁净空气处理30 min对胰脂肪酶和α-淀粉酶的抑制率无显著性差异(P>0.05)。因此,乳清蛋白源活性肽短时间暴露于空气中对其功能特性影响不大,推测乳清蛋白源活性肽有一定的抗氧化作用,在短期保存过程中可以不进行隔氧处理。

图9 氧气对乳清蛋白源活性肽抑制率的影响
2.4.5 常见金属离子对乳清蛋白源活性肽抑制率的影响
由图10可知,当Na+浓度为1.0%(w/w)时,乳清蛋白源活性肽对胰脂肪酶的抑制率趋向于稳定,而对α-淀粉酶的抑制率最大。继续增加Na+浓度,胰脂肪酶抑制率无明显变化,对α-淀粉酶的抑制率则逐渐减小。因此,从减肥作用和人体健康两方面考虑,选择金属离子浓度为1.0%进行后续试验,并与其他4种金属离子进行对比,比较结果如图11所示。

图10 Na+对乳清蛋白源活性肽抑制率的影响
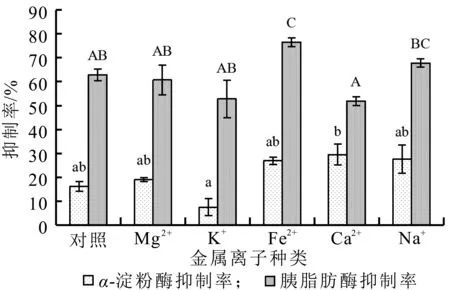
图11 不同种类金属离子对乳清蛋白源活性肽抑制率的影响
由图11可知,不同种类的金属离子对乳清蛋白源活性肽功能特性的影响不同。对胰脂肪酶的抑制率而言,Fe2+与Na+处理组相比无显著性差异(P>0.05),但Fe2+处理组显著高于其他处理组(P<0.05);同时Na+处理组显著高于Ca2+处理组(P<0.05)。对α-淀粉酶的抑制率来说,K+显著低于Ca2+处理组,(P<0.05),与其他处理组均无显著性差异(P>0.05),同时与对照组相比,K+降低了牛乳清蛋白源活性肽对α-淀粉酶的抑制率(P>0.05)。由此可知,Fe2+和Na+对乳清蛋白源活性肽的减肥功效有促进作用,其中Fe2+的促进作用最高,K+对乳清蛋白源活性肽的减肥功效有抑制作用。因此,乳清蛋白源活性肽与含Fe2+的食品一起被食用可能更好地发挥减肥作用,但与含K+的食品一起食用可能会减弱其减肥效果。
2.4.6 模拟胃肠道消化对乳清蛋白源活性肽的影响
对经过模拟胃肠道消化试验后的乳清蛋白源活性肽进行抑制率及多肽含量的测定,结果如表3所示。由表3可知,经过模拟胃液消化后,乳清蛋白源活性肽对胰脂肪酶和α-淀粉酶的抑制率先上升。
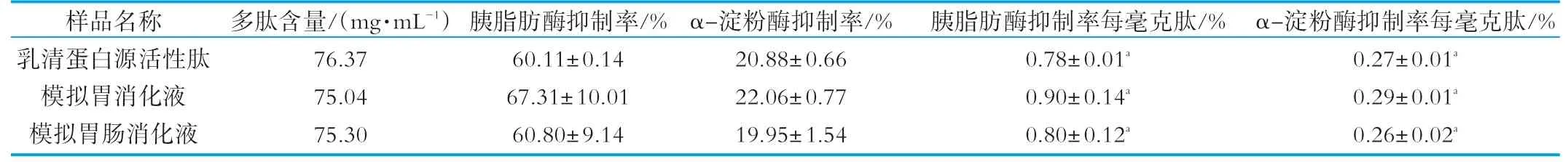
表3 模拟胃肠道消化对牛乳清蛋白肽抑制率的影响
再经过模拟肠液消化后下降,每毫克肽胰脂肪酶抑制率由0.78±0.01%变为0.80±0.12%,每毫克肽α-淀粉酶抑制率由0.27±0.01%变为0.26±0.02%,最终得到的模拟胃肠道消化液与未经消化的活性肽对脂肪酶和α-淀粉酶抑制率无显著性差异(P>0.05)。由此可知,乳清蛋白源活性肽经模拟胃肠道消化后稳定性良好,仍能发挥减肥功能。
3 结 论
(1)牛乳清蛋白源活性肽的制备工艺条件,与中性蛋白酶,木瓜蛋白酶,胰蛋白酶以及胃蛋白酶相比,碱性蛋白酶为制备乳清蛋白源活性肽的最佳水解酶,最优酶解工艺为60 mg/mL的乳清蛋白溶液中加入750 U/g的碱性蛋白酶,45℃酶解4 h。在此条件下,酶解液中的多肽含量为75.37 mg/mL,每毫克肽对胰脂肪酶抑制率为0.78±0.01%,对α-淀粉酶抑制率为0.27±0.01%。
(2)乳清蛋白源活性肽的影响因素,光照、氧气对乳清蛋白源活性肽胰脂肪酶与α-淀粉酶的抑制率影响不大,而相对高温可以提高其活性。p H和金属离子是影响乳清蛋白源活性肽活性的重要因素。环境p H值在7~8时适合乳清蛋白源活性肽的保存。Fe2+能提高乳清蛋白源活性肽对胰脂肪酶和α-淀粉酶的抑制率,K+则相反。当酶解液中Na+质量分数为1.0%(w/w)时,乳清蛋白源活性肽胰脂肪酶和α-淀粉酶抑制率最高。
(3)乳清蛋白源活性肽经过模拟胃肠道消化前后对胰脂肪酶和α-淀粉酶抑制率差异不显著(P>0.05),说明乳清蛋白源活性肽在人体消化道中的稳定性较好。

