等温扩增技术在克罗诺杆菌属快速检测中的研究进展
王亮,张懿翔,刘洋
(上海市质量监督检验技术研究院国家食品质量监督检验中心(上海),上海200233)
0 引 言
克罗诺杆菌属营养要求低,环境耐受性强,具有较强的耐热、耐寒和抗干燥能力,广泛存在于大自然中。生活中的各种食品:饼干、巧克力、坚果、水果等均会受到克罗诺杆菌属的不同程度的污染[1],它也是婴幼儿配方乳粉中常见的革兰氏阴性致病菌,会对免疫力低下的人群特别是婴幼儿的健康造成严重危害,可引发坏死性小肠结肠炎、菌血症和新生儿脑膜炎等疾病,甚至可能留下严重的神经系统后遗症,死亡率高达高达40%~80%[2]。
1 克罗诺杆菌属的分类和致病性
克罗诺杆菌属的分类经历了4个阶段:最初发现时根据其能产生黄色素被命名为黄色阴沟肠杆菌,1980年FARMER通过DNA杂交、生化反应、抗生素敏感性检测等发现它与阴沟肠杆菌有所区别,因此更名为阪崎肠杆菌(Enterobacter sakazakii)[3],2007年IVERSEN等利用多种现代分类技术将其划分为肠杆菌科下克罗诺杆菌属,该属包括6个种[4]。2012年,JOSEPH等在IVERSEN等人的基础上采用16SrRNA基因序列分析和多位点测序(Multilkocus sequence typing,MLST)技术,将克罗诺杆菌属分为7个种分别是:阪崎克罗诺杆菌(Cronobacter sakazakii)、丙二酸盐克罗诺杆菌(Cronobacter malonaticus)、苏黎世克罗诺杆菌(Cronobacter turicensis)、莫金斯克罗诺杆菌(Cronobacter muytjensii)、都柏林克罗诺杆菌(Cronobacter dublinensis)、康迪蒙提克罗诺杆菌(Cronobacter condimenti)、尤尼沃斯克罗诺杆菌(Cronobacter universalis)[5]。
克罗诺杆菌属的7个种都具有致病性,其致病性与类肠毒素、内毒素以及外膜蛋白有关,不同种之间的毒力表型差异较大[6]。据调查研究发现2012年重庆市旗山村4名儿童因克罗诺杆菌属引起食物中毒,2013年温州和上海也有婴儿疑似感染的病例[7]。2019年10月6日和10月30日,加拿大食品检验局就疑似克罗诺杆菌属感染问题分别发布警告紧急召回President’s Choice低铁婴儿配方奶粉和Parent’s Choice婴儿配方奶粉。目前,克罗诺杆菌属已被FAO和WHO共同列为A类致病菌,严重威胁着人体的健康,因而建立相关的检测方法尤其是快速检测方法,能够帮助企业及时发现和召回问题产品,对于食品生产环节控制及食品安全监管及疾病预防控制等方面都有极其重要的意义。
2 克罗诺杆菌属的检测方法和等温扩增技术
克罗诺杆菌属的检测方法主要分为国标生理生化检测和分子核酸检测两大类,早期的生理生化检测方法存在针对性不强、选择性不佳等诸多问题[8-9],国际标准化组织和国际乳品联合会,不断优化和完善后形成了ISO/TS 22964-2006检测方法,我国现行的GB 4789.40-2016《食品安全国家标准 食品微生物学检验克罗诺杆菌属(阪崎肠杆菌)检验》也是基于该方法制定而成。常规生化检测,需要经过培养增菌、分离筛选、生化鉴定等步骤,增菌时间就要2 d之久,整个检测流程至少5 d以上,流程繁复且耗时耗力,无法满足现代对致病菌快速筛查的要求。现代微生物鉴定已不再局限于观察菌体形态结构及生理生化特性,可以从分子遗传出发来鉴定微生物种属。分子核酸检测具有快速、高效、特异、灵敏度高等特点,主要通过检测目标病原体中的特定DNA或RNA序列来实现。综合目前国内外研究进展,克罗诺杆菌属检测用到的目标靶基因主要有:16SrRNA、ITS、α-葡萄糖苷酶、外膜蛋白(ompA)、rpoB、gyrB等[10-14]。相关技术包括:PCR、RT-PCR(实时荧光定量PCR)、dd PCR、CRISPR、寡核苷酸DNA微阵列等。
在普通PCR基础上发展起来的等温扩增技术,由于无需热循环仪等设备、灵敏度高以及操作便捷等优势被广泛应用于现场食品、环境等病原微生物的快速检测。本文将重点综述包括环介导等温扩增、重组酶聚合酶等温扩增、滚环扩增技术、依赖解旋酶扩增在内的不同等温扩增技术的相关原理及其在克罗诺杆菌属快速检测中的应用情况,旨在为完善和改进克罗诺杆菌属的快速检测方法提供相关理论依据。
2.1 环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)
LAMP技术由日本人Notomi在2000年发明[15],通过针对目标基因的6个区域设计4条特异性引物,在链置换DNA聚合酶作用下,(60~65℃)条件下完成恒温扩增。具有操作简单、灵敏度高,但引物设计复杂,存在多条引物相互作用以及气溶胶造成的假阳性问题。李莉,陈泽辉采用LAMP法检测阪崎克罗诺杆菌,实验结果显示LAMP试剂盒对人工污染的婴儿配方奶粉中的阪崎克罗诺杆菌的检出限为20 CFU/mL,其灵敏度明显高于国标生化鉴定法,同时该方法从DNA提取到LAMP扩增结束仅需1.5 h[16],而国标生化鉴定法分离培养到鉴定至少需要3 d以上。石伟雄等人采用了实时荧光环介导等温扩增技术,通过在LAMP反应体系中加入荧光染料,利用ESE Quant TS-LAMP扩增仪实时收集荧光信号来监控LAMP反应的进程,其检测阪崎克罗诺杆菌的灵敏度可达到8×10-2CFU/mL[17]。
2.2 重组酶聚合酶等温扩增技术(recombinase polymerase amplification,RPA)
RPA技术通过重组酶与引物结合形成蛋白-DNA复合物,一旦同源序列被引物定位即可发生链交换反应,DNA合成启动并进行指数扩增[18]。该反应只需在37℃条件下进行,15 min即可完成。该技术对PCR抑制剂有一定耐受力,因而被广泛用于疾病诊断和致病菌的检测。陈纯阳等人将RPA与免疫层析试纸条(lateral flow strip,LF)相结合,利用生物素和地高辛修饰引物,进而形成标记的DNA产物,最后扩增产物与胶体金标记的地高辛抗体及试纸条上固定的链霉亲和素发生特异性结合,只要20 min便可通过肉眼便观察实验结果。该方法检测阪崎克罗诺杆菌菌液的检出限可达1.7×102CFU/m L[19]。
2.3 滚环扩增技术(Rolling circle amplification,RCA)
RCA技术通过借鉴环状质粒及病毒的DNA滚环式自主复制,其关键步骤在于通过粘性末端或平末端成环的方式构建环状DNA模板[20]。Ju Liu等人建立了利用不对称拖尾PCR(AT-PCR)触发滚环扩增(RCA)的双重信号放大来检测克罗诺杆菌属的技术。首先2个平末端发卡DNA在T 4DNA连接酶作用下形成哑铃状DNA,同时不对称拖尾PCR形成大量ssDNA,哑铃状DNA与ssDNA杂交触发RCA反应,进而形成大量G-四链体结构DNA。该结构能与荧光染料硫黄素T(ThT)特异性结合,通过收集荧光信号得到检测结果[21]。Yunzhe Zhang等人在RCA基础上创新发明了SRCA技术,该技术可实现引物自身不扩增而目的基因扩增的效果,具有方法简单、耗时短,省去了RCA中环化和连接酶构建环状DNA链的关键步骤,1.5 h即可完成反应。由于反应中d NTPs在合成DNA链时同时形成焦磷酸根离子,和反应体系中的镁离子形成焦磷酸镁沉淀。结果可以通过添加荧光染料或离心观察沉淀,可用于现场快速检测,在纯培养条件下通过肉眼观察的检测限为3.4×102CFU/g,染料法的检测限为3.4×101CFU/g[22]。
2.4 依赖解旋酶扩增技术(Helicase-dependent amplification,HDA)
HDA技术,2004年纽英伦生物实验室根据活体细胞中DNA解旋酶解开双链DNA进行复制的机制,设计了一种新型的DNA体外扩增技术-HAD[23]。HDA反应需要DNA解旋酶、DNA聚合酶、辅助蛋白和可选择的单链DNA结合蛋白(SSB)等多种蛋白相互协作、共同完成DNA扩增。依据扩增过程中解旋酶的不同种类,主要分成以下几种:常温HDA(Mesophilic form of HDA,m HDA);耐热型HDA(Thermophilic helicase dependent amplification,tHDA);环状HDA(Circular HDA,c HDA)。HDA作为简单的等温扩增,不需要复杂的引物,反应底物要求低,可以是菌体细胞、血液样本等。Xu Di等人采用商品化的tHDA试剂盒,对经过二氧化硅包裹的磁性纳米粒子快速分离获得的DNA进行特异性扩增,最后通过加入荧光染料,检测荧光信号,3 h内便可完成检测,纯培养物的检测限达到100 CFU/mL[24]。
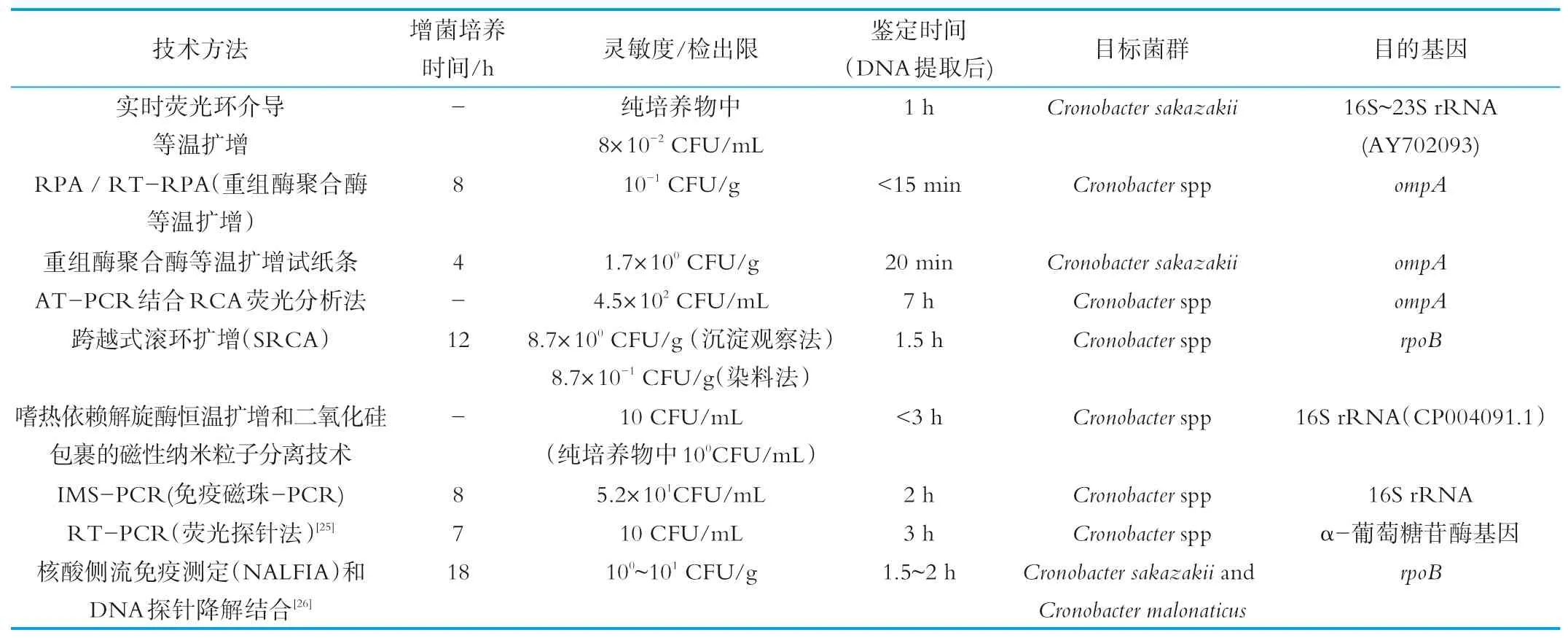
表1 近5年包括等温扩增技术在内的分子检测方法在克罗诺杆菌属中的具体应用
3 发展趋势
3.1 缩短目标菌富集时间
目前快速检测在满足其检测灵敏度条件下如何压缩检测时间实效快速的目的是未来需要解决的技术难题之一。常规进行检验时都需要2 d以上的增菌培养,这虽然一定程度上降低了检出限并提高了灵敏度,但是耗费了大量检测时间。目前已有相关方法可以有效缩短甚至不用增菌,如:Qiming Chen等人通过免疫磁珠及磁性纳米粒子进行快速富集,使用能作用于克罗诺杆菌属外膜蛋白A(ompA)的多克隆抗体构建免疫磁珠,可以迅速分离目标克罗诺杆菌属,有效缩短富集培养时间[27]。Xu Di等人采用二氧化硅包裹的磁性纳米粒子分离技术,无需前期增菌富集。二氧化硅包裹的磁性颗粒具有超顺磁性能,可吸附溶液中的核酸分子,在外加磁场作用下将负载核酸的磁性纳米颗粒可以从样品溶液中分离出来,磁性纳米粒子经过溶液洗脱便可获得纯化的核酸,该技术提取DNA时间不到半小时。
3.2 结果直观易读
直接易读的检测结果便于实验人员快速作出判断,也是未来快速检测发展的方向。对于扩增产物的检测方法主要有电化学和光学检测,后者适用于现场的快速检测,等温扩增通常可以和荧光染料、免疫试纸条法、浊度法及比色法联用。其中纸质材料由于其具有轻、薄、便宜、来源广泛等特点,由此发展起来的侧向流层析试纸条技术和等温扩增等分子检测手段联用被广泛用于病原微生物的快速检测领域[28]。姜毓君等人利用免疫磁分离和金纳米杂交探针策略,开发了一种快速和灵敏的可视化检测婴幼儿配方乳粉中阪崎克罗诺杆菌的方法,直观结果和电泳及紫外扫描光谱结果一致。
3.3 多重技术融合
采用两种及以上检测技术联用,进而放大检测信号,提高检测灵敏度和特异性,降低结果的假阳性。除等温扩增技术外,CRISPR(Clustered regularly interspaced short palindromic repeats)作为2017年新问世的检测技术被誉为“下一代的分子检测技术”,具有“快速、灵敏、高特异、简便、低价”的特性,被广泛应用于病毒及病原菌的检测,其灵敏度与Taqman方法的荧光定量PCR接近[29]。与荧光定量技术相比,具有无需大型扩增检测设备、成本低等优点。Chen JS等人基于CRISPR法将Cas12a和Cas14蛋白与RPA结合用于HPV病毒的快速检测,其灵敏度和特异性都显著提高,灵敏度达到了attomolar水平,特异性≤7个碱基[30-31]。所以CRISPR和等温扩增等技术结合用于克罗诺杆菌属的快速检测也是非常值得研究一个重要方向。
4 结束语
克罗诺杆菌属作为一种广泛分布的食源性致病菌,食品加工的任何环节,包括原料的选择、加工、储藏、运输、销售等环节都存在潜在污染风险。食品尤其是婴幼儿配方乳粉的质量安全一直是整个社会关注的焦点,这急需科研和检测人员开发针对克罗诺杆菌属等致病微生物的快速、特异、简单、便捷的检测技术。随着现代生物技术的不断进步,等温扩增等分子检测技术也将不断迭代更新,如何高效融合各项检测技术将是未来致病微生物快速检测技术需要探索的方向。

