发酵过程中不同理化因素对乳酸菌噬菌体的影响
于晓丽,赵莉,程溪,秦松跃,狄亚心,崔文,姜艳平,王丽,李一经,唐丽杰,徐义刚,周晗,乔薪瑗
(东北农业大学动物医学学院动物疾病防控技术与制剂创制实验室,哈尔滨150030)
0 引 言
乳酸菌作为益生菌,广泛应用于食品发酵及饲料加工业,在功能食品、医疗保健、微生态制剂等许多领域也具有较好的应用前景[1-4]。乳酸菌具有提高机体免疫力、调节肠道微生态平衡[5]、促进机体新陈代谢[6]等功能,对机体发挥着不容忽视的作用。乳酸菌定植肠道与自由基结合,可降低对机体的损害[7],且菌体及其提取物均具有抗氧化作用[8]。乳酸菌长期用于食品发酵,已被证明不具有致病性,被公认为安全级微生物[9]。但是乳杆菌在发酵过程中的不同阶段均受到噬菌体污染的威胁,导致发酵周期延缓、产量下降甚至全部浪费,造成严重的经济损失[10-11]。
在食品加工、化学制药、饲料生产和生物技术等行业,噬菌体污染问题被广泛报道[12]。减少或消除噬菌体污染,成为研究者非常关注的问题[13]。在发酵生产的不同阶段若发生噬菌体侵染,会导致乳酸菌产酸量减少,发酵过程缓慢或产品产量、质量下降等,造成巨大的经济损失[14]。Cox首次报道了噬菌体侵染发酵剂,在该领域取得显著进步,特别是在噬菌体遗传学、生态学及抵抗外界环境因素方面[15],随后又有相关文献[16]报道了干酪乳杆菌和副干酪乳杆菌的噬菌体导致乳品发酵失败;近来年,对噬菌体侵染酸奶和奶酪的报道[17-19]变得越发频繁,造成严重的经济损失。目前,噬菌体污染仍然是影响发酵工业的一个难题。
本研究通过分析环境中不同理化因素对3株乳酸菌噬菌体的影响,为控制发酵生产中噬菌体污染、保护工业菌株、制定有效防控措施提供理论依据。通过对发酵介质中理化因素对噬菌体及宿主菌的影响分析,为筛选抑制噬菌体活性且不影响发酵过程的有效措施奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株
干酪乳杆菌(L.casei ATCC 393)戊糖乳杆菌(L.pentosus KLDS 1.0413)短小乳杆菌(L.brevis ATCC 367),由本实验室保存。噬菌体Lc、Lpen和Lbre;均由本实验室保存。
1.1.2 主要实验仪器与设备
垂直板电泳系统BIO-RADMV120型,Savant Instruments;低温台式高速离心机Z323,HERMAL公司;电热恒温培养箱DNP-9162型,上海精宏实验设备有限公司;电热恒温水槽DK-80型,上海精宏实验设备有限公司;凝胶成像仪UVR-800 Uitra-Uiolet Procducts Limted Cambhdge,UK吉尔森公司;微量电子天平BS201S型,北京赛多利斯公司;透射电子显微镜H-7650型,日本日立公司。
1.1.3 培养基配制
试验过程中使用的主要培养基见表1。
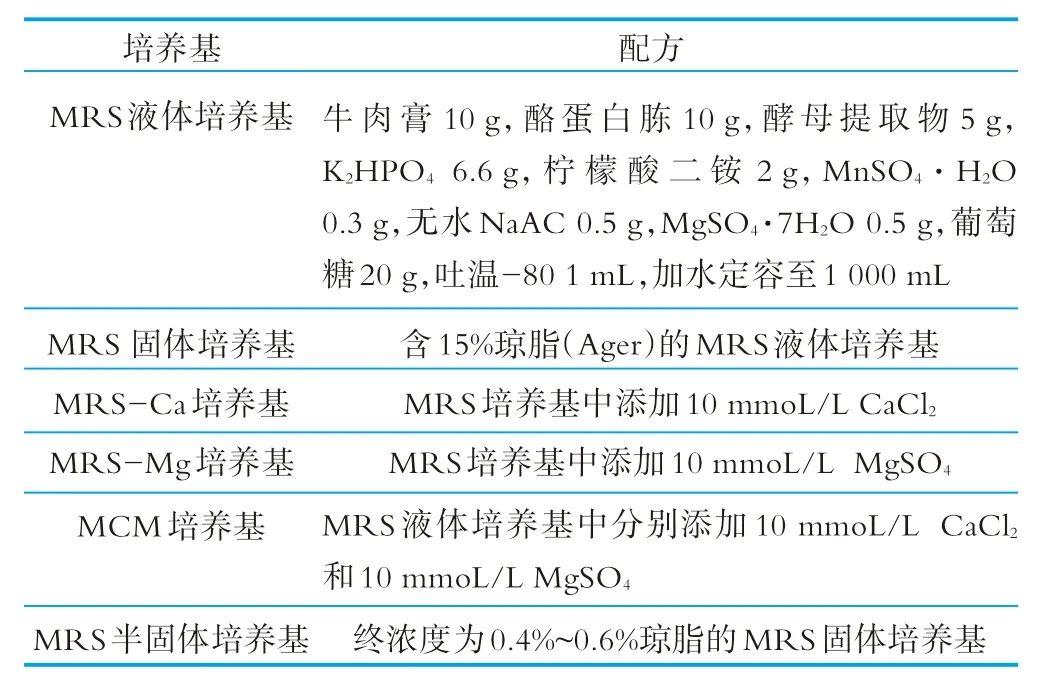
表1 主要培养基及其配方
1.2 试验方法
1.2.1 发酵过程中p H对宿主菌和噬菌体的影响
取不同p H值(p H=2~11)的MRS培养液98 m L,分别接种L.casei ATCC 393、L.pentosus KLDS 1.0413和L.brevis ATCC 367菌液2 mL,37℃静置培养18 h,测定OD600值。再将不同p H值(p H=2~14)的900μL MRS培养液中分别添加100μL噬菌体,混匀,32℃温育30 min,以L.casei ATCC 393为指示菌,以MRS固体培养基做下层培养基,将原液10倍比稀释后取100μL接种100μL指示菌,再将混合液接种4 mL MCM半固体培养基做上层培养基,制成双层琼脂平板,对形成的噬菌斑进行计数,测定噬菌体的效价,计算噬菌体存活率。实验重复3次。
1.2.2 发酵过程中温度对宿主菌和噬菌体的影响
为了减少发酵食品中乳酸菌菌种的使用、缩短发酵时间,对菌种最适生长温度进行测定,本试验选取发酵过程中常用温度,取MRS培养液98 mL,分别接种L.casei ATCC 393、L.pentosus KLDS 1.0413和L.brevis ATCC 367菌液2 mL,将其置于32、37、45、56℃条件下进行培养,每隔2 h测定其OD600值,绘制在不同温度下的生长曲线。为了测定噬菌体的热稳定性,筛选出利于乳酸菌发酵但不利于噬菌体生长的温度,参照Capra[20]等所描述的方法,用MRS培养宿主菌后,再分别感染3种噬菌体,噬菌体裂解宿主菌,收取裂解液,分别置于32、37、45、56℃和63℃温度下作用,于2、5、10、15、30、45 min和60 min分别取样,12 000×g离心4 min,取100μL上清进行十倍比梯度稀释,测定噬菌体效价。实验重复3次。
1.2.3 发酵介质中二价阳离子对宿主菌和噬菌体的影响
取MCM、MRS-Ca、MRS-Mg、MRS液体培养基98 mL,每一种培养液均分别接种L.casei ATCC 393、L.pentosus KLDS 1.0413和L.brevis ATCC 367菌液2 mL,置于37℃静置培养18 h后测定其OD600值。参照Quiberoni等[21]所使用的方法,用MRS培养噬菌体,获得噬菌体裂解液,采用双层平板法制斑,其中上层分别为MCM、MRS-Ca、MRS-Mg、MRS半固体培养基,下层均为MRS固体培养基。32℃静置培养,测定噬菌体的效价。
1.2.4 发酵介质中NaCl对宿主菌和噬菌体的影响
在MRS培养基中添加质量浓度1%、2%、3%、5%NaCl,取添加质量浓度1%、2%、3%、5%NaCl的MRS培养液各98 mL,分别接种L.casei ATCC 393、L.pentosus KLDS 1.0413和L.brevis ATCC 367菌液2 mL,37℃静置培养18 h,测定OD600值。参照Capra等[20]使用的方法,用MRS培养3种噬菌体,将终浓度为106PFU/m L噬菌体裂解液置于上述不同浓度NaCl发酵液中,32℃孵育4 h,测定噬菌体的效价。
1.2.5 发酵介质中聚山梨醇酯类(T-20)对宿主菌和噬菌体的影响
取MRS培养基添加T-20,体积分数分别为0.01%、1%、2%,将其平均分为两组,取添加积分数分别为0.01%、1%、2%T-20的MRS培养液各98 mL,分别接种L.casei ATCC 393、L.pentosus KLDS 1.0413和L.brevis ATCC 367菌液2 mL,第二组除接种等量菌液外,按最佳感染复数(motiplicity of infection MOI)接种对应的噬菌体,32℃培养过夜,第一组分别测定菌液OD600值,第二组培养液经12 000×g离心4 min,收集噬菌体裂解液,10倍比稀释后制斑,测定此时噬菌体效价。
2 结果与分析
2.1 发酵过程中不同p H对宿主菌和噬菌体的影响结果
2.1.1 发酵过程中p H对宿主菌的影响结果
在p H=5~9范围内3株乳酸菌均可正常生长,具有较强的嗜酸性。当p H=2或10时均不能生长,p H等于3时差异极显著,pH等于4时差异显著,均不能正常生长,p H等于9时差异不显著乳酸菌可以正常生长,表明对强酸、强碱较敏感。结果如图1所示。

图1 不同pH对宿主菌存活率的影响
2.1.2 发酵过程中p H对噬菌体的影响结果
在发酵介质中,不同p H对Lc、Lpen及Lbre的影响结果如图2所示。当pH=2时,Lc完全灭活,Lpen效价下降1个数量级,Lbre效价下降4个数量级;当p H=3~10时,3株噬菌体均表现出完全抗性;当pH=11~14时,3株噬菌体效价均急剧下降,最终完全灭活。
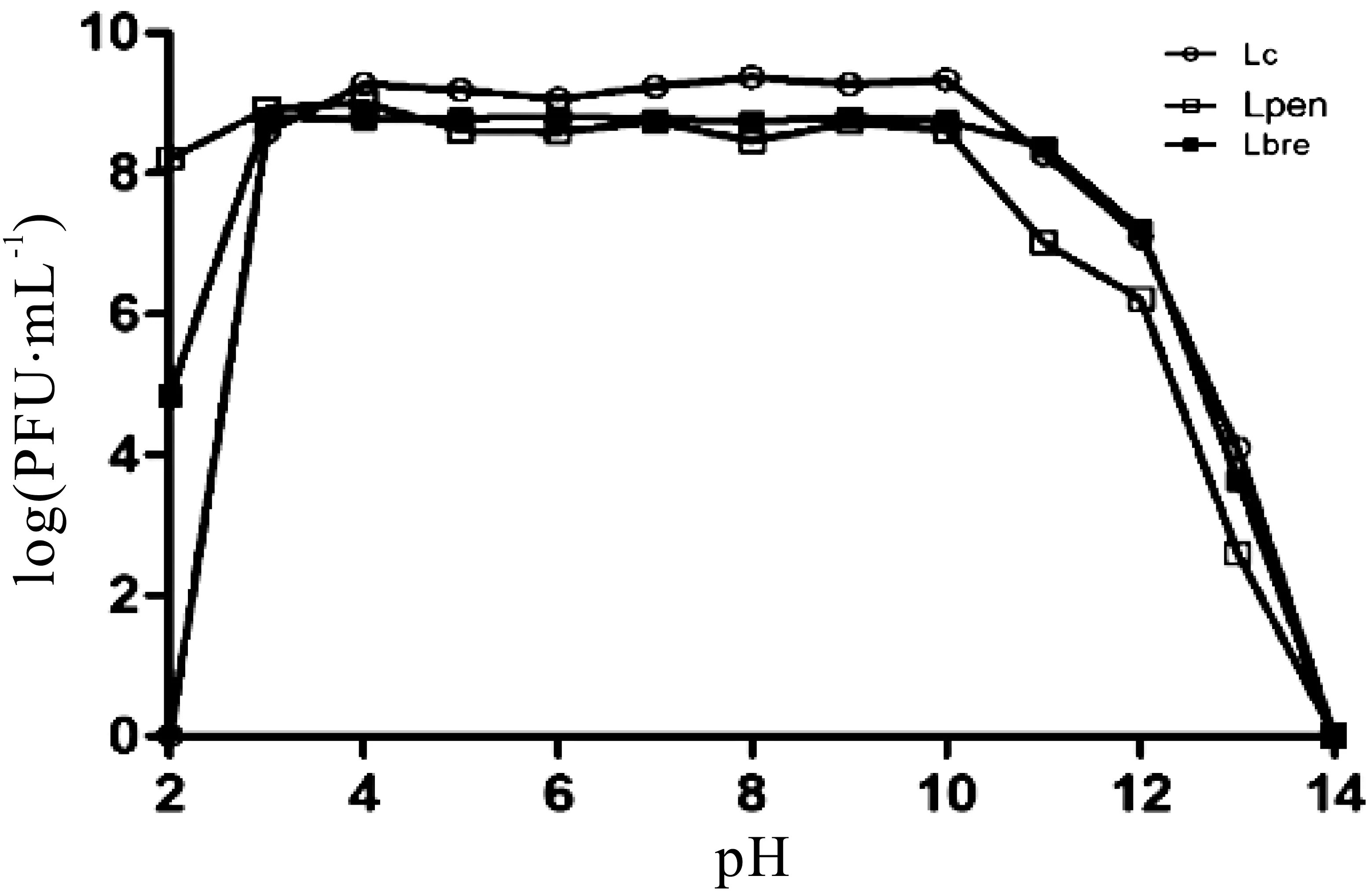
图2 不同pH对噬菌体效价的影响
2.2 发酵过程中温度对宿主菌和噬菌体的影响结果
2.2.1 发酵过程中温度对宿主菌的影响结果
3株乳酸菌L.casei ATCC 393、L.pentosus KLDS1 0413和L.brevi s ATCC 367分别于32、37、45℃和56℃进行生长曲线的测定,当温度为32℃和37℃时,3株乳酸菌均正常生长,且37℃时生长状态略好;当温度为45℃时,与37℃相比,差异极显著,3株乳酸菌均生长缓慢,生长速度L.casei ATCC 393>L.pentosus KLDS1.0413>L.brevis ATCC 367;当温度为56℃时,与37℃相比,差异极显著,3株乳酸菌均不能正常生长,结果如图3~图5所示。
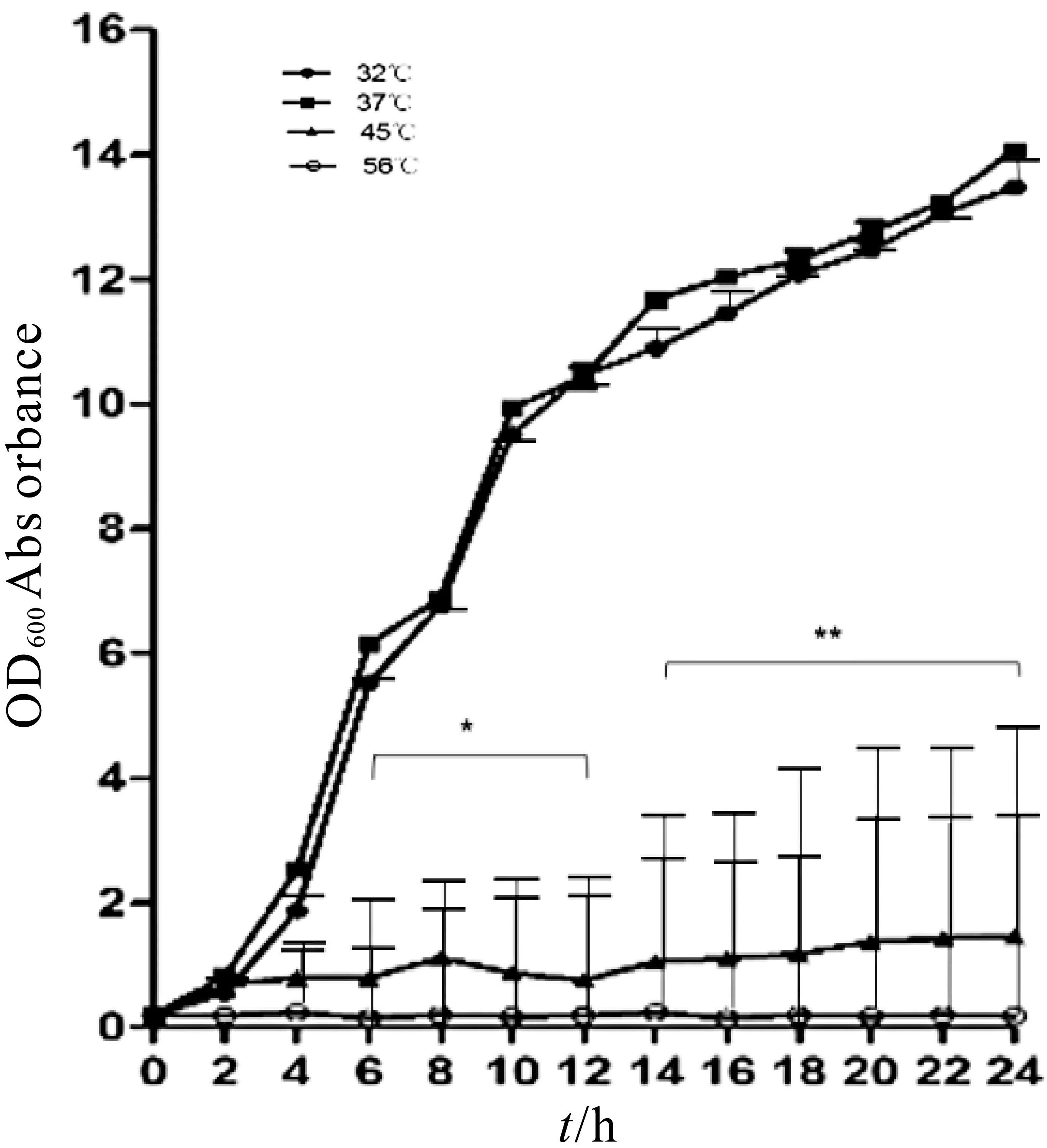
图3 温度对L.casei ATCC 393的影响

图4 温度对L.pentosus KLDS1.0413的影响

图5 温度对L.brevi s ATCC 367的影响
2.2.2 发酵过程中温度对噬菌体的影响结果
发酵介质不同温度对Lc的影响结果如图6所示,37℃时表现出完全抗性;45℃处理5 min,15%噬菌体失活,处理30 min,60%噬菌体失活,处理60 min后,70%噬菌体失活;56℃处理5 min后,可使98%Lc灭活,处理10 min后几乎全部灭活;63℃处理2 min即可完全灭活。

图6 发酵介质中温度对噬菌体Lc的影响
发酵介质不同温度对Lpen的影响结果如图7所示,当温度为32℃和37℃时,均表现出完全抗性;45℃时处理15~60 min,15%~20%噬菌体灭活;56℃作用处理45 min后,可使其全部灭活;63℃处理2 min即可完全灭活。
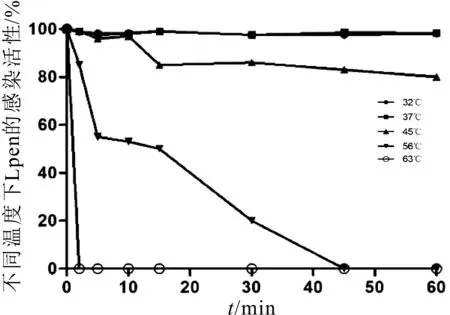
图7 发酵介质中温度对噬菌体Lpen的影响
发酵介质不同温度对Lbre的影响结果如图8所示,当温度为32℃时,表现出完全抗性;37℃处理2~10 min,可使其10%灭活;处理30~60 min,可使其30%灭活;45℃作用5~10 min,可使其30%灭活,作用60 min后,可使其70%灭活;在56℃及63℃温度下分别处理5 min和2 min即可使噬菌体全部灭活。
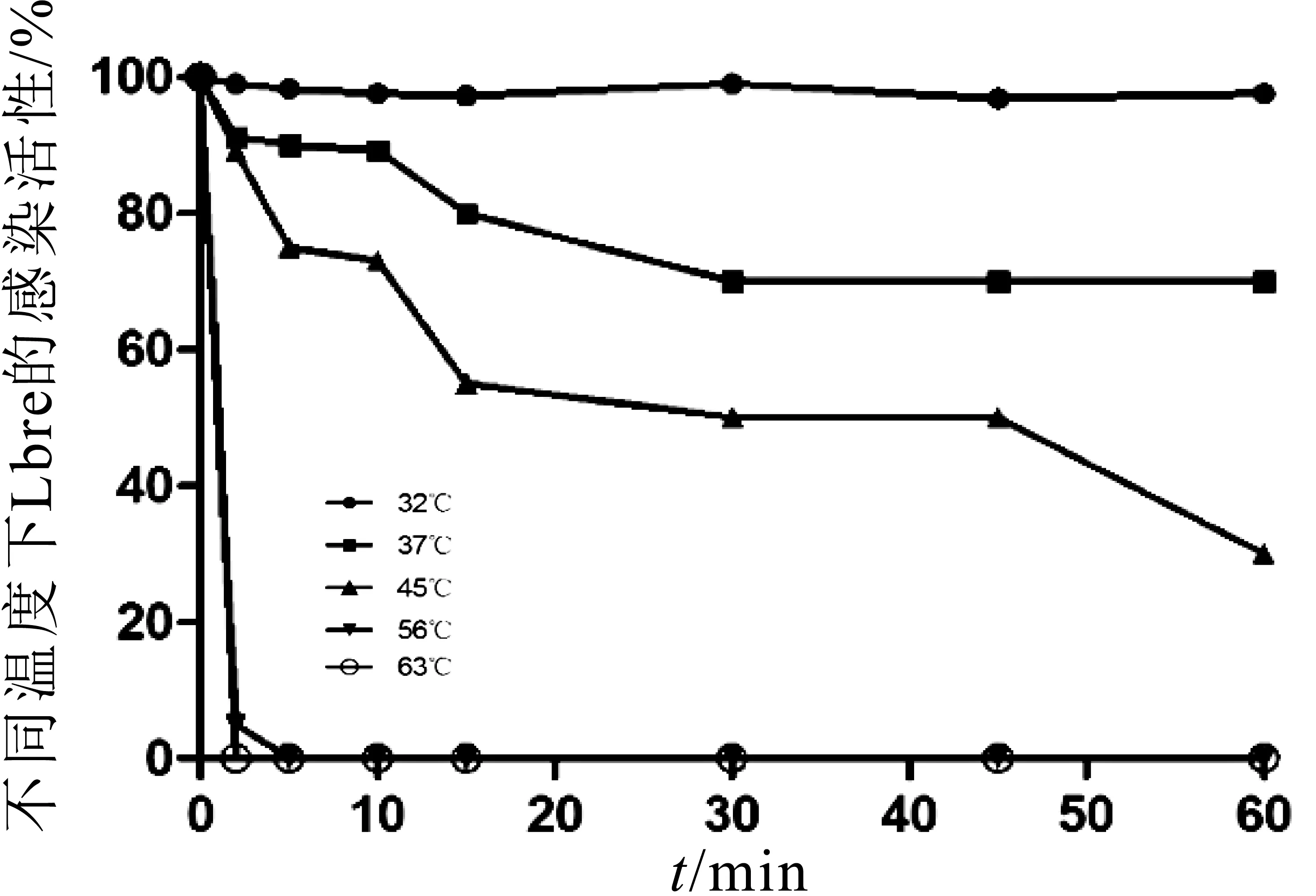
图8 发酵介质中温度对噬菌体Lbre的影响
2.3 发酵介质中二价阳离子对宿主菌和噬菌体的影响结果
2.3.1 发酵介质中二价阳离子对宿主菌的影响结果
发酵介质中添加Ca2+和Mg2+对宿主菌的影响结果如图9所示,L.casei ATCC 393、L.pentosus KLDS1.0413、L.brevis ATCC 367在MCM、MRS-Ca、MRS-Mg、MRS 4种培养基中的菌浓度均无明显变化,差异不显著,发酵液体介质中添加钙、镁离子未影响宿主菌的正常生长。
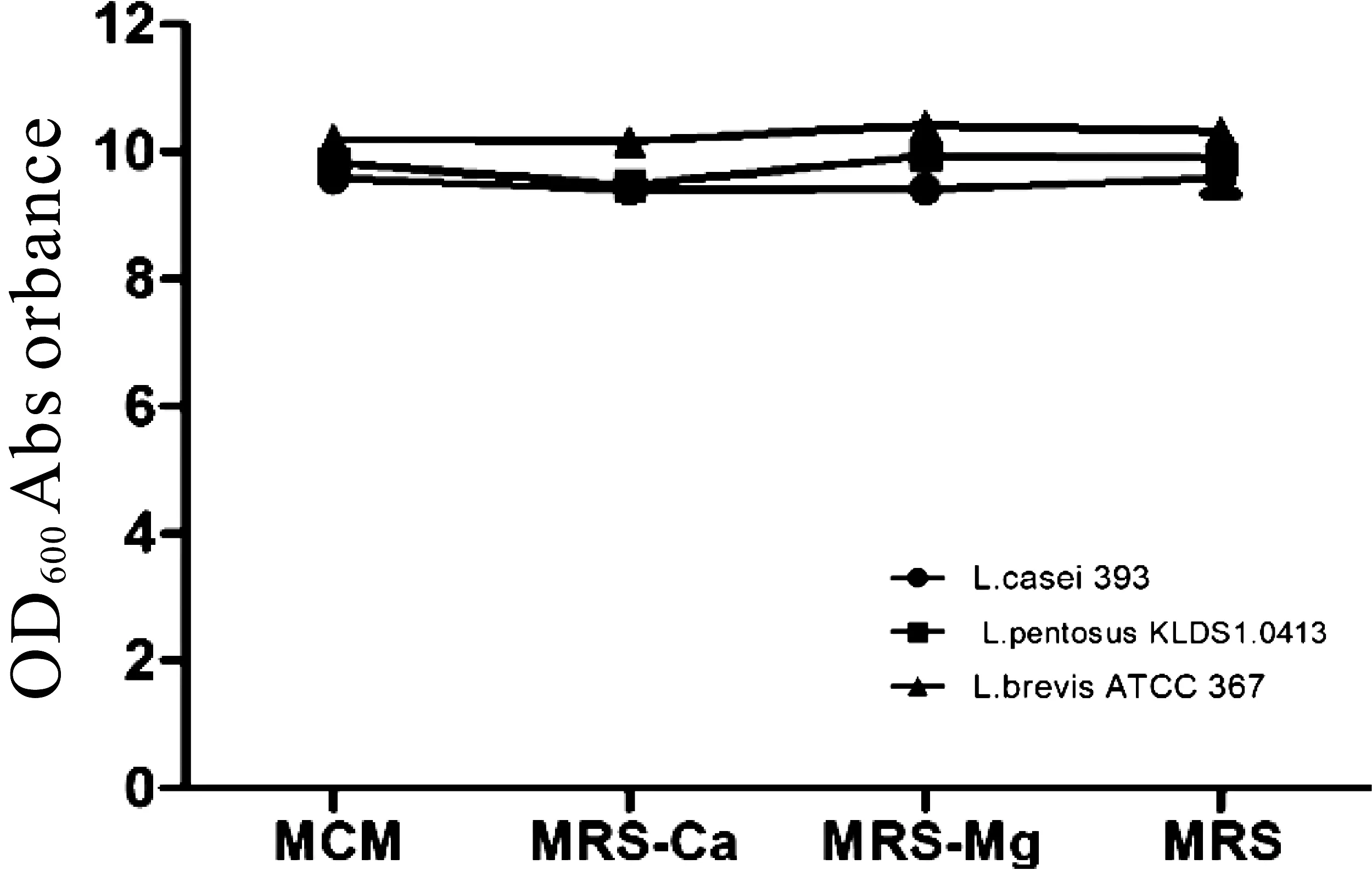
图9 钙、镁离子对宿主菌的影响
2.3.2 发酵介质中二价阳离子对噬菌体的影响结果
发酵介质中Ca2+和Mg2+对噬菌体的影响结果如图10所示,上层为未添加Ca2+和Mg2+的MRS培养基时,噬菌体效价与MCM、MRS-Ca、MRS-M g 3组相比明显降低。其中,未添加Ca2+和Mg2+使Lc效价下降2个数量级,Lpen和Lbre效价下降1个数量级;未添加Ca2+可使Lc效价下降1个数量级,Lpen效价略有降低,Lbre效价无明显影响。

图10 钙、镁离子对噬菌体的影响
2.4 发酵介质中NaCl对噬菌体和宿主菌的影响结果
2.4.1 发酵介质中NaCl对宿主菌的影响结果
在添加不同剂量NaCl的MRS培养基中,L.casei
ATCC393、L.pentosus KLDS 1.0413、L.brevis ATCC 367
均能正常生长,培养18 h后检测OD600。结果如图11所示,当NaCl浓度为2%时,L.casei ATCC 393菌液OD600最大(9.8673);当NaCl浓度为1%时,L.pentosus KLDS 1.0413菌液OD600最大(9.5430);当NaCl浓度为2%时,L.brevis ATCC 367菌液OD600最大(6.2780),与MRS组相比差异不显著,OD600数值均在乳酸杆菌正常生长的区间。
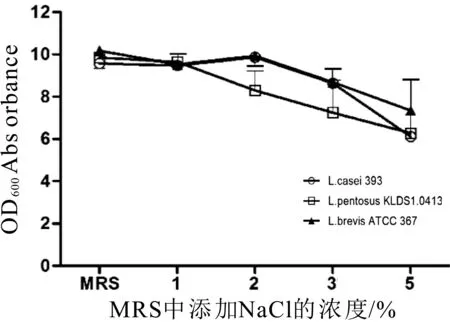
图11 不同浓度NaCl对宿主菌的影响
2.4.2 发酵介质中NaCl对噬菌体的影响结果
发酵液体介质中不同浓度NaCl对Lc、Lpen及Lbre的影响结果如图12所示。当1%NaCl作用Lc时,Lc效价未发生改变;当2%NaCl处理时,其效价下降1个数量级;当3%、5%NaCl作用Lc时,其效价下降2个数量级。当1%、2%NaCl作用Lpen时,其效价下降2~3个数量级;当3%NaCl作用Lpen时,其效价下降4个数量级,当5%NaCl处理时完全灭活。当不同浓度NaCl作用Lbre时,其耐受性较强,当NaCl浓度为3%和5%,效价下降一个数量级,但不能完全灭活。
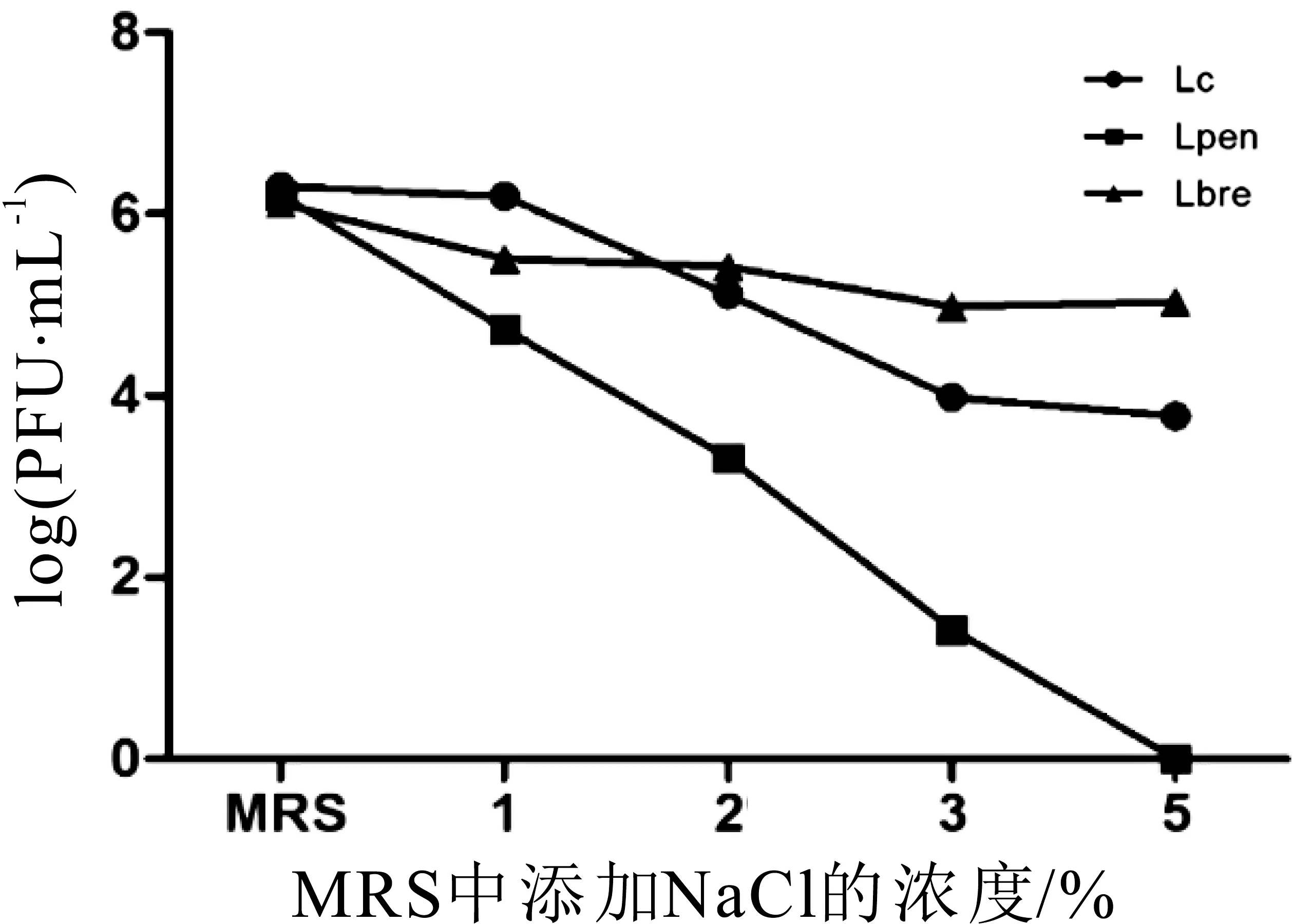
图12 不同浓度NaCl对噬菌体的影响
2.5 发酵介质中T-20对噬菌体和宿主菌的影响结果
2.5.1 发酵介质中T-20对宿主菌的影响结果
不同浓度T-20对宿主菌L.casei ATCC 393、L.pentosus KLDS 1.0413、L.brevis ATCC 367的作用结果如图13所示。随着T-20浓度的增加,3株乳酸菌的菌浓度均有降低(2%>1%>0.1%),当T-20浓度为1%、2%时,菌浓度下降较明显,但差异不显著,可以保证发酵的正常进行。
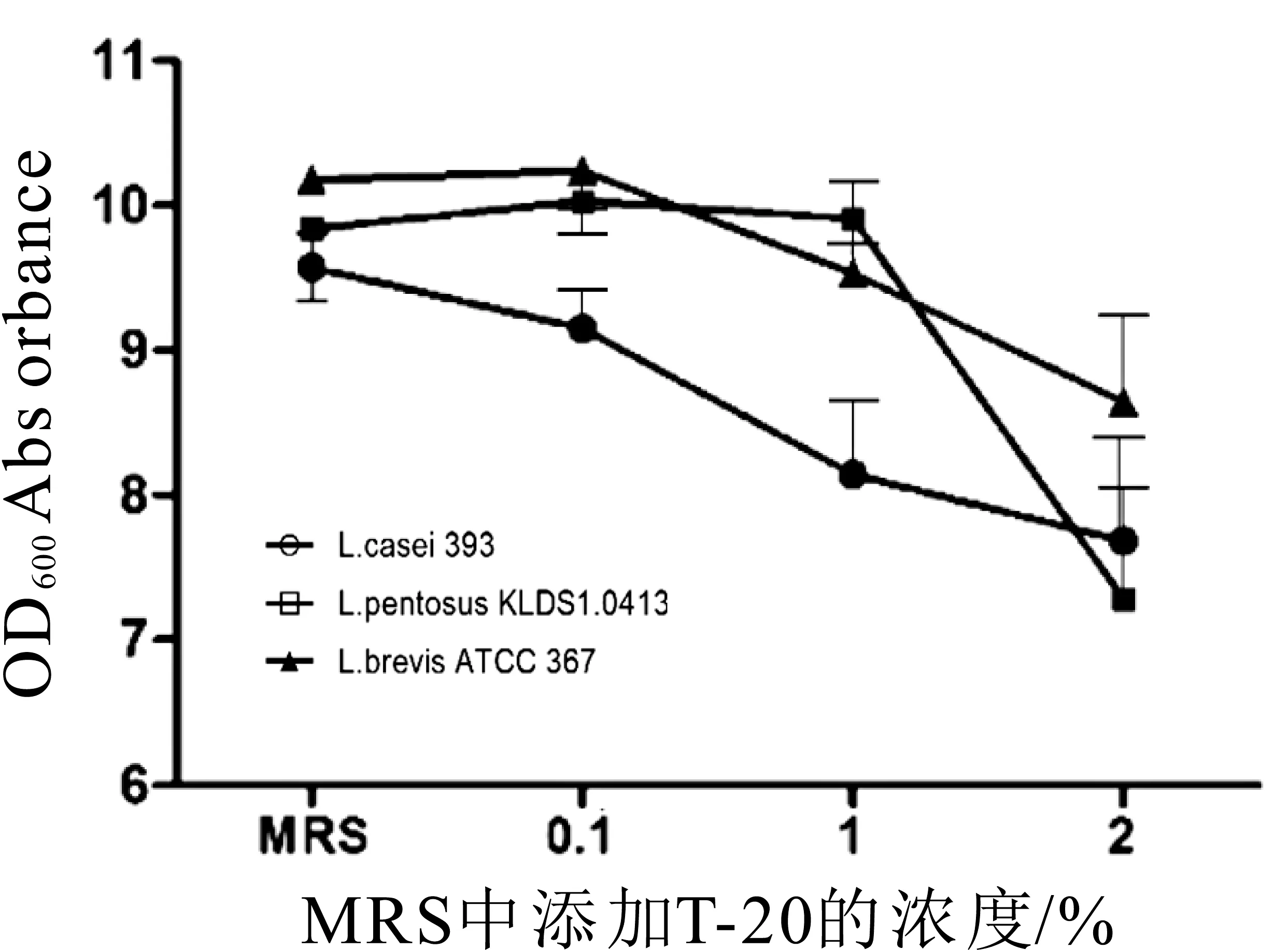
图13 T-20对宿主菌的影响
2.5.2 发酵介质中T-20对噬菌体的影响结果
不同浓度T-20对噬菌体的影响结果如图14所示。0.1%、1%T-20可使Lc效价分别下降1个和2个数量级,2%T-20使Lc效价下降3个数量级;0.1%T-20处理Lpen时,其效价下降2个数量级,1%T-20处理时Lpen效价下降5个数量级,2%处理后可完全灭活;0.1%T-20处理Lbre时效价下降4个数量级,1%、2%T-20可使噬菌体Lbre完全灭活。
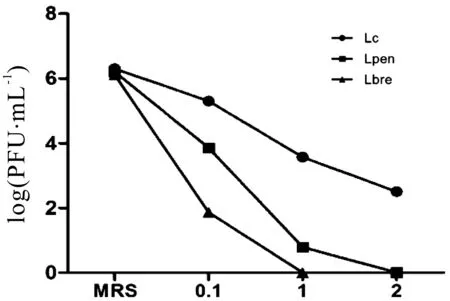
图14 不同浓度T-20对噬菌体的影响
3 讨 论
噬菌体污染的普遍存在常引起发酵失败,并导致严重的经济损失[22-23]。生产环境是影响发酵过程的重要因素之一,在发酵过程中,发酵液体的随意排放、发酵乳废弃以及洗罐后废水的不当处理等,会导致噬菌体污染发酵环境[24]。
噬菌体污染时,车间及厂区周围环境会有大量噬菌体残留,紫外消毒可有效控制发酵环境中的噬菌体污染。虽然紫外消毒覆盖面积大,操作便捷,但由于穿透力弱,对隐蔽或遮挡的发酵生产设备,例如工厂管道、发酵罐和种子罐等不能消杀彻底。发酵生产中常用的新洁尔灭(0.05%)、甲醛(0.1%)和高锰酸钾(KMnO4,0.05%)等生物灭活剂对噬菌体灭活效果非常显著[25-26]。有研究报道,对乳杆菌噬菌体MLC-A最有效的乙醇浓度为75%[13]。
在发酵过程中,介质中的相关因素对发酵过程具有重要的影响。在发酵生产中不同pH对噬菌体和宿主菌的影响不同,噬菌体对pH表现出高抗性,具有较强的耐酸、耐碱能力,但宿主菌耐酸不耐碱,并且噬菌体对p H的耐受范围与宿主菌相比较宽。因此,在发酵过程中,采用改变p H无法有效抑制噬菌体生长。另外,多数噬菌体对热处理较敏感,高温处理可破坏衣壳蛋白、裂解噬菌体。本研究将噬菌体Lc、Lpen、Lbre在56℃条件下分别作用10、45、5 min均被灭活;而宿主菌L.casei ATCC 393、L.pentosus KLDS1.0413和L.brevis ATCC 367在32℃和37℃下正常生长。综合发酵介质中温度对噬菌体与宿主菌的影响,在发酵生产中,可采取“先高后低”来设定温度,发酵初期将介质温度升至56℃及以上维持一段时间,然后通过制冷装置降至发酵菌株正常培养温度,完成发酵过程。
噬菌体在侵染宿主菌过程中,吸附阶段是首要过程。Sechaud等[27]指出Ca2+或M g2+不仅具有稳定噬菌体DNA螺旋结构、提高phage对宿主菌吸附率的作用,还可控制噬菌体DNA侵入宿主细胞。因此,二价阳离子Ca2+和Mg2+是噬菌体增殖必不可少的。本研究通过检测添加Ca2+或Mg2+对发酵过程的影响,结果表明,宿主菌在添加和未添加Ca2+或Mg2+时均能正常生长,但Lc、Lpen、Lbre在未添加Ca2+或Mg2+时,其效价下降2~4个数量级,且形成的噬菌斑较小。有研究报道,当噬菌体BYM、Ib3、YAB和MLC-A裂解菌体时,培养基中只有添加Ca2+和M g2+时,才能形成噬菌斑[28]。因此,在生产实践中,可考虑在发酵介质中添加络合物(如柠檬酸盐等)除去液体介质中多余的二价阳离子,阻断噬菌体对宿主菌的吸附,有效控制发酵过程中的噬菌体污染。
NaCl作为食品添加剂,不仅能改变发酵食品的口感质地,还可抑制噬菌体污染且不影响发酵菌株正常生长。在本研究中,当添加5%NaCl时发酵菌株浓度略有降低,但不影响发酵过程;当3%、5%NaCl处理Lc时,效价下降2个数量级,有效抑制其活性;当5%NaCl处理时,噬菌体Lpen完全灭活,Lbre无明显抑制作用。因此,在食品发酵生产中,可利用噬菌体对Na-Cl敏感性的不同,添加适宜浓度的NaCl来抑制噬菌体活性。T-20是一类非离子表面活性剂,常用于发酵过程中,减少泡沫的产生,被公认为安全、无毒、无刺激性的原料,每日允许摄入量为0~25 mg/kg(FAD/WHO,1985)。本研究选用不同浓度T-20对噬菌体及宿主菌共同作用,为了探究在合理浓度范围内添加T-20,是否可以控制发酵过程中噬菌体的污染,随着T-20浓度的增加,3株乳酸菌浓度略有降低(0.1%<1%<2%),但可以确保发酵过程顺利进行;当2%T-20作用Lc、Lpen、Lbre后,只有Lc效价下降3个数量级,而Lpen、Lbre均具有较强耐受性。因此,在生产实践中,可利用噬菌体对T-20的敏感性抑制其活性。
本研究通过分析发酵介质中不同理化因素对发酵过程的影响,为保护商业菌株、制定有效防控措施提供理论依据和实验数据,同时为深入了解探究噬菌体与宿主菌间的相互作用奠定基础。在生产实践中不同消毒剂和消毒方法各有优缺点,在发酵生产过程中,可联合应用多种方法,有效控制噬菌体污染,节约生产成本,提高生产效率。

