miR-122-5p对滑膜肉瘤细胞株SW982增殖及放疗敏感性的影响
庞李贺 杨华瑞 周耀君 鲍同柱
(三峡大学 第一临床医学院[宜昌市中心人民医院] 骨外科, 湖北 宜昌 443003)
滑膜肉瘤(synovial sarcoma,SS)是15~29岁青少年最常见的恶性骨肿瘤之一,超过90%的SS发生于四肢,约有一半会出现远处转移[1]。目前常规治疗方法包括手术切除、术后辅助化疗和放疗,而以放疗为基础的新辅助治疗在骨肉瘤的治疗中起着至关重要的作用[2, 3]。但不断产生的化疗药物耐药性及放疗抵抗,使得耐药患者的5年生存率小于20%,因而探寻新的减少滑膜肉瘤耐药性的机制具有重要的临床意义[4]。
MicroRNAs (miRNAs)是一类短的非编码RNA,长度约20~24个核苷酸,通过与靶基因mRNA的3’未转录区(3’UTRs)结合来调控转录后基因表达[5, 6]。miRNAs参与调控发育和应激反应等重要生理机制。目前越来越多的证据表明,它们也参与了肿瘤生成、恶性进展及化疗耐药性的产生等多种病理过程[7-9]。肿瘤患者体内特定miRNAs表达差异还可以作为判断临床预后的生物标志物,以及评估化疗药物的临床效果[10, 11]。因此,深入探索在SS中发挥重要作用的miRNA及其具体功能,有望为治疗SS提供有效的靶点。miR-122-5p已被证实在多种肿瘤中发挥重要作用,例如在非小细胞肺癌、胰腺导管腺癌、胶质瘤中都有抑制肿瘤进展的作用,但是在滑膜肉瘤中的相关研究甚少[12]。
在本研究中我们通过脂质体转染法、流式细胞术、MTT法及γ射线干预来探究miR-122-5p在滑膜肉瘤组织及癌旁组织中的差异性变达,miR-122-5p与甲基化CpG结合蛋白2(methyl-CpG-binding protein 2, MeCP2)蛋白表达的关系,以及MeCP2蛋白与滑膜肉瘤放疗敏感性之间的关系,旨在研究miR-122-5p对滑膜肉瘤增殖、分化及其对放疗敏感性的作用及其调控机制。
1 材料和方法
1.1 试剂
试验所用主要试剂有:Trizol 试剂(Life Technologies,美国);PureLinkTMmiRNA分离试剂盒(Thermo Fisher公司,美国);二甲基亚砜(北京索莱宝科技有限公司);RNAse R(Epicenter公司,美国);RT-PCR试剂盒(TIANGEN公司);miR-122-5p mimic、inhibitor委托凯基生物公司合成。
1.2 仪器
ND-1000微量紫外可见分光光度计(NanoDrop公司,美国);实时PCR系统(Applied Biosystems,美国);137Cs γ射线照射源(Autocell40原子能有限公司,加拿大);流式细胞仪(CytoFLEX 贝克曼库尔特公司,美国)。
1.3 方法
1.3.1 临床滑膜肉瘤标本收集
本研究所用到的SS组织、癌旁正常滑膜组织标本均来自我院骨外科(2017年6月~2020年1月)。手术期间收集的所有标本被立即置于液氮中冷冻储存,用于RNA或蛋白质提取等实验。本研究已经过我院伦理委员会批准,并根据赫尔辛基宣言中制定的指南进行操作。
1.3.2 细胞培养及γ-射线照射处理
人滑膜肉瘤细胞SW982(上海酶联生物科技有限公司)快速解冻复苏,培养在RPMI-1640培养基(含10%胎牛血清、100 U/mL青霉素、100 U/mL链霉素),置于37℃、5%CO2的恒温培养箱中培养。电离辐射以4 Gy的γ射线照射细胞,一次性照射,剂量率为1 Gy/min,照射完成后继续培养进行后续检测。
1.3.3 miR-122-5p mimic/inhibitor转染
SW982细胞接种至六孔板(2.5×105细胞/孔),培养24 h后更换培养液,并给予完全培养基溶解的miR-122-5p mimic、miR-122-5p inhibitor及对照载体(凯基生物技术公司合成),附加Lipofection 2000转染质粒进行转染,细胞继续培养48 h后进行后续RT-PCR验证miR-122-5p转染效率。
1.3.4 MTT检测细胞活力
在具体分析过程中,通过EViews软件,采用ADF(Augmented Dickey-Fuller)检验,具体结果见表2。从表2可知,变量LGDP和LTTL都是非平稳的时间序列,而其一阶差分变量LGDP1和LTTL1是平稳的时间序列,即变量LGDP和LTTL都是一阶单整平稳序列,因此,两变量可以进行协整检验和Granger因果检验。
SW892细胞经过miR-122-5p mimic、miR-122-5p inhibitor转染、培养后,收集处于对数生长期的各组细胞,制成1×105/mL的单细胞悬液,以200 μL /孔浓度接种至96孔板,分别于培养0 h、24 h、48 h、72 h时进行MTT测定,每孔加入20 μL的MTT溶液(5 mg/mL)继续培养4 h后,再加入150 μL DMSO溶液振荡反应5 min,通过酶标仪测定每孔在492 nm波长的吸光度值,以吸光度值表示细胞的活性。
1.3.5 流式细胞术测定细胞周期
将分组细胞经γ-射线照射处理以后继续培养24 h,PBS将细胞洗涤以后,用0.25%的胰蛋白酶消化,将细胞配制成单细胞悬浮液。添加75%的乙醇溶液混合后,放置于4℃孵育过夜。在细胞中添加RNase A水,放在37℃孵育30 min,继续添加PI染液400 μL染色30 min。流式细胞仪检测细胞周期变化,每组细胞设置4个复孔。
1.3.6 流式细胞测定细胞凋亡
将分组细胞经γ-射线照射处理以后继续培养24 h,收集各组细胞,用PBS悬浮以后,再分别添加5 μL的 Annexin V-FITC和PI染液反应10 min,流式细胞仪检测凋亡变化,每组细胞设置4个复孔。
1.3.7 Western Blot
从培养细胞中提取总蛋白,根据制造商的说明,使用BCA试剂盒(碧云天科技,北京)检测蛋白浓度。将提取的蛋白加入上样缓冲液中,95℃加热5 min。每个样本取20 mg蛋白质上样行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,并转至PVDF膜上(BioRad,Hercules,CA)。5%牛血清白蛋白溶液中在室温下封闭1 h,1∶1 000一抗(MeCP2、Wnt1、β-catenin、Cyclin1、Caspase3,均购自Santa Cruz,美国)继续在4℃孵化过夜。PVDF膜将与辣根过氧化物酶标记的二抗在室温孵育1 h,使用增强型化学发光试剂盒检测蛋白表达强度(Thermo Fisher Scientific,美国)。
1.3.8 实时荧光定量PCR
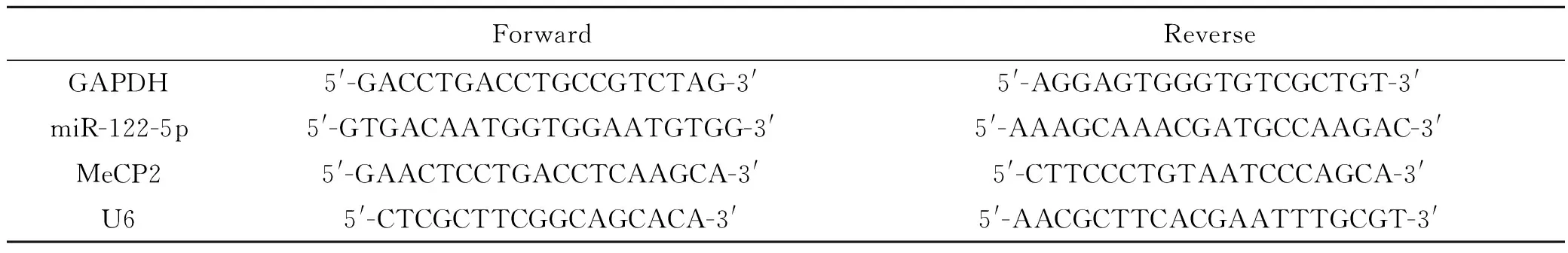
表1 引物序列
1.4 统计分析

2 结果
2.1 miR-122-5p在滑膜肉瘤组织中差异表达分析
我们收集了42例SS临床标本及16例对应的癌旁组织,通过RT-PCR检测miR-122-5p表达。结果显示,与正常对照组织相比,SS组织中miR-122-5p明显下降(P<0.01,图1A)。比较SS患者合并转移(31例)与无转移者(11例)癌组织中miR-122-5p的表达发现,与无转移者的癌组织相比,合并转移者的癌组织中miR-122-5p表达水平显著降低(P<0.01,图1B)。进一步对不同病理分型的SS中miR-122-5p的表达分析,发现在低分化型的癌组织中miR-122-5p表达量最低,其显著低于单相纤维型及双相纤维型(均P<0.01),而miR-122-5p的水平在单相纤维型与双相纤维型之间无统计学差异(P>0.05,图1C)。总之,这些结果表明miR-122-5p在SS中低表达,而且与肿瘤恶性程度及转移相关。

注:A: miR-122-5p在滑膜肉瘤组织与正常组织中的表达;B:转移与未转移滑膜肉瘤患者肿瘤组织中miR-122-5p的表达;C:单相纤维型、双相纤维型及低分化型的滑膜肉瘤组织中miR-122-5p的表达。内参为U6;*P<0.01图1 miR-122-5p在滑膜肉瘤组织中的表达分析
2.2 miR-122-5p过表达可增加滑膜肉瘤细胞放疗敏感性
为进一步研究miR-122-5p是否参与调控SS细胞的增殖、凋亡,首先我们对SS细胞SW982转染miR-122-5p mimic和miR-122-5p inhibitor,分别过表达或抑制miR-122-5p表达(均P<0.01,图2A)。对转染后细胞增殖进行分析,MTT测定结果发现,与对照组相比,miR-122-5p inhibitor转染后细胞活力明显增高,而miR-122-5p mimic转染过表达组细胞增殖被显著抑制(均P<0.01,图2B)。为了确定miR-122-5p表达差异对细胞分裂的影响,我们通过流式细胞术分析细胞周期变化,与对照组比较,miR-122-5p mimic转染处理后,细胞所处G1/G0期(静止期)比例明显上调,而S期(DNA复制)、G2/M期(有丝分裂期)细胞比例明显下降(均P<0.05,图2C)。而miR-122-5p inhibitor转染抑制miR-122-5p表达的同时,显著下调SW982细胞在G1/G0期比值,更多的细胞处于S期和G2/M期(图2C)。上述结果表明,过表达miR-122-5p在SW982细胞中可发挥抑制肿瘤细胞增殖的作用。
为进一步明确miR-122-5p是否参与SS细胞对放疗敏感性的调控,转染mimic、inhibitor后SW982细胞接受4 Gy剂量γ-射线照射后继续培养24 h和48 h,使用流式细胞术测定细胞凋亡。结果显示,在射线照射24 h后,miR-122-5p mimic组的细胞凋亡较对照组明显增加,而miR-122-5p inhibitor转染后细胞凋亡较对照组明显降低(均P<0.05,图2D)。同样,在γ-射线照射48 h后,过表达miR-122-5p仍能增加细胞凋亡率(P<0.05,图2D)。上述结果表明,过表达miR-122-5p可增加SS细胞放疗敏感性。
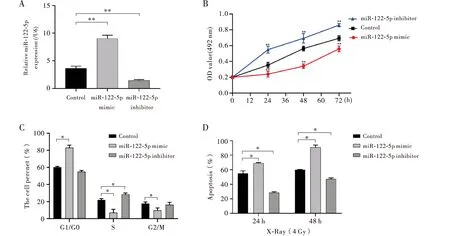
注:A:RT-PCR检测各组细胞的miR-122-5p表达,内参为U6;B:通过MTT法测定各组细胞活力;C:流式细胞术测定各组细胞周期;D:使用γ射线4 Gy剂量照射24 h和48 h,通过流式细胞术测定各组细胞凋亡率。与Control组相比,*P< 0.05;**P<0.01图2 miR-122-5p可抑制滑膜肉瘤SW982细胞增殖
2.3 miR-122-5p靶向调控MeCP2
通过Target Scan预测确定miR-122-5p靶向结合MeCP2 3’UTR区域,且SW982细胞转染miR-122-5p mimic后MeCP2表达明显受抑制,而miR-122-5p inhibitor转染能够上调MeCP2蛋白表达(图3A)。对MeCP2在SS组织中的表达进行分析发现,与癌旁组织相比,SS癌组织中MeCP2蛋白和基因呈明显高表达(P<0.01,图3B和3C)。合并转移的SS癌组织中MeCP2 mRNA表达明显高于无转移者(P<0.01,图3D)。对SS不同病理分型的MeCP2 mRNA表达分析发现,在低分化型的癌组织中MeCP2表达量最高,而单相纤维型表达相对较低,具体含量比较为单相纤维型<双纤维相型<低分化型(均P<0.01,图3E)。对癌组织中miR-122-5p和MeCP2的表达进行线性回归分析发现,它们存在明显的负相关关系(R2=-0.433,P<0.01,图3F)。上述结果提示,miR-122-5p可能通过靶向调控MeCP2,与肿瘤恶性病理程度、转移明显相关。
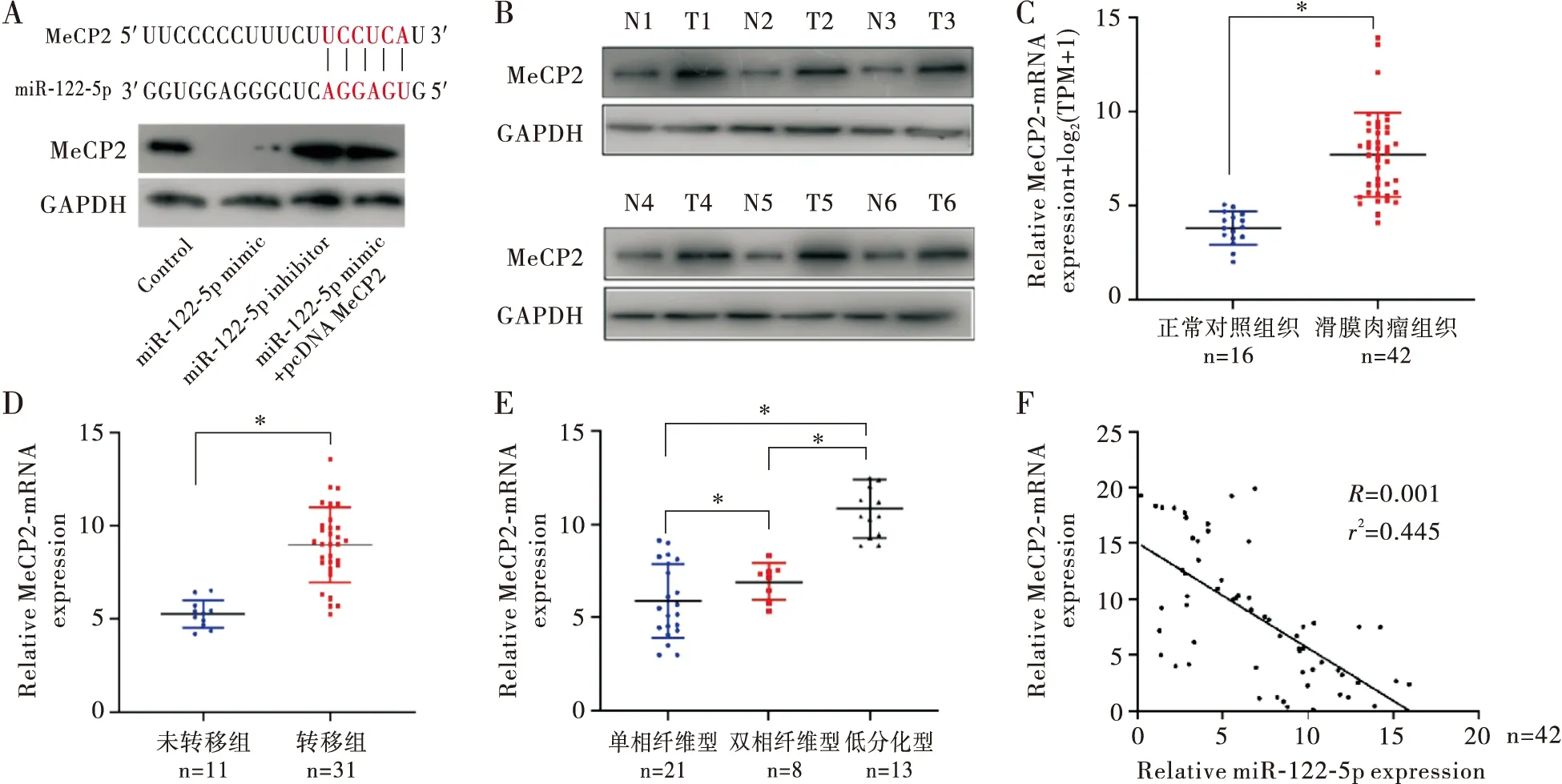
注:A:上方为miR-122-5p与MeCP2 3’UTR结合位点示意图,下方为Western Blot分析各组MeCP2蛋白表达;B:Western Blot测定滑膜肉瘤组织中MeCP2蛋白表达(N:癌旁组织;T:癌组织);C:RT-PCR分析滑膜肉瘤组织中MeCP2 mRNA水平;D:伴转移与无转移滑膜肉瘤患者的MeCP2 mRNA表达;E:不同病理分型中MeCP2 mRNA表达;F:滑膜肉瘤组织中miR-122-5p水平与MeCP2 mRNA表达的关系(采用线性回归分析);*P<0.01图3 miR-122-5p靶向调控MeCP2表达
2.4 miR-122-5p通过MeCP2调控滑膜肉瘤细胞放疗敏感性
为了确定miR-122-5p/MeCP2信号轴是否参与调控SS细胞的周期及放疗敏感性,SW982细胞给予miR-122-5p mimic干预后再转入过表达MeCP2质粒(pcDNA MeCP2)上调MeCP2蛋白表达(均P<0.05)。过表达miR-122-5p可显著抑制其下游靶基因MeCP2蛋白表达,且Wnt信号通路蛋白Wnt1、β-catenin蛋白,细胞周期蛋白Cyclin D1表达均受到明显抑制(均P<0.05);过表达MeCP2后,可明显上调Wnt1、β-catenin、Cyclin D1蛋白表达(均P<0.05)。同样的,细胞凋亡相关蛋白Caspase3在miR-122-5p mimic作用下表达明显增多,MePC2的上调反而抑制其表达(均P<0.05)(图4A)。这些结果表明,在膜肉瘤细胞中过表达miR-122-5p可以抑制MePC2蛋白调控的Wnt信号通路激活,从而抑制细胞增殖和促进凋亡。

注:A:Western Blot分析MeCP2、Wnt1、β-catenin、Cyclin D1、Caspase3蛋白在不同处理后的表达;B:流式细胞术分析不同处理后细胞周期变化;C:给予γ射线4 Gy剂量照射干预24 h、48 h后各组细胞的凋亡率。*P<0.05图4 miR-122-5p通过MeCP2调控SW982细胞凋亡
为进一步明确miR-122-5p是否通过MeCP2调控SS细胞的放疗敏感性,SW982细胞转染miR-122-5p mimic后,给予4 Gy剂量γ-射线照射后继续培养24 h、48 h,部分细胞再给予转入pcDNA MeCP2过表达MeCP2,通过流式细胞术测定细胞周期。结果显示,与对照组比较,过表达miR-122-5p后SW982细胞出现更多的G1/G0期细胞,而再次转染MeCP2质粒能够抑制这一效果,促使更多的S期、G2/M期细胞转化(均P<0.05)(图4B),表明miR-122-5p/MeCP2信号轴参与细胞周期的调控。对细胞接受γ-射线照射后继续培养24 h、48 h,分析各组细胞的凋亡情况。与对照组相比,miR-122-5p mimic组细胞凋亡明显增加,而转染MeCP2过表达质粒可抑制肿瘤细胞凋亡(均P<0.05)(图4C),该结果表明miR-122-5p/MeCP2信号轴能够调控放疗后细胞凋亡。
3 讨论
SS是一种高度恶性的间叶组织来源肿瘤,占所有软组织肿瘤的8%~10%,其以染色体易位(X;18)(p11.2;q11.2)及SS18-SSX融合基因形成为特征[13]。SS具有极高的复发、转移风险,虽然5年生存率为40%~68%,但其转移率可达50%[2]。目前手术切除联合围手术期的放疗被认为是治疗SS的有效方法。美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南[14]也指出,将放疗作为SS术后的标准辅助治疗。Song等[15]和Naing等[16]研究也证实,辅助放疗可以有效延长SS患者的生存期。陶芳等[17]回顾性研究发现,接受放疗的SS患者中位生存期为114月,而未行放疗的仅为67月,其5年生存率也存在明显的差异。但由于部分患者存在肿瘤细胞对放疗抵抗,导致放疗效果明显受限。因此,研究肿瘤细胞的放疗敏感性及有效增敏手段具有重要的临床意义。
本研究发现,临床SS组织中miR-122-5p较癌旁组织呈低表达,这可能与肿瘤细胞的增殖、分化有关。MeCP2是miR-122-5p的下游靶蛋白,调控SS细胞增殖、细胞周期及放疗敏感性。此外,miR-122-5p/MeCP2可调控Wnt信号通路,可能存在Wnt信号轴介导的放疗敏感性调控。通过上调miR-122-5p能够抑制MeCP2表达,同时显著增加SS细胞的放疗敏感性。MeCP2作为转录因子,如何进一步调控下游蛋白表达,最终影响细胞的放疗敏感性,有待进一步研究。
miR-122-5p已被证实在多种上皮源性肿瘤中发挥重要作用,例如在非小细胞肺癌中通过卵泡抑素样蛋白3抑制肿瘤增殖[18]。在胰腺导管腺癌、胶质瘤中作用于细胞周期蛋白Cyclin G1,抑制肿瘤侵袭、转移[19, 20]。在肝癌中抑制核糖体蛋白L4进而抑制肿瘤进展[21]。Yuan等[22]证实,miR-122-5p在骨肉瘤中明显低表达,上调miR-122-5p后能够抑制解整合素金属蛋白酶10表达,最终通过协调E-cadherin/β-catenin信号通路抑制骨肉瘤细胞侵袭、转移及增殖。本研究发现miR-122-5p/MeCP2在SS放疗敏感性调控方面的相关性。Zhang等[23]研究发现,miR-122-5p还参与乳腺癌细胞对多柔比星的耐药性调控,miR-122-5p能够通过抑制凋亡抑制蛋白Bcl-2和细胞周期依赖性蛋白激酶CDKs,进而促进乳腺癌细胞对多柔比星的化疗敏感性。但目前没有研究涉及miR-122-5p在SS中的作用。本研究发现在SS组织中miR-122-5p发挥抑癌作用,并且能够通过抑制MeCP2蛋白表达增加肿瘤细胞的放疗敏感性,其潜在机制与调控Wnt1/β-catenin信号通路有关。
MeCP2是一种转录因子,Kadam等[24]和Lavery等[25]在Rett综合征患者的体内发现MeCP2基因功能缺失型突变,而且MeCP2的过表达与自闭症、反复感染、过早夭折等有关,也被称为MeCP2重复综合征。而有研究发现MeCP2在多种肿瘤中异常表达,而且与化疗耐药有关。在乳腺癌中通过miR-194-3p抑制MeCP2能够促进多柔比星的化疗敏感性[26]。MeCP2在胶质瘤中参与上皮间质转化(epithelial-mesenchymal transition,EMT)介导的肿瘤细胞侵袭、转移[27]。在骨肉瘤的研究中,MeCP2的异常表达与肿瘤进展密切相关,抑制MeCP2表达能够抑制肿瘤细胞恶性进展[28]。因此,MeCP2可能参与多种恶性肿瘤的增殖、迁移以及恶性进展,然而其在SS中的具体作用及调控机制尚未阐明。本研究发现,MeCP2的表达与miR-122-5p水平呈线性负相关,其在SS组织中呈现明显的高表达。MeCP2的过表达能够阻断miR-122-5p抑制SS增殖、增加肿瘤细胞放疗敏感性的效应,这表明MeCP2在SS中起到促癌作用,而且与肿瘤增殖、放疗抵抗存在关联。
随着人们对软组织肿瘤的不断深入研究,扩大手术范围、化疗并不能达到理想的临床效果,放疗是目前SS比较认可的治疗方法。肿瘤细胞对放射治疗产生抵抗是放疗失败的重要原因,寻找有效的途径提高肿瘤细胞的放射敏感性是目前研究的关键。本研究中miR-122-5p/MeCP2信号轴的发现为进一步探索肿瘤放疗抵抗的机制提供了新的思路。

