维生素D受体在食管鳞癌中的表达及其与预后的关系
孔金玉,王 健,刘怡文,孙 蔚,原 翔,高社干
食管癌是世界上最常见的恶性肿瘤之一,在中国90%以上为鳞状细胞癌[1-2],而目前的预防及治疗手段欠佳,多数患者仍不能得到有效控制,5 a生存率很低[3]。维生素D(vitamin D,VD)是一种与人体健康密切相关的脂溶性维生素。长期以来,人们对VD的研究主要集中在钙、磷代谢的调节作用,近年来,VD在抗肿瘤方面的研究受到越来越多的关注。大量研究表明,VD及其类似物可通过抑制肿瘤细胞增殖、浸润与转移、诱导细胞分化、促进细胞凋亡、抗血管生成等方式发挥抗肿瘤作用[4]。VD发挥生物学效应的受体是广泛分布于体内诸多组织内的VD受体(vitamin D receptor,VDR)。目前,VDR与肿瘤的研究主要集中在乳腺癌、肺癌和结肠癌等[5-7],关于VDR在食管鳞癌组织中的表达水平及与临床病理特征、预后的相关性鲜有报道。本研究拟采用实时定量PCR法检测食管鳞癌组织中VDR的表达水平,并分析其与临床病理特征、预后之间的关系,探讨VDR在食管鳞癌发生、发展中的作用及意义。
1 资料与方法
1.1 一般资料本研究为回顾性研究,收集河南科技大学第一附属医院2012年1月至2014年12月具有明确病理学诊断的原发性食管鳞癌患者组织标本114例,其中男73例,女41例;年龄40~73岁,中位年龄61岁;淋巴结转移者56例;TNM分期Ⅰ/Ⅱ期66例,Ⅲ期48例。另取其中50例手术切除的癌旁组织作为对照,全部标本收集后立即于-80 ℃冰箱保存。
1.2 主要试剂与仪器TRIzol LS Reagent及TaqMan Expression Kit(美国,Invitrogen);M-MLV逆转录酶、0.1 mM DTT、5×First Buffer、RNase Inhibitor和GADPH(美国,Applied Biosystems)。NanoDrop ND1000紫外可见分光光度计(美国,Thermo),7900HT荧光定量PCR(美国,Applied Biosystems)。
1.3 实时定量PCR方法检测VDR mRNA的表达水平取食管癌或癌旁组织标本100~200 mg,液氮中研磨成粉末状;加入1 mL的TRIzol,混合均匀;加入200 μL氯仿,12 000 r·min-1,4 ℃离心30 min;加入等体积异丙醇,-20 ℃放置2 h;12 000 r·min-1,4 ℃离心30 min;弃上清,加入1 mL 75%乙醇,洗涤RNA,混匀;12 000 r·min-1,4 ℃离心10 min;重复洗涤1次;NanoDrop紫外分光光度计检测RNA浓度和纯度;1%琼脂糖凝胶电泳鉴定RNA是否降解;稀释至工作浓度(50 ng·μL-1),-80 ℃保存。按照逆转录试剂盒进行cDNA合成,总反应体系为12 μL。逆转录反应条件:25 ℃ 10 min,37 ℃ 50 min,70 ℃15 min。cDNA 样本在-20 ℃保存。按照TaqMan mRNA Assays的说明进行实时荧光PCR,检测mRNA表达水平。每个PCR 反应体系为5 μL,设3个复孔,反应条件:95 ℃10 min;95 ℃ 15 s,60 ℃ 60 s;40个循环。以GADPH为内参,Log10(2-ΔΔCt)表示VDR mRNA相对表达量。
1.4 随访根据病历信息进行随访,死于其他疾病、失访或随访截止时间仍存活视为截尾数据。114例患者中死亡66例,均死于食管癌相关的并发症或复发远处转移;总生存期(overall survival, OS)定义为确诊日期至死亡日期或最近一次随访日期(2020年12月)。
1.5 统计学处理采用SPSS 19.0软件包进行统计分析,采用 Log10(2-ΔΔCt)计算mRNA相对表达量,mRNA在癌和相应癌旁组织中的表达比较采用配对t检验,VDR mRNA表达水平与临床病理特征的相关性采用χ2检验。Kaplan-Meier法绘制生存曲线,Log-rank检验生存时间的差异。α=0.05,以P<0.05为差异具有统计学意义。
2 结果
2.1 VDR mRNA在食管鳞癌及癌旁组织中的表达水平应用实时定量PCR方法检测50例食管鳞癌及相应的癌旁组织中VDR mRNA的表达水平,结果显示,VDR mRNA在食管鳞癌组织中平均表达水平(5.39 ± 0.52)低于癌旁组织(5.92 ± 0.54),差异有统计学意义(t=4.958,P<0.05)。见图1。
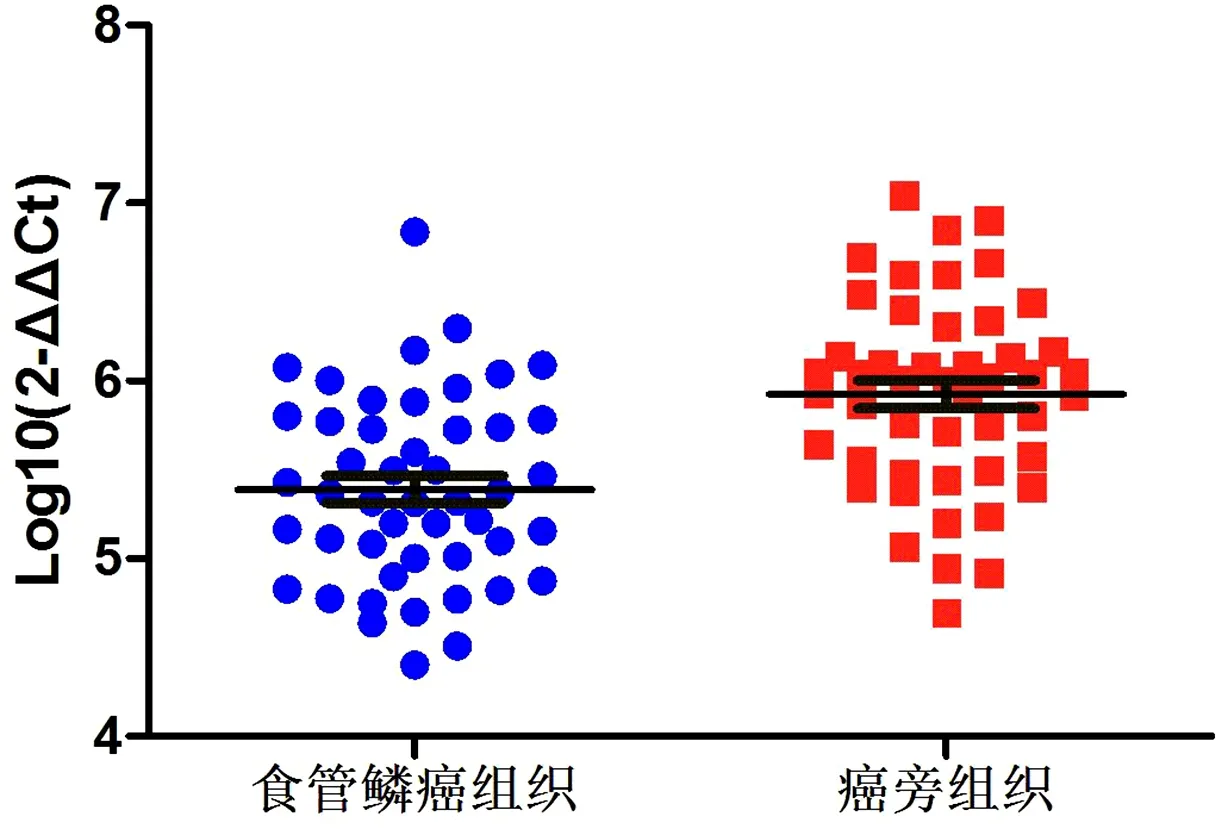
图1 VDR mRNA在食管鳞癌组织及癌旁组织中的表达水平
2.2 VDR mRNA表达与临床病理特征相关性分析进一步检测VDR在114例食管鳞癌中的表达,利用VDR mRNA表达的中位值(5.550)将患者分成高表达、低表达两组。如表1所示,VDR基因表达水平和性别(χ2=6.437,P=0.011)、吸烟(χ2=3.947,P=0.047)和淋巴结转移相关(χ2=5.054,P=0.025),差异有统计学意义。
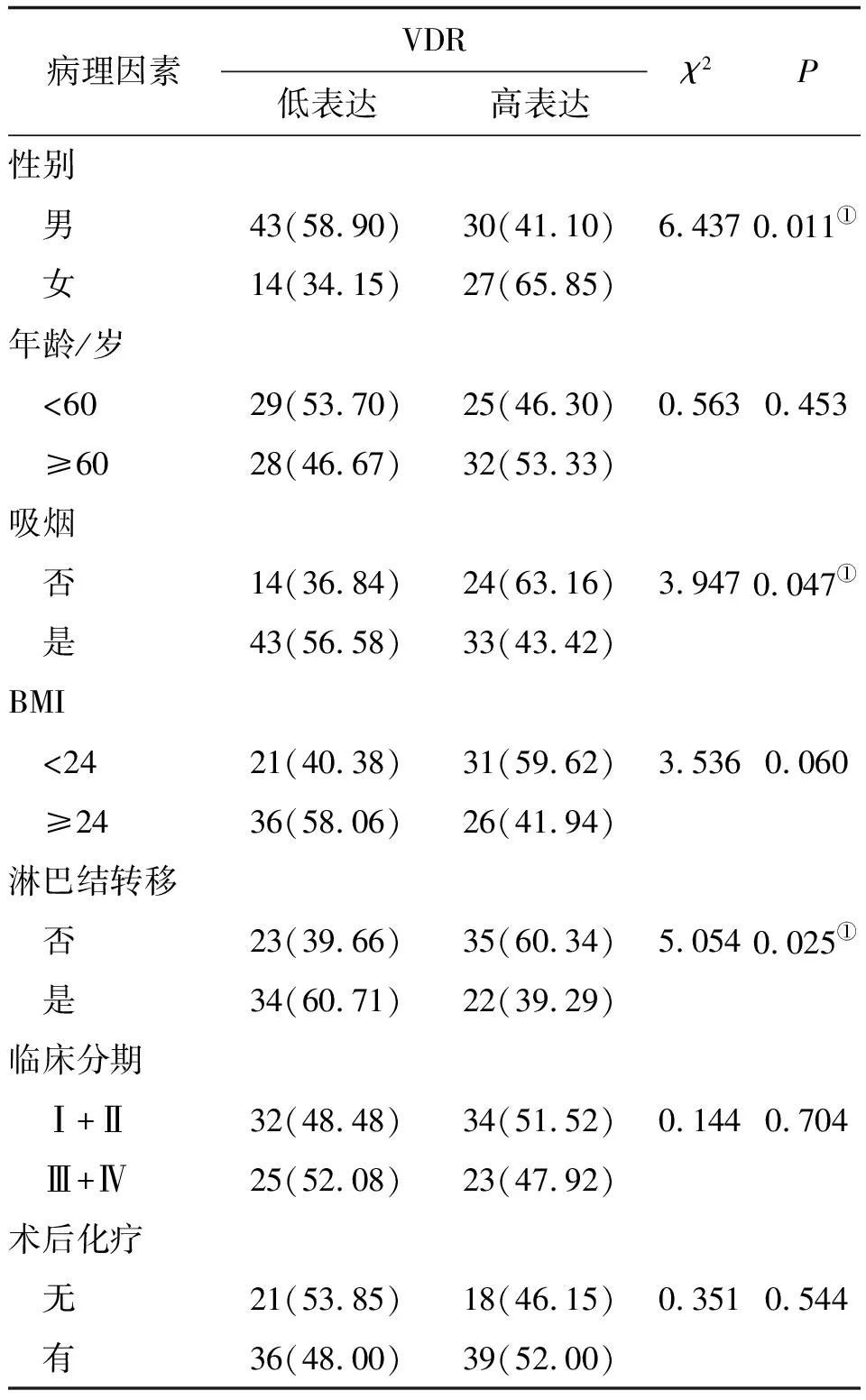
表1 食管鳞癌组织中VDR mRNA表达与临床病理特征的关系 例(%)
2.3 VDR mRNA表达与食管鳞癌预后的关系运用Kaplan-Meier法绘制生存曲线,采用Log-rank检验比较生存时间的差异,分析VDR mRNA表达与食管鳞癌患者预后的相关性,图2结果显示,114例食管鳞癌患者术后VDR mRNA高表达组中位生存期为65.5个月,明显高于低表达组(22.7个月),提示VDR mRNA高表达与食管鳞癌患者生存预后较好有关(χ2=4.906,P=0.027)。
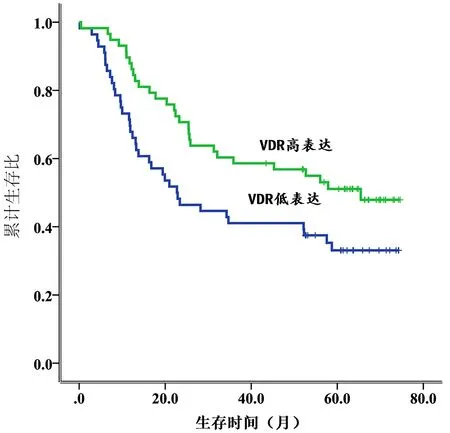
图2 食管鳞癌中VDR mRNA高表达与低表达的生存曲线
3 讨论
维生素D是一种脂溶性的类固醇衍生物,在骨代谢和钙稳态中发挥重要作用,近年来研究发现,VD具有潜在的抗肿瘤作用,其抗肿瘤作用机制包括抑制肿瘤细胞增殖、侵袭转移、诱导细胞凋亡、促进细胞分化等。除此之外,VD还参与调节免疫、抑制炎症等多个生物学过程[8]。VDR广泛分布于小肠、肾、骨、皮肤、甲状旁腺、结肠、乳腺、胰腺等正常组织中,同时也表达于这些组织的癌细胞中[9]。VD的生物学功能是通过与VDR结合调节靶基因转录来实现的,当游离的1,25(OH)2D3进入细胞后被转移至核内,与VDR结合并使VDR发生磷酸化,从而导致VDR构象的改变,进而与类视黄醇X受体(retinoid X recepto,RXR)结合形成异质二聚体,VD-VDR复合物作为转录因子,作用于其靶基因启动区中的特异DNA序列(维生素D反应元件,vitamin D responsive element,VDRE),从而激活或抑制基因转录[10]。
VDR表达于大多数肿瘤细胞中,包括食管癌。既往VDR和食管癌的研究主要为腺癌,在食管腺癌中VDR表达水平随着肿瘤去分化而下降。与食管正常鳞状上皮相比,VDR在Barrett食管黏膜中的表达显著升高[11-12]。在食管鳞癌细胞中VDR基因多态性和不良预后相关[13]。Mimori K等[14]研究发现,与正常食管组织相比,VDR在食管癌组织中表达较低,其低表达与预后较差相关,表现为肿瘤细胞的淋巴结转移、浸润侵袭及血行扩散能力增强。该研究提示VDR表达下调可能在食管癌的进展中发挥着重要作用,而VDR基因表达上调具有改善食管癌预后的潜在可能。另外,相关体外及动物模型研究表明,VD能抑制食管鳞癌细胞增殖,使细胞周期阻滞在G0/G1期,并诱导肿瘤细胞凋亡[15-16]。
本研究采用实时定量PCR法检测VDR mRNA在食管鳞癌中的表达水平,并分析其与临床病理特征及预后的相关性。研究发现VDR mRNA在食管鳞癌组织中的表达显著低于相应的癌旁组织。VDR mRNA低表达与预后较差、生存时间较短相关。本研究结果与相关文献报道一致[14]。除此之外,VDR mRNA表达与食管癌患者性别、吸烟及淋巴结转移相关,提示VDR mRNA低表达在食管癌患者中男性多于女性,吸烟患者多于非吸烟患者,VDR mRNA低表达患者易发生淋巴结转移。
综上所述,本研究表明VDR mRNA在食管鳞癌组织中的表达水平显著低于癌旁组织,且其表达与患者的临床病理类型及预后密切相关。VDR有望成为食管鳞癌预后的判断指标及潜在的治疗靶点。

