不同浓度光敏剂对食管癌疗效的回顾性分析
单探幽,李婉莹,高社干
光动力治疗(Photodynamic therapy,PDT)作为肿瘤治疗的一种有效补充,在早期、中晚期食管癌中均取得了良好疗效。保证光动力疗效的两大关键因素为光敏剂及合适波长的激光照射。肿瘤在相同的光能量、不同的光敏剂剂量下对治疗效果有一定影响。本课题组回顾性分析了进行光动力治疗的38例中晚期吞咽困难食管癌患者,对不同剂量的光敏剂剂量进行分析研究,现报道如下。
1 临床资料
1.1 一般资料选择2019年1月至2020年1月河南科技大学第一附属医院收治的吞咽不利的食管癌患者38例,根据光敏剂血卟啉剂量分组。高剂量组(3 mg·kg-1)15例,其中男8例,女7例,年龄50~77岁,中位年龄65岁;均经胃镜活检病理确诊为鳞状细胞癌;根据食管癌吞咽困难评分标准(Stooler吞咽困难分级),Ⅰ级0例,Ⅱ级4例,Ⅲ级10例,Ⅳ级2例。低剂量组(2 mg·kg-1)23例,其中男15例,女8例;年龄51~73岁,中位年龄65岁;均经胃镜活检病理确诊为鳞状细胞癌;根据食管癌吞咽困难评分标准(Stooler吞咽困难分级),Ⅰ级0例,Ⅱ级4例,Ⅲ级13例,Ⅳ级6例。见表1。
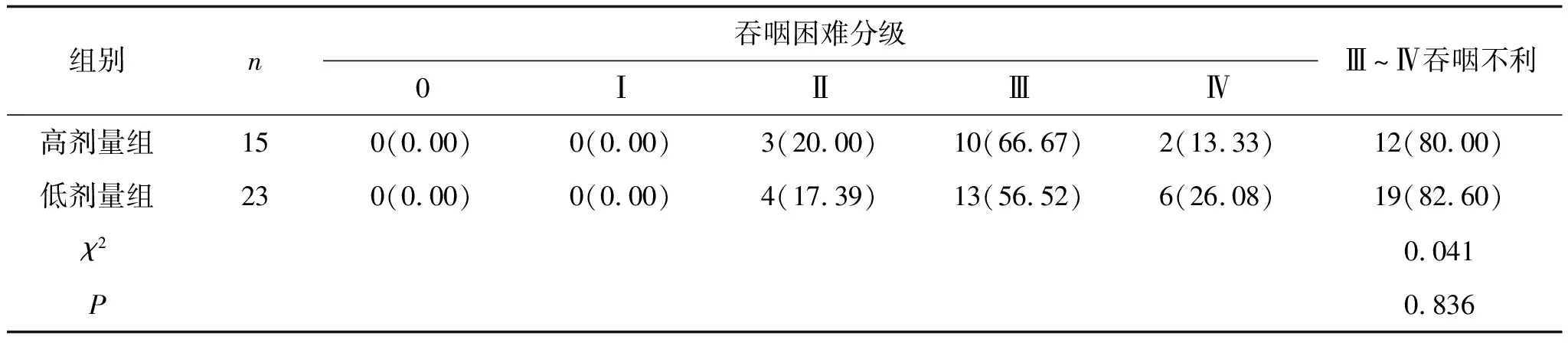
表1 两组患者吞咽困难对比 例(%)
1.2 药物与仪器使用国产雷迈公司的630PDT治疗仪,最大输出功率均达2 000 mW;光敏剂使用重庆迈乐制药有限公司的血卟啉注射液。
1.3 治疗方法
1.3.1 高剂量组注射光敏剂:用药前将冰冻药品置室温避光融化,取原液在患者前臂做皮肤划痕试验,观察15 min,皮试如无红肿硬结等过敏现象,则按照3 mg·kg-1的剂量加入250 mL生理盐水中,在1 h内滴注完毕,滴注过程中严密观察患者生命体征。滴注结束后48 h,进行激光治疗。光动力照射:取左侧卧位,咽部麻醉后插入胃镜,观察食管腔内情况,确定病变的部位和大小,若食管管腔狭窄致胃镜不能通过,先行探条或球囊适当扩张[6],或更换超细胃镜,将病变置于视野中央,由活检孔插入柱状光纤,使光纤尽量贴近病变位置进行照射,根据病变的范围采用不同的柱状光纤(弥散端长度2.5~4.0 cm),照射范围需超过病灶边缘0.5 cm,充分覆盖病灶。治疗结束后观察有无活动性出血及其它异常,如无异常退镜。术后监测生命体征。照射光剂量为300~400 mW·cm-2,照射时间为750~1 200 s,柱状光纤设定能量密度为225~480 J·cm-2。
1.3.2 低剂量组注射光敏剂:光敏剂按照2 mg·kg-1的剂量加入250 mL生理盐水中,在1 h内滴注完毕,滴注过程中严密观察患者生命体征。方法同高剂量组。
1.3.3 疗效评价本研究针对食管癌晚期姑息治疗病人,以实体瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST)为基础[23],内镜下测量管腔直径和稀钡造影综合判断肿瘤大小和管腔狭窄的最小直径进行判定。评价标准中仅设部分缓解(partial response,PR)、病情稳定(stable disease,SD)和疾病进展(progression disease,PD),不设完全缓解(complete response,CR)。选择光动力治疗后1个月、3个月进行疗效评价。判定标准:治疗前后分别测量狭窄段最小直径,PR为治疗后最小直径增加≥30%;PD为治疗后最小直径缩小≤20%;SD为治疗后最小直径变化在PR和PD两者之间。
2 结果
2.1 毒副反应两组患者出现的毒副反应有光过敏反应、胸骨后疼痛、穿孔、发热、出血。其中高剂量组发生光过敏反应20.00%(3/15)、胸骨后疼痛86.67%(13/15)、穿孔6.67%(1/15)、发热6.67%(1/15)、出血6.67%(1/15)。低剂量组发生光过敏反应8.70%(2/23)、胸骨后疼痛47.83%(11/23)、出血43.48%(1/23)。低剂量组除在胸骨后疼痛方发生率低于高剂量组(P<0.05),其余毒副反应发生率两组无差异。见表2。
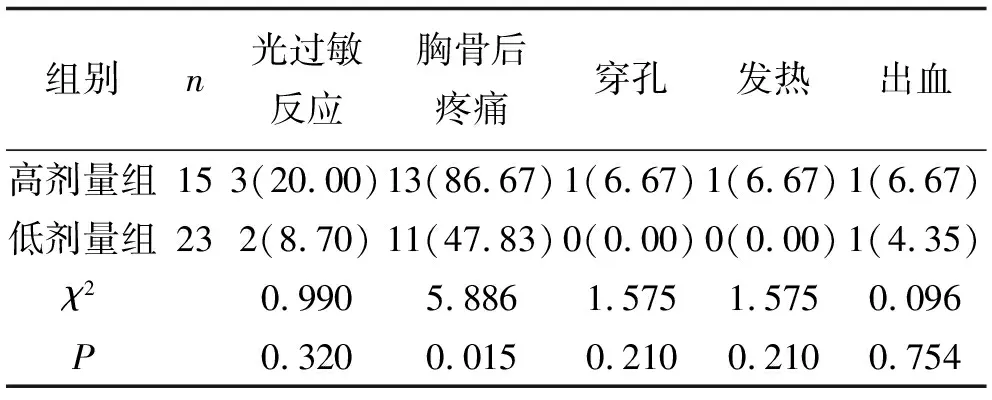
表2 两组患者的毒副反应比较 例(%)
2.2 1个月后疗效对比高剂量组治疗前Ⅲ~Ⅳ吞咽不利率为80.00%,治疗1个月后Ⅲ~Ⅳ吞咽不利率为13.33%,明显低于治疗前,且差异有统计学意义(P<0.05),见表3。低剂量组治疗前Ⅲ~Ⅳ吞咽不利率为82.61%,治疗1个月后Ⅲ~Ⅳ吞咽不利率为17.39%,明显低于治疗前,且差异有统计学意义(P<0.05),见表4。两组治疗1个月后Ⅲ~Ⅳ吞咽不利率相比,差异无统计学意义(P>0.05),见表5。
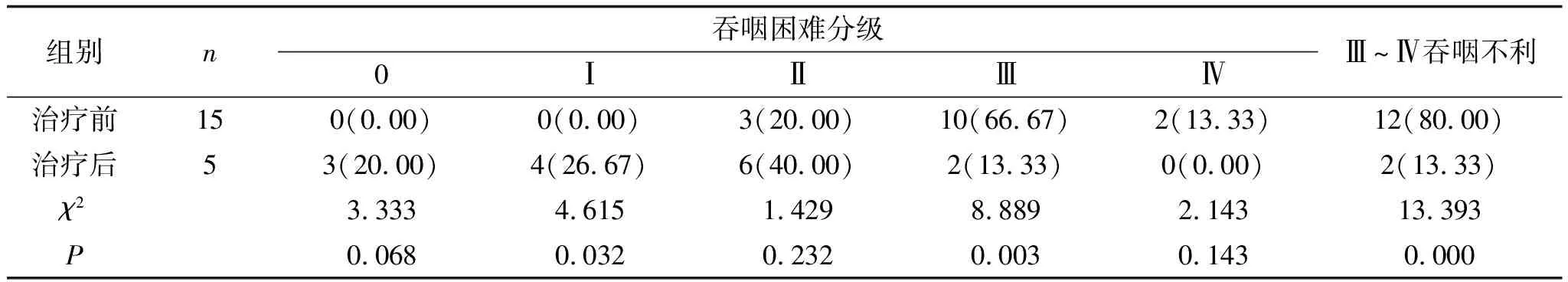
表3 高剂量组患者治疗前后Ⅲ~Ⅳ级吞咽不利的比较(1个月) 例(%)
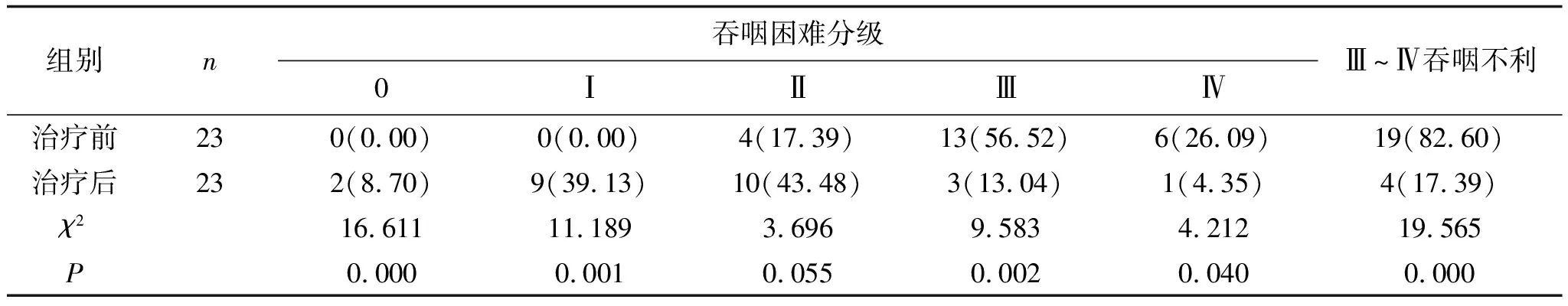
表4 低剂量组患者治疗前后Ⅲ~Ⅳ级吞咽不利的比较(1个月) 例(%)
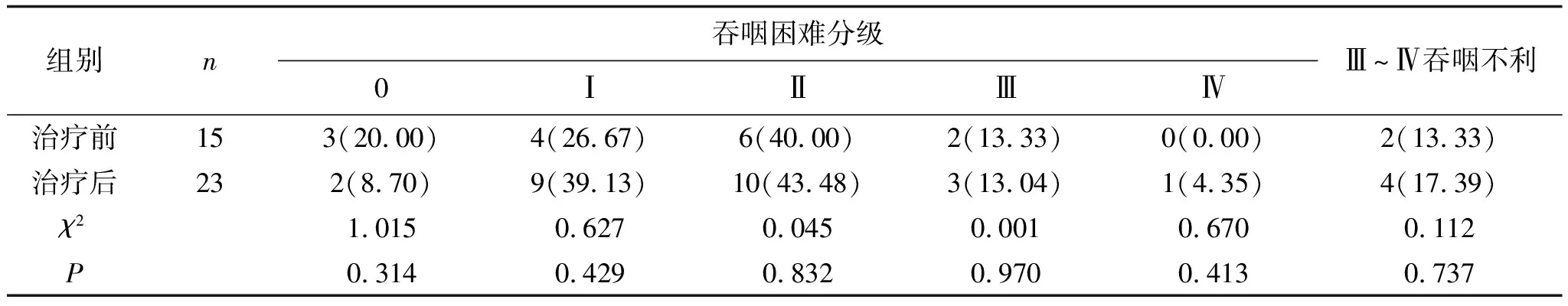
表5 两组患者治疗术后1个月Ⅲ~Ⅳ级吞咽不利的比较 例(%)
2.3 3个月后疗效对比高剂量组治疗前Ⅲ~Ⅳ吞咽不利率为80.00%,治疗3个月后Ⅲ~Ⅳ吞咽不利率为53.33%,明显低于治疗前,且差异无统计学意义(P>0.05),见表6。低剂量组治疗前Ⅲ~Ⅳ吞咽不利率为82.61%,治疗3个月后后Ⅲ~Ⅳ吞咽不利率为26.09%,明显低于治疗前,且差异有统计学意义(P<0.05),见表7。两组治疗3个月后Ⅲ~Ⅳ吞咽不利率相比,差异无统计学意义(P>0.05),见表8。
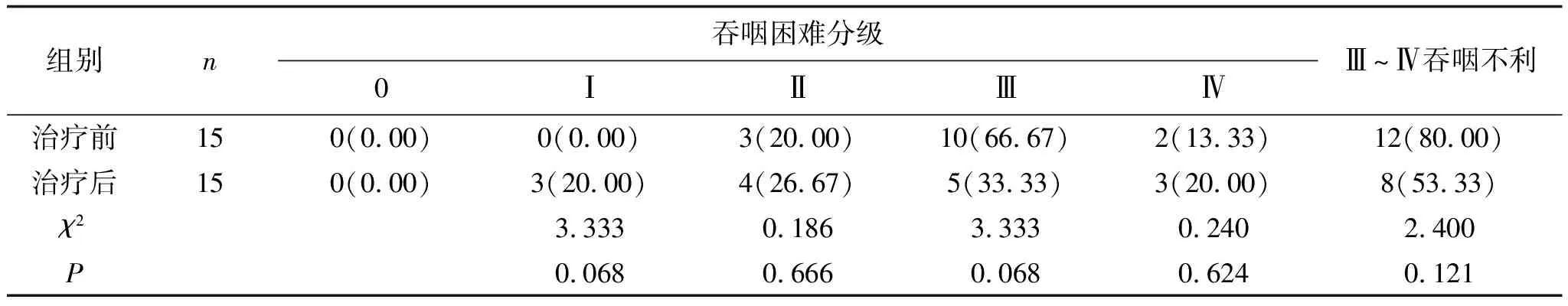
表6 高剂量组患者治疗前后Ⅲ~Ⅳ级吞咽不利的比较(3个月) 例(%)
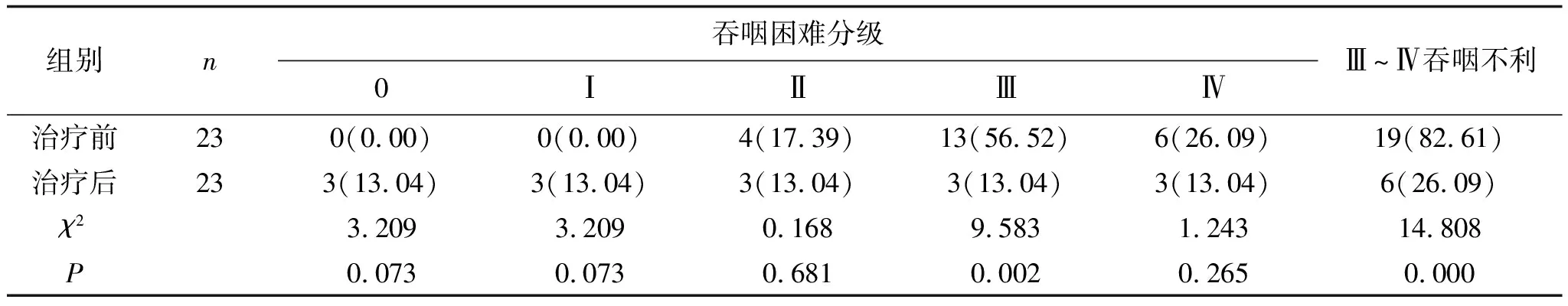
表7 低剂量组患者治疗前后Ⅲ~Ⅳ级吞咽不利的比较(3个月) 例(%)
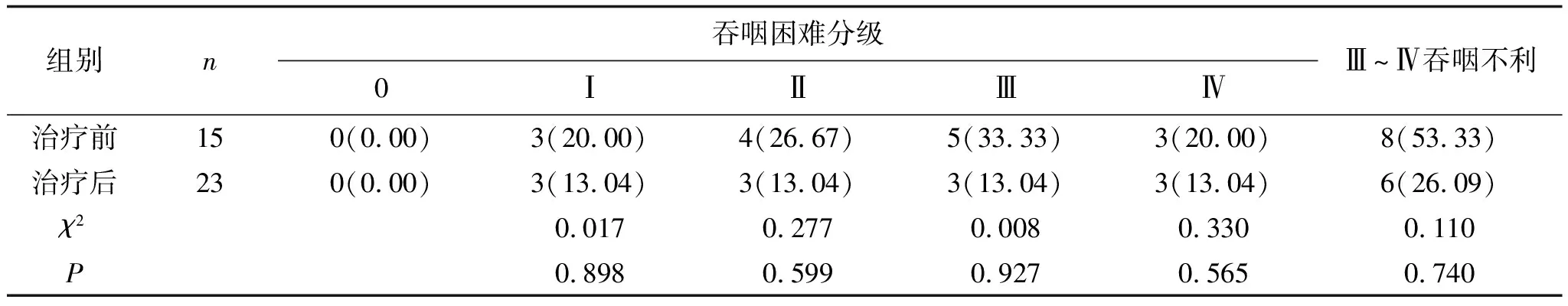
表8 两组患者光动力治疗术后3个月Ⅲ~Ⅳ级吞咽不利的比较 例(%)
3 讨论
食管癌是临床上常见的消化道肿瘤,全球范围内其发病率居第七位,死亡率居第六位[1]。早期食管癌可通过胃镜下切除达到根治效果,中晚期食管癌治疗方法包括手术、放疗、化疗及内镜治疗,也可以联合应用。外科手术是食管癌的首选方法,但由于局部复发和远处转移,术后的5 a生存率并不尽如人意。单纯放疗多用于颈段、胸上段食管癌,但单纯放疗对远处转移的病灶无法控制,接受传统剂量单纯放疗5 a存活率仅在0%~10%之间[2-3]。NCCN指南推荐DDP + 5-FU 方案为食管癌的标准治疗方案,但易引起强烈的毒副反应且疗效有限[4]。由于部分患者就诊时已是晚期,丧失手术机会,且合并食管梗阻或进食困难,寻找高效缓解患者症状、提高生存质量的治疗方法是临床急需解决的重要问题。
PDT是上世纪70年代发展起来的,指利用光敏剂及相应光源,诱发光化学反应、破坏肿瘤细胞的一种新型疗法。对不宜手术的中晚期食管癌患者行PDT 能减小肿瘤病变范围、缓解临床症状,毒副作用轻微,提高生存质量[5]。PDT 治疗晚期及术后复发的食管癌,短期完全应答率为 15%,中位生存期2.9~13.8个月,可明显缓解吞咽困难和出血等并发症,改善患者生存质量[6-7]。PDT需具备3个基本要素:光敏剂、激发光和分子氧。根据光敏剂亲肿瘤组织的特性,在特定波长激发光的照射下,光敏剂获得能量,由基态转化为激发态,聚集在肿瘤组织中的光敏剂可将光子的能量传递给肿瘤组织中的氧,使之成为激发态的单线态氧,进而破坏肿瘤细胞中多种生物大分子,引起肿瘤细胞凋亡与坏死[8]。此外,PDT还可以造成血管内皮细胞和基底膜损伤,引起微血栓形成、血管活性分子释放增加和血管壁通透性增高,从而导致肿瘤微循环障碍[9]。同时肿瘤细胞对光敏剂有优势摄取及滞留时间较长的特点,保证了其他正常组织受影响最小。目前已有多项研究报道PDT在各种肿瘤治疗中疗效可靠[10-12]。虽然PDT 在临床上具有良好的安全性,但同时也存在一定的不良反应,比如光敏剂在皮肤中排泄慢,极易产生皮肤毒性反应,应严格避光;在消化道的治疗中,由于肿瘤坏死可引起穿孔或出血;血卟啉衍生物(hematoporphyrin derivative,HPD)有潜在的严重不良反应,如心肌梗塞、心跳骤停等[13-15]。PDT治疗为恶性肿瘤治疗提供了新的方法,但临床疗效不稳定[8]。PDT联合化疗对胆管癌、宫颈癌、皮肤癌、食管癌可明显抑制肿瘤细胞的增殖,诱导肿瘤细胞凋亡[16-17]。PDT能有效激活宿主免疫,其介导的氧化应激和某些光敏剂可能会产生特殊的肿瘤抗原,使 PDT 治疗的癌细胞比其他方法杀死的癌细胞更具免疫原性,PDT与免疫治疗联合可增强抗肿瘤效果[18]。
本研究共纳入38例中晚期吞咽困难的食管癌患者,对光动力治疗的疗效、安全性及剂量进行了研究。结果显示PDT治疗食管癌能有效缓解吞咽困难,且低剂量组疼痛、食管瘘的发生率明显低于高剂量组。表明光动力治疗在缓解病情的同时,可明显改善患者生存质量,显示了良好的临床前景,但缺乏临床大样本及长期的疗效观察,有待进一步研究。作者将继续随访患者生存期,为临床研究提供数据,同时也将继续探索如何增强PDT治疗的抗肿瘤效果,推动PDT治疗的临床应用。

