TAP检测联合增强CT对食管癌术前淋巴结转移评估的临床意义
肖中岳,轩青霞,袁小志
食管癌(esophage cancer,EC)是一种以进行性吞咽困难为典型临床症状的较为常见的消化道恶性肿瘤。最新数据显示,在世界范围内食管癌的发病率居第六位,而中国的发病率为11.28/10万,是世界水平的1.79倍[1-2]。与国外不同,中国食管癌以中上段食管鳞癌居多,由于大部分食管癌发现较晚,中国食管癌5 a生存率仅有30.3%[3],与许多发达国家有相当大的差距。目前手术治疗仍是食管癌患者最为有效的治疗手段,可以明显提高患者的生存率[4]。淋巴结清扫是食管癌手术成功与否的关键,术前有效的淋巴结转移评估对手术治疗具有不可替代的指导意义。食管癌患者术前淋巴结评估最主要的手段为增强CT,但单一的增强CT评估具有一定的局限性[5]。肿瘤异常蛋白(Tumor Abnormal Protein,TAP)作为重要的肿瘤标志物,对多种消化道肿瘤早期筛查和临床诊治具有重要指导意义[6],但是否对食管癌淋巴结转移评估具有指导意义,仍缺乏相关研究。本文通过回顾性分析术前增强CT判断淋巴结转移阳性食管癌患者的临床及TAP资料,探讨术前TAP检测对食管癌淋巴结转移评估的意义,现报道如下。
1 资料与方法
1.1 一般资料回顾性分析自2018年3月至2020年3月在河南科技大学第一附属医院就诊的53例食管癌患者,其中男性37例,女16例,年龄47~82岁,平均63.9岁。纳入标准:①术前增强CT评估患者淋巴结转移阳性的诊断标准为最大淋巴结短径≥10 mm;②术前未接受放疗、化疗、免疫治疗等抗肿瘤治疗;③CT资料完整且距手术时间不超过1个月;④所有患者均接受食管癌根治性手术并行系统淋巴结清扫,且术后病理证实为食管鳞癌。排除标准:①CT图像无法达到测量标准;②存在其他原发肿瘤病史。
1.2 CT检查采用东芝 320层CT进行扫描。患者禁食8h以上,扫描前10~15 min饮用500~750 mL纯净水,扫描前再饮用250 mL,取平卧位,先行平扫,参数:120 kV,200 mAs,层厚5 mm,层间距5 mm,深吸气后屏气扫描。增强CT采用经肘正中静脉团注对比剂80~100 mL,剂量2 mL·kg-1,扫描参数:120 kV,300~160 mA,层厚5 mm,层距5 mm。嘱患者屏气后自锁骨上开始扫至双肾下缘。检测气管分叉水平降主动脉CT值达到200 HU,注入后10 s开始胸部动脉期扫描,40 s后开始行病灶区延迟期扫描。
1.3 图像分析CT扫描图像上传至医学图像存档与通信(picturearchiving and communication systems,PACS)系统并通过医学影像诊断工作站调阅。由2名资深胸部影像学医师在不知晓病理结果的情况下共同阅片,另有1名高级医师负责质控。记录最大淋巴结短径,以最大淋巴结短径≥10 mm为判定转移的标准,记录转移淋巴结数目。
1.4 实验室检查术前行血清TAP检测,以末次检测结果为准。
1.5 统计学分析采用SPSS 22.0统计分析软件,卡方检验和秩和检验用于资料组间比较,采用ROC曲线进行分析,对曲线下面积、相应的敏感度、特异度、准确率和尤登指数进行计算。以P<0.05表示差异有统计学意义。
2 结果
2.1 临床病理特征分析53例患者中男性37例(69.81%)、女性16例(30.19%),增强CT术前诊断淋巴结转移的假阳性率为37.74%(20/53),卡方检验和秩和检验结果显示患者G分期(P=0.001)、T分期(P=0.002)及最大淋巴结短径(P=0.002)均为食管癌患者淋巴结转移的影响因素。其临床病理学特征见表1。
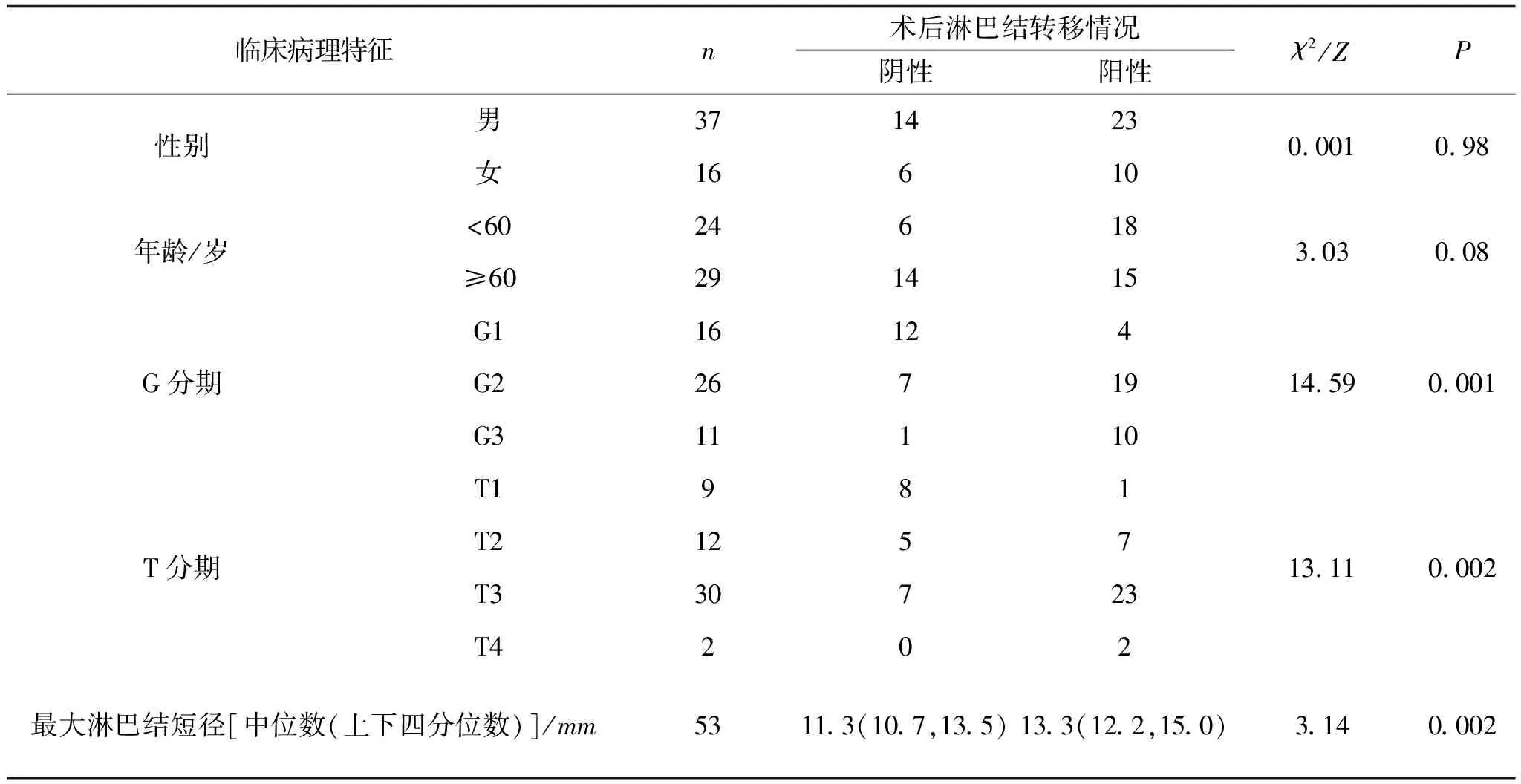
表1 食管癌患者临床病理特征的相关性分析(n=53) 例
2.2 ROC曲线分析以TAP≥121 μm2为诊断术前临床判断淋巴结转移的最佳标准,曲线下面积为0.751,敏感度60.61%,特异度80.00%,准确率66.03%,尤登指数0.41。见图1。
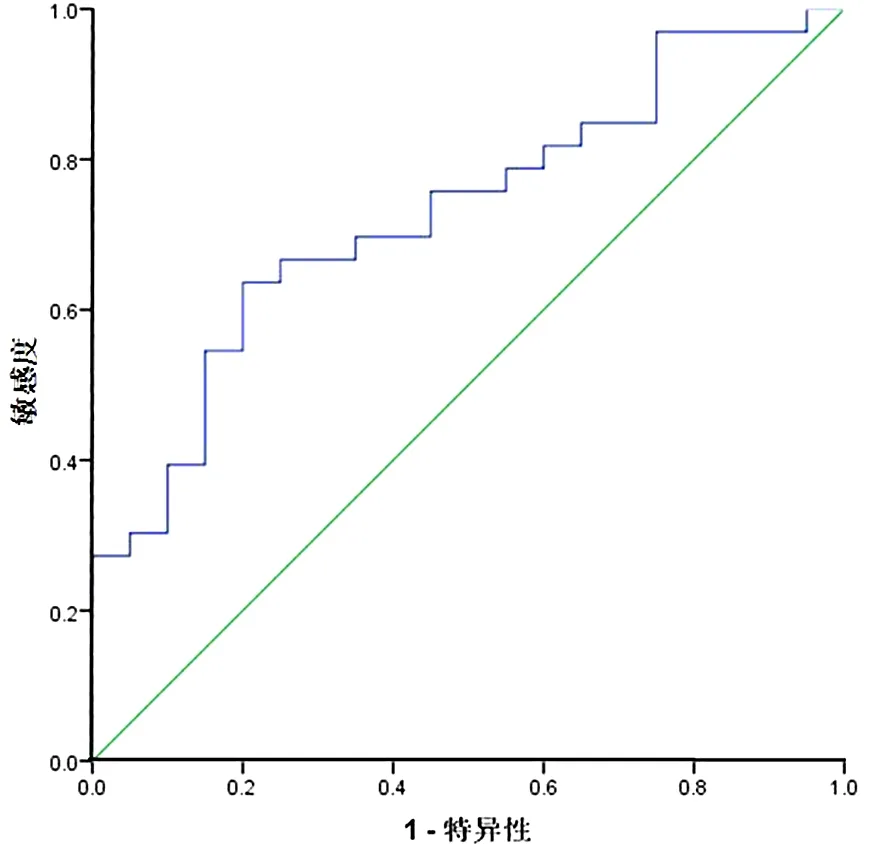
曲线下面积:0.751;P=0.002;95%可信区间(0.612~0.890)。
2.3 TAP对食管癌术前淋巴结转移的评估以TAP≥121 μm2为分界,将TAP分为正常组及升高组行卡方检验显示:术前血清TAP水平(P=0.014)是食管癌淋巴结转移的独立影响因素,比值比(odds ratio,OR)4.615,95%可信区间(1.497,14.232);对于临床判断为淋巴结转移阳性的患者,术前TAP升高者其转移风险是正常患者的4.615倍,以血清TAP进一步筛查术前增强CT诊断为淋巴结转移的假阳性率下降为9.43%(5/53),见表2、图2。

表2 根据术前血清TAP水平诊断临床食管癌患者淋巴结转移(n=53) 例(%)
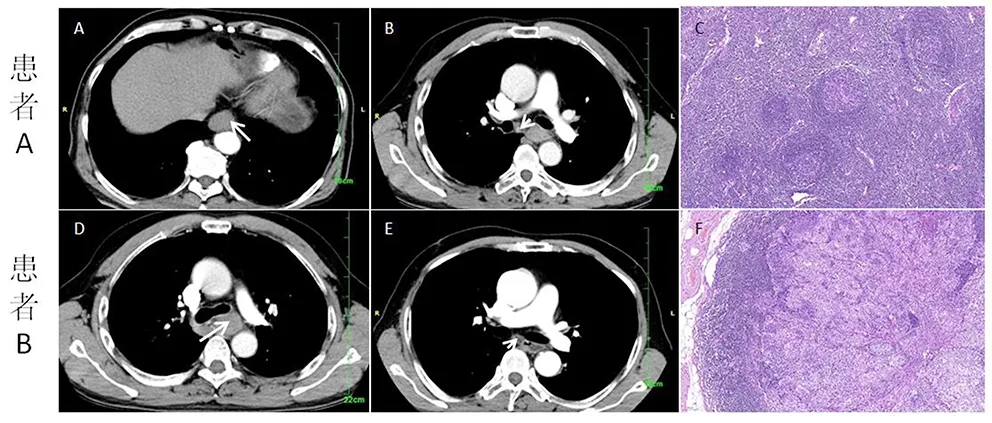
患者A,男,54岁,食管癌,肿瘤(A,箭头),术前血清TAP正常(115.31 μm2)支气管隆突下淋巴结(B,箭头),约12.17 mm × 10.99 mm,术后病理(C)证实淋巴结无转移(HE,×100);患者B,男,64岁,食管癌,肿瘤(D,箭头),术前血清TAP升高常(128.13 μm2)支气管隆突下淋巴结(E,箭头),约11.21 mm × 10.30 mm,术后病理(F)证实为淋巴结转移(HE,×100)。
3 讨论
最新资料显示,中国每年食管癌发病率为14.58/10万,死亡率为10.80/10万,其发病率及死亡率几乎占到全世界近一半的数量[1-2]。食管癌的主要症状为进行性的吞咽不利,部分患者有吞咽时胸骨后疼痛等症状,如未进行有效治疗患者可能发展为吞咽困难甚至完全梗阻,并可能出现持续性疼痛、声音嘶哑、饮水呛咳等症状,严重时可出现呕血、重度肺部感染等并发症,最终危及患者生命。目前临床上食管癌的主要治疗方法为手术、放疗、化疗,或辅以免疫治疗等新型治疗方法。作为重要的治疗手段,手术治疗能够有效地延长患者生存期,提高5 a生存率[4]。但手术治疗具有一定的局限性,术前评估尤其是对淋巴结转移的术前评估对于患者是否需要术前辅助治疗,并制定最佳治疗方案显得尤为重要。目前临床术前评估食管癌是否发生淋巴结转移的主要手段为增强CT,但单纯依靠淋巴结径线进行判断准确率较低[5]。临床上通常以最大淋巴结短径≥10 mm淋巴结转移的阳性判断标准,但有研究显示,63%的食管癌患者的转移淋巴结最小直径<10 mm。也有研究显示以最大淋巴结短径≥8 mm为判断标准可以提高术前评估的敏感性,但特异性有所降低[7-9]。总之,由于肿瘤转移、炎细胞浸润或组织增生等原因均可引起淋巴结肿大,因此单一使用增强CT图像上淋巴结大小判断转移情况无法满足术前淋巴结评估的需要,进行淋巴结转移的相关因素分析,增加辅助诊断方法具有十分重要的意义。
TAP是由异常糖蛋白、钙组蛋白和细胞癌变后基因表达的常见物质组成的复合物。在致癌因子的刺激下,原癌基因和抑癌基因逐渐发生变化,基因突变导致功能蛋白的改变,从而产生糖链异常的糖蛋白。与正常糖蛋白相比,这些糖蛋白的糖链更长,分支结构更复杂,质和量都不正常[10]。TAP可以间接反映癌细胞的数量和程度。当肿瘤细胞生长到一定数量时,这些物质大量排放到血液中,并能在外周血中检测到[11]。以往的研究表明,TAP与肺癌、胃癌、甲状腺癌等多种肿瘤的诊断及预后有关[12-14],特别是在癌症早期筛查方面,与传统的肿瘤标志物CEA等相比,有一定的优势[15]。
血清TAP检测及胸部增强CT检查在临床上简单易行,对临床初始治疗具有指导作用。既往对于TAP的研究多注重于癌症的早期筛查,其对淋巴结转移评估的作用尚缺乏相关研究。Cheng YJ等[16]的研究显示,TAP与肺癌淋巴结转移具有相关性,并且与患者的预后相关。本研究发现,TAP是食管癌淋巴转移的危险因素,ROC曲线分析显示:以TAP≥121 μm2为诊断术前临床判断食管癌淋巴结转移的最佳标准,对于术前淋巴结评估≥10 mm的患者,术前血清TAP升高,其淋巴结转移的风险也相应增加,对食管癌术前淋巴结转移评估有重要意义。结合术前TAP检测可以有效降低淋巴结评估的假阳性率。本组术前增强CT诊断的临床淋巴结转移患者37.74%(20/53)为假阳性,结合术前血清TAP检测后,其淋巴结转移假阳性率下降为9.43%(5/53)。
综上所述,术前评估胸部增强CT发现最大淋巴结短径≥10 mm的食管癌患者,其术前血清TAP升高是淋巴结转移的危险因素。术前进行血清TAP检测可以降低增强CT对淋巴结转移评估的假阳性率,从而帮助临床医师制定术前治疗策略。

