致病性大肠杆菌全基因组测序及毒力基因分析
周 倩,王嘉福*,冉雪琴,牛 熙,黄世会
1.贵州大学生命科学学院,贵州贵阳 550025;2.贵州大学动物科学学院,贵州贵阳 550025
大肠杆菌存在于人和动物肠道中[1],某些大肠杆菌是导致仔猪腹泻的主要病原菌之一[2],其导致的疾病发病率高、发病急、死亡率高、涉及范围广,给养猪业造成巨大经济损失,严重影响了养猪业的发展[3]。然而由该菌引发的疾病目前缺少有效的治疗手段,临床上主要以母体抗原、抗血清、抗生素等为主,容易产生耐药性、药物残留等问题[4-5]。
大肠杆菌通过黏附素黏附于断奶仔猪小肠上皮细胞,就定居在小肠上并开始大量繁殖并产生毒素,产生的毒素被吸收后,引起胃肠道血管、皮下组织和脑血管的损伤,从而使宿主发生一系列疾病[6]。致病性大肠杆菌侵袭宿主组织引起其发病的过程是由多种毒力因子相互协调而发挥作用,大肠杆菌的主要毒力因子包括毒素、黏附素、外膜蛋白、铁转运系统和吸收系统等[7]。为研究致病性大肠杆菌致病力差异的原因,采用二代高通量测序技术对7株不同致病力的大肠杆菌进行全基因组测序,分析毒力基因的差异,以期解析大肠杆菌的致病因子和致病机制。
1 材料与方法
1.1 材料
菌株P211、P555、P32、P444和P111由本实验室从贵州某猪场腹泻仔猪粪样中分离,菌株S10670、E24190购自中国工业微生物菌种保藏管理中心。40只SPF级小鼠购自北京斯贝福生物技术有限公司。
1.2 菌株纯化鉴定
使用EMB、MAC和LB固体培养基对7菌株进行纯化,随后对菌株进行革兰氏染色镜检和生理生化鉴定,再用细菌16S rDNA基因通用引物27F和1 492R进行扩增(表1),扩增产物进行Sanger测序,用NCBI网站对测序产物进行Blast同源比对,对菌株进行分子系统学鉴定。

表1 细菌16S rDNA扩增引物
1.3 小鼠致病性试验
挑取单个纯化后的7株菌株于LB液体培养基中培养至浓度为1×108CFU/mL的菌悬液,将40只小鼠随机分为8组,7个实验组和一个对照组,每组5只小鼠,实验组小鼠的给药途径、给药方法和给药剂量参照《药理实验方法学》的动物实验技术进行[8],按照10 g/0.2 mL 的剂量腹腔注射菌悬液,对照组则按照10 g/0.2 mL 的剂量腹腔注射生理盐水。正常饲喂,自由饮水,感染后观察48 h,记录小鼠临床症状和死亡时间,死亡小鼠及时剖检观察内脏组织病变并制作病理切片,观察病理变化。
1.4 测序样品
挑取单个纯化鉴定后的菌株用LB液体培养基中培养于37 ℃、160 r/min培养过夜后收集菌体,使用细菌基因组DNA提取试剂盒提取基因组,经酶标仪及1%的琼脂糖凝胶电泳检测其浓度、纯度均达到基因组DNA 的测序要求后进行全基因组测序。测序工作由华大深圳股份有限公司完成,测序平台为DNBSEQ。
1.5 基因文库构建
将基因组DNA的大片段随机打断获得200 bp~400 bp的DNA片段,然后修复双链DNA末端,并在3'末端加上A碱基,配制接头连接反应体系使接头与DNA连接,扩增连接产物并纯化回收,将PCR产物变为单链后,配制环化反应体系,得到单链环形产物,消化掉未被环化的线性DNA分子后,即得到最终的文库。
1.6 全基因组测序与基因组组装
检测合格文库安排上机测序(DNBSEQ):单链环状DNA分子通过滚环复制,形成一个包含300多个拷贝的DNA纳米球(DNB)。将得到的DNBs采用高密度DNA纳米芯片技术,加到芯片上的网状小孔内。通过联合探针锚定聚合技术(cPAS)进行测序。得到测序原始数据后,对raw reads过滤质控,去除低质量reads以及adapter和duplication污染后,从而得到高质量Clean Reads后,采用SOAPdenovo[9]组装软件进行序列组装,通过不断优化参数Kmer值为15获得最好的组装结果。
1.7 基因预测及注释
采用Glimmer 3.02[10]进行组装结果的基因预测,分别采用RNAmmer-1.2[11]和tRNAscan-SE[12]软件对基因组中包含的rRNA和tRNA进行预测。将预测基因的氨基酸序列与eggNOG(http://eggnog-mapper.embl.de/)[13]数据库和VFDB(https://card.mcmaster.ca)[14]数据库进行BLAST比对,将得到的基因进行功能注释,获得COG注释信息和菌株毒力基因,并对COG注释结果进行统计和分类,通过VFBD数据库注释到的毒力因子,分析不同致病力菌株的毒力基因差异。
2 结果
2.1 菌株的鉴定
2.1.1菌落形态特征
7株菌株在MAC琼脂平板上形成圆形、表面光滑、湿润的粉红色菌落(图1A);在EMB琼脂培养基上形成表面光滑、凸起、带黑色金属光泽的菌落(图1B);在LB固体培养基上形成圆形、表面光滑、半透明的乳白色菌落(图1C);革兰氏染色,镜检可见红色短杆菌、中等大小、两头钝圆、呈单个或多数散在排列(图1D),鉴定结果均与大肠杆菌形态特征相符。
A
2.1.2生理生化鉴定
7株菌株均能发酵葡萄糖、甘露醇、乳糖、麦芽糖,尿素、蛋白胨水、乙酰甲基甲醇(V-P)、Koser肉汤、氧化酶、硫化氢试验阴性,甲基红试验(MR)阳性,具有动力,结果显示该7株菌与大肠杆菌具有相似的生理生化特性(表2)。
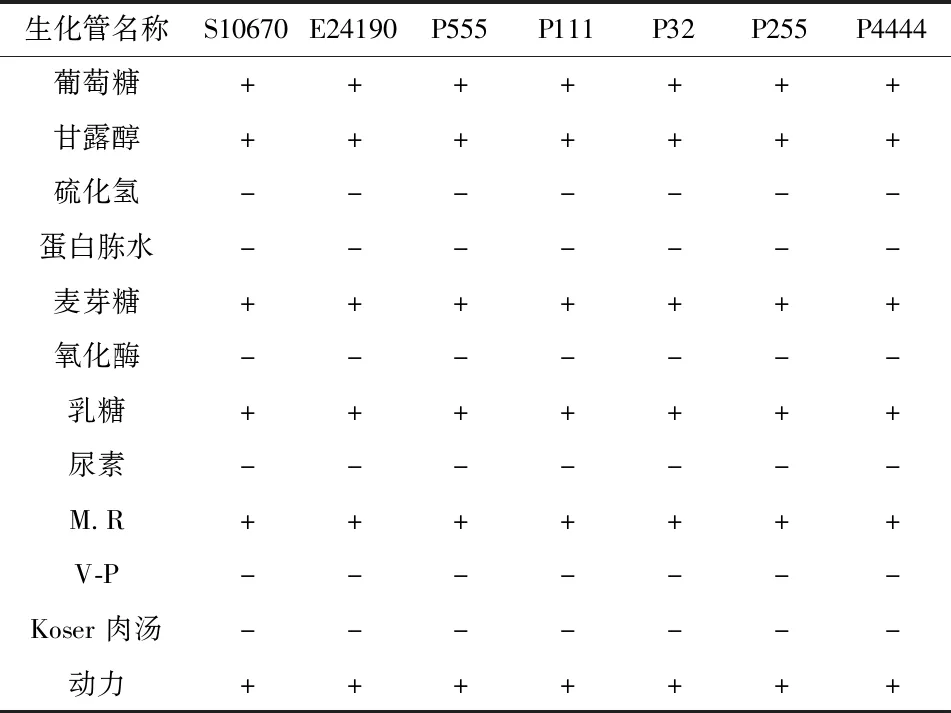
表2 7株菌株生理生化鉴定结果
2.1.3分子生物学鉴定
菌株16S rDNA基因经PCR扩增获得1 500 bp的片段,与预期相符(图2),将16S r DNA基因序列与NCBI核酸数据库比对,7株菌株与已知大肠杆菌的相似性最高,均在99.5%以上,将7株菌株鉴定为大肠杆菌。
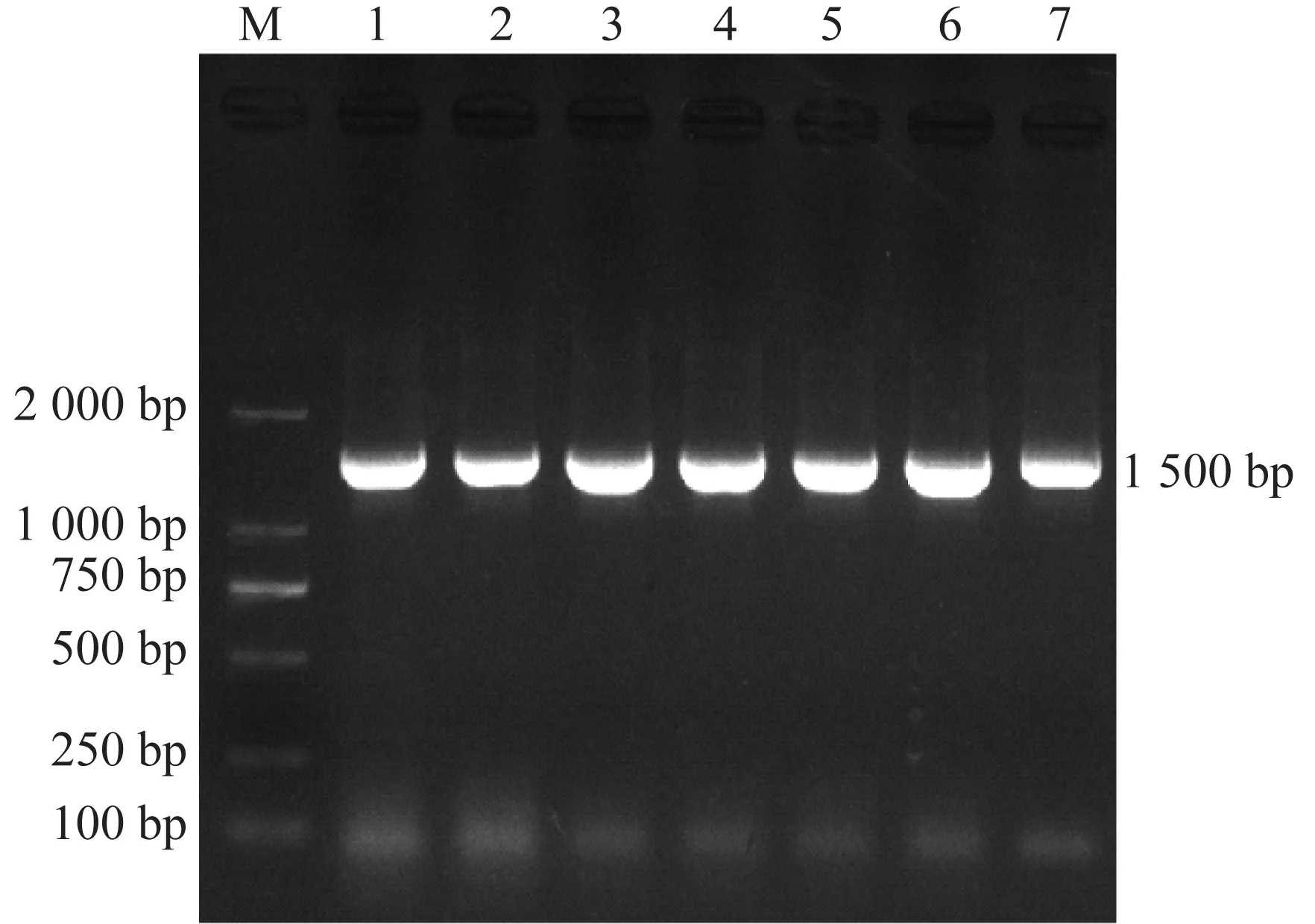
注:M:D 2 000 DNA marker ;1.S40670;2.E24190;3.P211;4.P555;5.P32;6.P444;7.P111图2 16S rDNA基因扩增结果
2.2 小鼠致病性试验
7株菌株用相同浓度(1×108CFU/mL)的菌悬液对小鼠进行感染试验,结果显示(表3),48 h后S10670和E24190实验组小鼠死亡5只,病死率为100%,P211和P555实验组小鼠死亡2只,病死率为40%,P32、P444和P111试验组小鼠死亡1只,病死率为20%,对照组小鼠全部存活。因此,将菌株S10670和E24190归为强毒株,P211和P555定为中等毒株,P32、P444和P32为弱毒株。感染后的小鼠出现背毛耸乱无光泽,进食少,活动缓慢,精神萎靡不活跃,倦怠、嗜睡,并且扎堆出现,对外界刺激迟钝,其中S10670和E24190组临床现象最严重,重度腹泻,接种菌株S10670的小鼠还有眼角包裹着眼屎,眼部出现水肿现象;P211和P555临床现象次之,P32、P444和P111临床现象最弱。
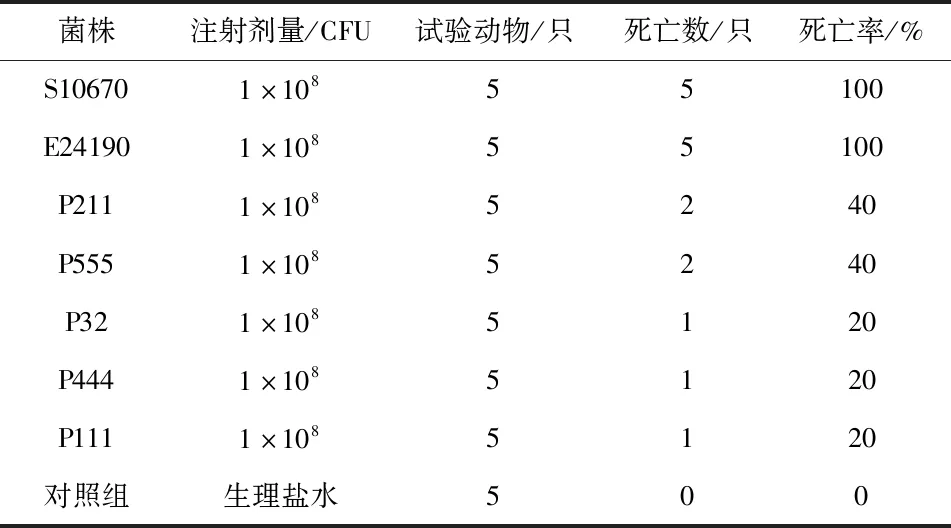
表3 小鼠致病性试验结果
2.3 剖检和组织病理学观察
对死亡小鼠进行剖解后(图3)观察小组内脏组织,与对照组相比实验组小鼠内脏组织出现不同程度的病变,表现为心脏、肝脏、脾脏、肺脏、肾脏肿大充血,颜色变深;肠道变薄,内有大量内容物,且味道恶臭。病理切片显示(图4),实验组小鼠心脏组织心肌纤维紊乱、排列不整齐,部分出现断裂崩解伴有出血;肝脏组织出现充血,细胞肿大,局部呈红色块状,组织界限模糊;脾脏组织出现充血;肺脏组织部分轮廓不清晰,出血,肺泡腔内有红细胞,肺泡壁增厚;肾脏组织出现充血,肾小球结构不明显;肠上皮细胞受损、肿大,肠黏膜坏死,肠绒毛脱落。其中组织病变和病理现象强毒株病变最严重,中等毒株次之,弱毒株最不明显。
心
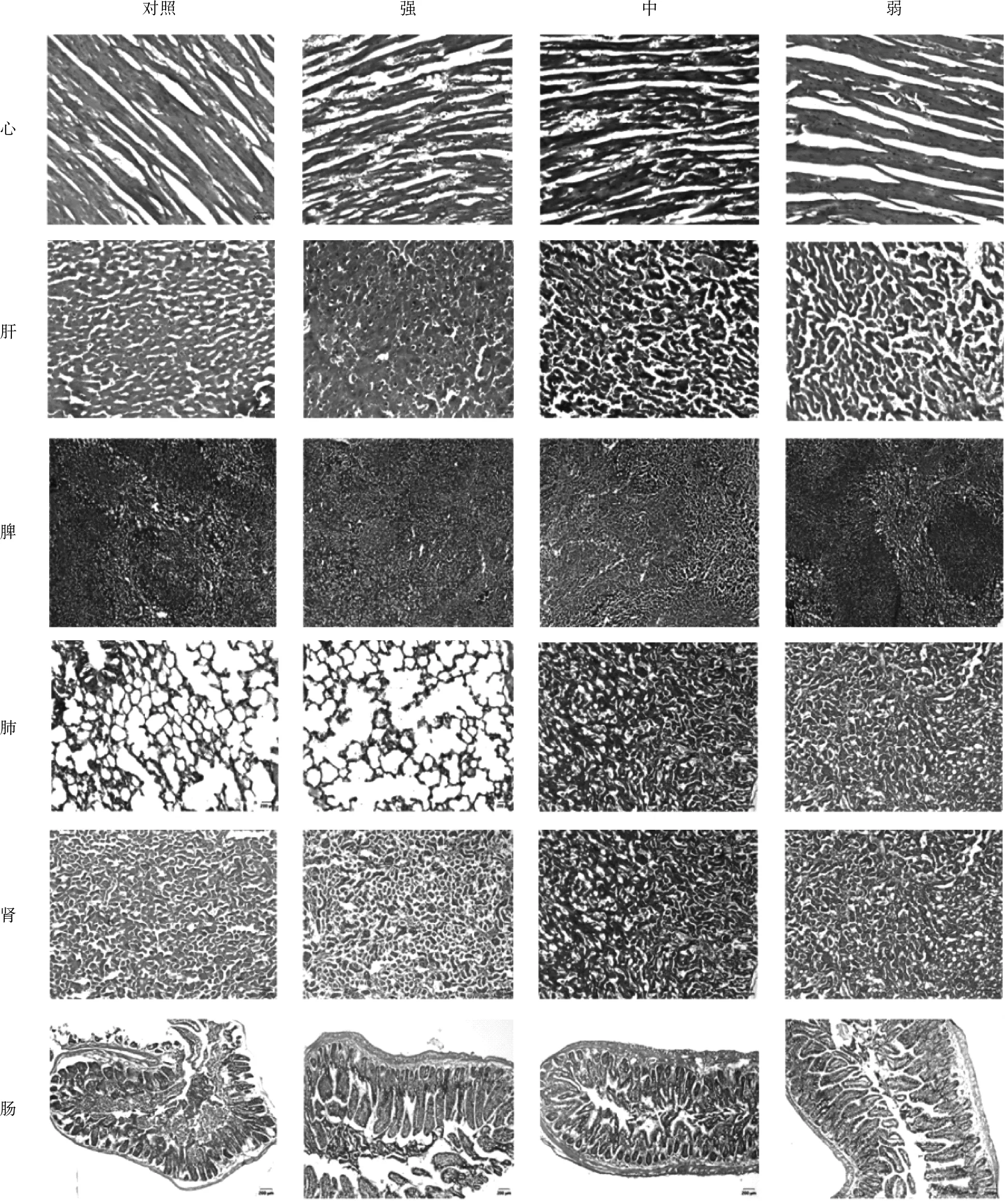
图4 组织切片图
2.4 基因组组装
对测序数据进行质量评估和组装,由结果可得菌株S10670、E24190、P211、P555、P32、P444和P111组装后得基因组大小依次为5.3 Mb、5.1 Mb、4.7 Mb、4.8 Mb、4.9 Mb、4.8 Mb和4.6 Mb,GC含量均在50%左右,基因组大小和GC含量均在大肠杆菌基因组大小和GC含量的正常范围,其它详细信息见表4,组装结果可知菌株S10670的基因组最大。
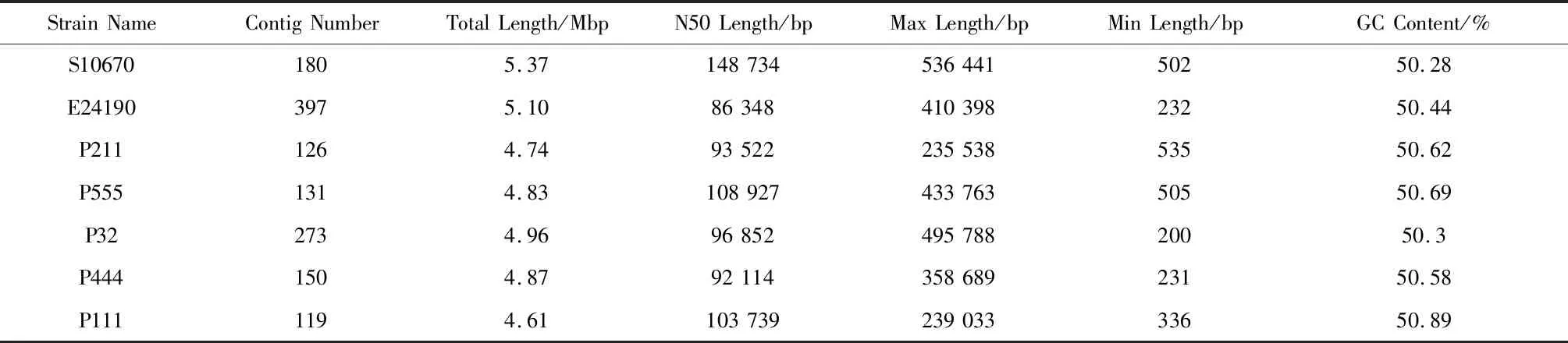
表4 基因组组装结果
2.5 基因预测
对组装好的序列进行基因组成分析,菌株S10670、E24190、P211、P555、P32、P444和P111采用Glimmer软件预测基因数量分别为5 124、4 936、4 563、4 601、4 762、4 724和4 376,用rRNAmmer1.2软件预测出的rRNA数量依次为9个、9个、5个、5个、3个、3个和7个,tRNAscan软件预测出的tRNA数量依次为85个、74个、75个、66个、77个、70个和74个,基因、rRNA、tRNA数量和GC含量均符合大肠杆菌基因组的基本特征(表5)。
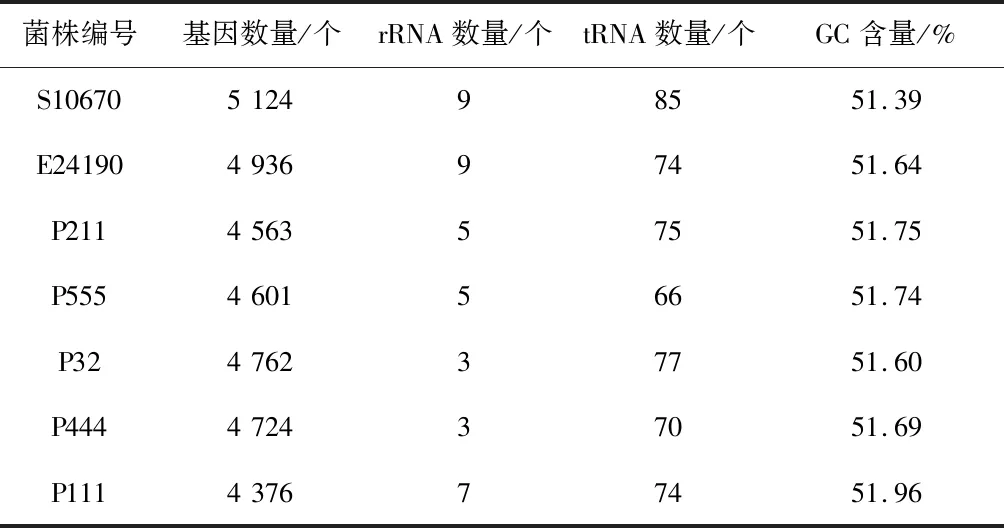
表5 基因预测结果统计
2.6 COG功能注释
本研究7株菌株基因的COG分类得到22类,菌株S10670、E24190、P211、P555、P32、P444和P111注释到的功能基因数量分别为3 482个、3 483个、3 274个、3 286个、3 342个、3 341个和3 183个。由图5可知,注释到的与代谢相关基因的数量最多。
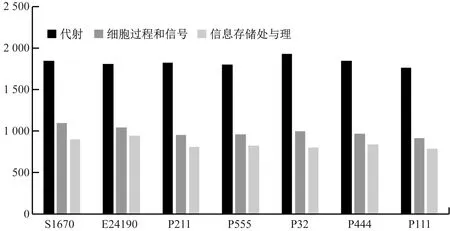
图5 COG注释分类统计
2.7 VFDB注释
通过与毒力因子数据库(VFDB)比对,菌株S10670、E24190、P211、P555、P32、P444和P111注释到的毒力基因数量分别为126、61、52、55、47、44、38个,其中分泌系统和黏附与侵袭毒力基因最多。由表6可知,强毒株S10670的基因组中含有志贺毒素基因(Stx),溶血素基因(hlyA,hlyB,hlyC,hlyD,hlyE/clyA),黏附相关的毒力基因有外膜蛋白黏附素基因(paa)、紧密黏附素基因eae、紧密黏附素易位受体蛋白基因Tir、toxB,血红素吸收相关基因(chuA,chuT,chuW,chuX,chuY),大量III型分泌系统相关基因如NLE系列基因(nleA,nleB1,nleB2-1,nleC,nleE-1,nleF,nleG-1,nleG2-3,nleG7,nleH1-1,nleH1-2)、Esp系列基因(espB,espF,espG,map,tir,espJ,espL1,espL2,espL4,espM1,espR1,espR3,espR4,espW,espX1~espX6,espY1~espY5)、Esc系列基因(escC,escD,escF,escJ,escL,escN,escO,escR,escS,escT,escU,escV)和VI型分泌系统相关基因(aec15~aec19,aec22~aec32);强毒株E24190基因组中含有肠毒素基因(LT)、溶血素基因(hlyA)和CFA/I菌毛相关基因(cfaA,cfaB,cfaC,cfaD/cfaE);中等毒株P211基因组中含有CFA/I菌毛相关基因(cfaA,cfaB,cfaC,cfaD/cfaE)、P菌毛相关基因(papA,papC,papD,papH)和铁转运系统吸收系统相关基因(sitA,sitB,sitC,sitD);中等毒株P555基因组中含有12个VI分泌系统相关基因(aec15~aec19,aec22~aec32);弱毒株P32、P444和111基因组中含有的毒力基因也存在于菌株S10670、E24190、P211和P555中,如黏附相关毒力因子大肠杆菌普通菌毛(ECP)、大肠杆菌层粘连蛋白结合蛋白菌毛(ELF)、出血性大肠杆菌菌毛(HCP)和I型菌毛(Fim),侵袭素相关毒力因子(ibeB,ibeC),铁转运系统相关毒力基因(entA,entB,entC,entE,entS,hitC)分泌系统相关毒力基因(espL1,espL4,espR1,espX1,espX4,espX5,aec15)和溶血素基因(hlyE/clyA)。
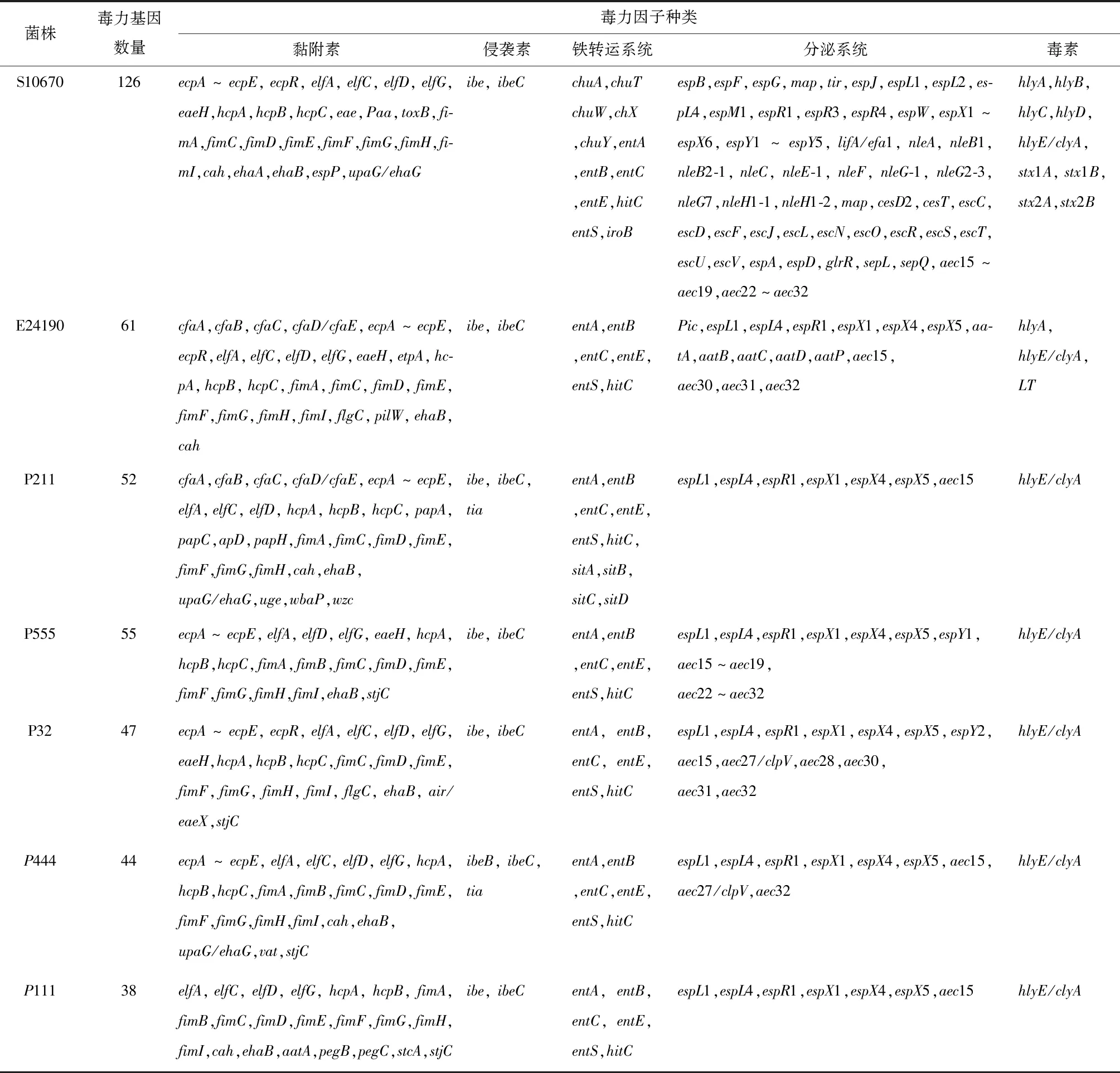
表6 毒力因子统计
3 讨论与结论
大肠杆菌的致病性是由多种毒力因子互相协作产生。志贺样毒素(Stx)是一种志贺毒素,具有细胞毒性、肠毒性、神经毒性作用,是毒性最强的细菌毒素之一,包括Stx1和Stx2两种亚型,Stx2较Stx1的毒力更强,Stx2的变异体Stx2e是导致仔猪发生水肿病的重要毒素[15]。紧密黏附素eae能使细菌紧密黏附到肠上皮细胞,eae与紧密黏附素易位受体蛋白Tir结合引起进一步的信号传导,细胞内钙离子浓度骤增,肠内液体分泌增加,引起特征性的粘附脱落病变(attaching and effacing,A/E)[16,17]。Chu系列基因编码的蛋白与血红素的吸收有关,血红素是宿主体内最丰富的铁离子资源,主要由chuA基因从细胞外或者宿主的血红素中摄取铁和血红蛋白中的铁元素[18]。溶血素(Hemolysin)基因(hlyA,hlyB,hlyC,hlyD,hlyE/clyA)孔道形成蛋白家族的成员,溶血素可溶解哺乳动物红细胞,在靶细胞膜上形成孔道继而杀死靶细胞[19]。Ⅲ型分泌系统效应因子( Non-LEE encoded effactor ,Nle ) NleH和NleD具有抗凋亡活性,NleH能够促进细胞的生存,抑制肠细胞的丢失,从而维持大肠杆菌的定值[20]。在感染期过程中,大肠杆菌表面分子能够诱导外源性的细胞凋亡,Ⅲ型分泌系统效应因子如EspF,Map能够诱导内源性的凋亡途径[21]。EspF能够诱导线粒体的溶解﹑破坏细胞紧密联接结构和促进抗凋亡蛋白的降解[22]。Map能够破坏细胞之间的紧密联结,诱导线粒体功能失活[23]。毒力因子Stx、eae、Tir、Chu、hlyB、hlyC、hlyD和III型分泌系统相关基因Nle、EspF 、Map在本研究中仅存在于强毒株S10670中,hlyA存在于强毒株S10670和E24190中。热敏肠毒素(LT)为一种免疫蛋白,与霍乱肠毒素(CT)有着密切关系,组成一个毒素家族,LT是产肠毒素大肠杆菌的主要致病因子之一,可引起水样腹泻[24]。LT在本研究中仅存在于强毒株E24190中。
VI型分泌系统(T6SS)是一种新型的分泌系统,普遍存在于革兰氏阴性菌中,最早是在霍乱弧菌中发现的,T6SS参与细菌生物膜的形成,并介导细菌与宿主之间的粘附和毒性作用[25],本研究检测到的VI分泌系统是ACE T6SS相关毒力因子。ACE T6SS仅存在于强毒株S10670和中等毒株P555中。CFA/I是一种优势血清型定居因子,整个CFA/I定居因子由4个基因 (cfaA,cfaB,cfaC,cfaD/E) 编码[26,27],编码的相应多肽称为cfaA,cfaB,cfaC,cfaD/E,成熟定居因子由cfaB和cfaE组成,cfaB是主要结构亚单位,cfaE位于定居因子顶端,二者均能介导CFA/I对人小肠上皮细胞相应受体的结合,致病性大肠杆菌通过其菌体表面的宿主特异性定居因子CFA/I介导粘附于小肠黏膜上皮细胞[28],大量增殖,释放肠毒素,引起仔猪腹泻,CFA/I在本研究中存在于强毒株E24190和中等毒株P211中。
P型菌毛多分布于尿道致病性大肠杆菌(UPEC)的黏附素,能介导大肠杆菌粘附于上尿道,P型菌毛是UPEC导致肾盂肾炎的主要毒力因子,已知的编码P菌毛操纵子的基因有papA、papB、papC、papD、papE、papF、papG、papH和papI,其中 PapA 蛋白是 P 菌毛的主要成分[29]。铁/锰转运蛋白(Iron/manganese transport)是铁摄取转运系统毒力因子,由sitA、sitB、sitC和sitD四个基因编码组成,该系统中的sitB是ATP结合蛋白,所以该系统相当于是ATP离子泵,可以提供细菌转运过程所需的能量,外膜转运系统还可以将二价铁载入细胞内,参与营养物质的摄取、细菌毒素的分泌以及将抗生素泵出细胞使细菌具有抗药性[30]。P菌毛和铁/锰转运蛋白本研究中仅存在于中等毒株P211中。
综上所述,本研究通过细菌感染小鼠鉴别7株菌株的致病力,采用二代测序技术测定7株致病性大肠杆菌的基因组序列,经组装,得到致病力相关的毒力基因,研究结果为大肠杆菌分子致病机制奠定理论基础。

