唾液乳杆菌电转化效率优化研究
张晓宇,王 慧,杨昳津,熊智强,夏永军,王光强,艾连中,宋 馨
上海理工大学 医疗器械与食品学院,上海 200093
唾液乳杆菌(L.salivarius)是美国FDA认证的GRAS(generally recognized as safe)微生物,存在于人的口腔、肠道、阴道、粪便,以及部分动物(如鸡、猪等)的肠道内[1-3]。作为益生菌,唾液乳杆菌耐酸、耐胆盐、高产胞外多糖,对肠道上皮细胞有较强粘附作用,能促进机体免疫系统的形成,增强肠道屏障功能[4-8]。唾液乳杆菌还对宿主健康具有重要意义。通过产生类细菌素,可抑制金黄色葡萄球菌诱导的咽炎损伤,避免食源性致病菌单增李斯特菌的感染等;通过拮抗作用可抑制致病菌在肠道内定殖,降低幽门螺杆菌活性,减少胃炎发生[9-12]。
目前的研究大多针对唾液乳杆菌的分离鉴定及益生特性,通过分子生物学解析其代谢物和代谢途径的研究相对较少,这在一定程度上限制了唾液乳杆菌的开发利用,其主要原因是缺乏遗传操作工具。唾液乳杆菌为革兰氏阳性菌,细胞壁厚,这导致外源DNA转入唾液乳杆菌的效率较低[13]。为便于从基因水平对唾液乳杆菌进行研究,需要对其电转化方法进行优化。
本研究使用单因素法,分别从细菌的培养状态,甘氨酸浓度、蔗糖浓度,电压及复苏时间等方面对唾液乳杆菌的电转化方法进行优化,从而提高唾液乳杆菌的电转化效率,为唾液乳杆菌基因工程奠定基础。
1 材料与方法
1.1 材料
1.1.1菌株和质粒
唾液乳杆菌(LactobacillussalivariusAR612)由本实验室分离并保藏。
pNZ44质粒(乳杆菌穿梭质粒)由本实验室保藏。
1.1.2培养基和缓冲液
MRS培养基(g/L):酪蛋白胨 10、牛肉浸出粉 10、酵母浸粉5、葡萄糖 20、磷酸氢二钾 2、柠檬酸氢二铵 2、三水乙酸钠 8.3、七水硫酸镁 0.58、一水硫酸锰 0.25、吐温-80 1,固体培养基另加琼脂粉20。
SGMRS培养基:含10 g/L甘氨酸和0.3 mol/L蔗糖的MRS培养基。
复苏培养基:含MgCl220 mmol/L和CaCl22 mmol/L的MRS培养基。
缓冲液Ⅰ:蔗糖0.3 mol/L、MgCl21 mmol/L、KH2PO45 mmol/L。
缓冲液Ⅱ:蔗糖0.3 mol/L、MgCl21 mmol/L、KH2PO45 mmol/L、150 mL/L甘油。以上缓冲液均用去离子水配置。
1.1.3仪器与试剂
质粒提取试剂盒(Axygen公司);电转杯(Bio-Rad公司);超微量分光光度计(NanoDrop 2000c,Thermo Scientific公司);电转仪(MicroPulser,Bio-Rad公司);生化培养箱(美蓝飘尔(上海)过滤设备有限公司);紫外可见分光光度计(UV-2600,尤尼柯(上海)仪器有限公司);分析天平(ML104/02,梅特勒-托利多仪器(上海)有限公司);电子天平(G2202L-1SCN,赛多利科学仪器(北京)有限公司);冷冻离心机(3-18K,Sigma公司);离心机(1-14,Sigma公司);全自动生长曲线分析仪(Bioscreen C,Bioscreen公司)。
1.2 方法
1.2.1质粒提取
pNZ44质粒提取按照试剂盒说明书进行。使用超微量分光光度计测定质粒浓度。
1.2.2菌种活化及生长曲线绘制
唾液乳杆菌在MRS固体培养基上划线培养,挑取单菌落接入MRS液体培养基,37 ℃过夜培养。活化后的菌液按1%接种于MRS培养基,37 ℃培养16 h,使用生长曲线分析仪测定并绘制生长曲线。
1.2.3唾液乳杆菌感受态制备
唾液乳杆菌挑取单菌落接入MRS液体培养基,37 ℃过夜培养。按1%接种量接入50 mL SGMRS培养基,37 ℃培养一定时间后将菌液移入预冷的50 mL离心管,4 ℃ 6 000 g,离心10 min,收集菌体,弃上清。缓冲液Ⅰ洗涤菌体,4 ℃,6 000 g,离心10 min,弃上清。该步骤重复2次。用1 mL缓冲液Ⅱ重悬菌体,按每管100 μL分装至1.5 mL EP管,-80 ℃冻存。
接种于SGMRS培养基的菌液分别培养至OD600为 0.1、0.2、0.3、0.4和0.5时,按上述方法制备唾液乳杆菌感受态细胞。SGMRS培养基中,甘氨酸浓度分别为0 g/L、5 g/L、10 g/L、20 g/L和30 g/L时,以及蔗糖浓度分别为0 mol/L、0.1 mol/L、0.3 mol/L和0.5 mol/L时,分别按上述方法制备感受态细胞。
1.2.4唾液乳杆菌电转化
唾液乳杆菌的电转化参考文献方法并作适当修改[14]。具体如下:从-80 ℃箱中取出唾液乳杆菌感受态细胞,置于冰上解冻,100 ng pNZ44质粒与100 μL 感受态细胞混合,转移至预冷的0.2 cm电转杯中,轻敲电转杯,确保混合物进入电转杯底部。设定电压为7.5 kV/cm,电击后迅速加入900 μL复苏培养基,于37 ℃复苏,取适量复苏后菌液涂布于抗性平板上。37 ℃静置培养2 d后菌落计数。
不同生长状态时制备的感受态细胞,按上述方法与质粒pNZ44混合,进行电转化。在电转化效率最高的生长状态下,分别对采取不同甘氨酸及蔗糖浓度的SGMRS所培养的感受态细胞进行电转化。
选择电转效率最高的细胞状态、以及相应的SGMRS培养基中甘氨酸和蔗糖浓度来制备感受态细胞。按照上述方法,分别在电压7.5 kV/cm、10 kV/cm和12.5 kV/cm时将pNZ44质粒转入感受态细胞。之后选择转化效率最高的电压进行电转化,分别复苏1 h、2 h、3 h和4 h后涂布于抗性平板,计算电转效率。
以上试验均重复3次。按照下面的公式计算电转化效率。
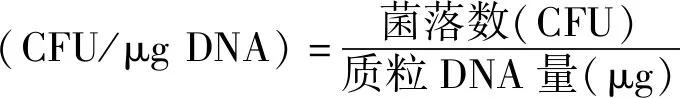
2 结果与分析
2.1 细胞培养状态对电转效率的影响
唾液乳杆菌(LactobacillussalivariusAR612)的生长曲线见图1。培养状态对电转化效率的影响见图2。唾液乳杆菌生长至OD600为0.1时,电转效率最高,为6.29×107CFU/μg DNA。随着OD600值升高,电转效率逐渐降低。OD6000.3时,电转化效率为2.33×105CFU/μg DNA,与OD6000.1相比,降低了2个数量级。
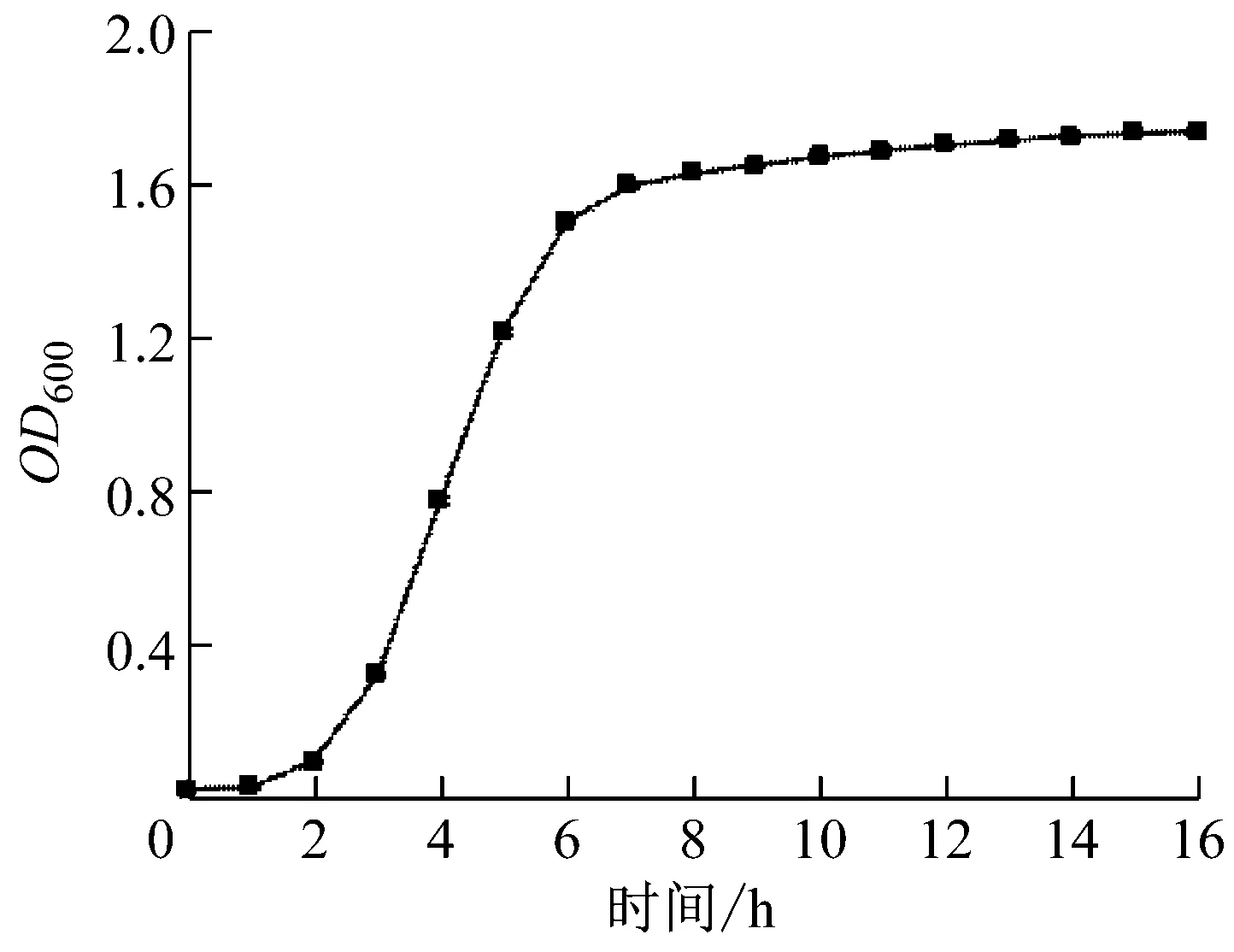
图1 唾液乳杆菌(Lactobacillus salivarius AR612)的生长曲线
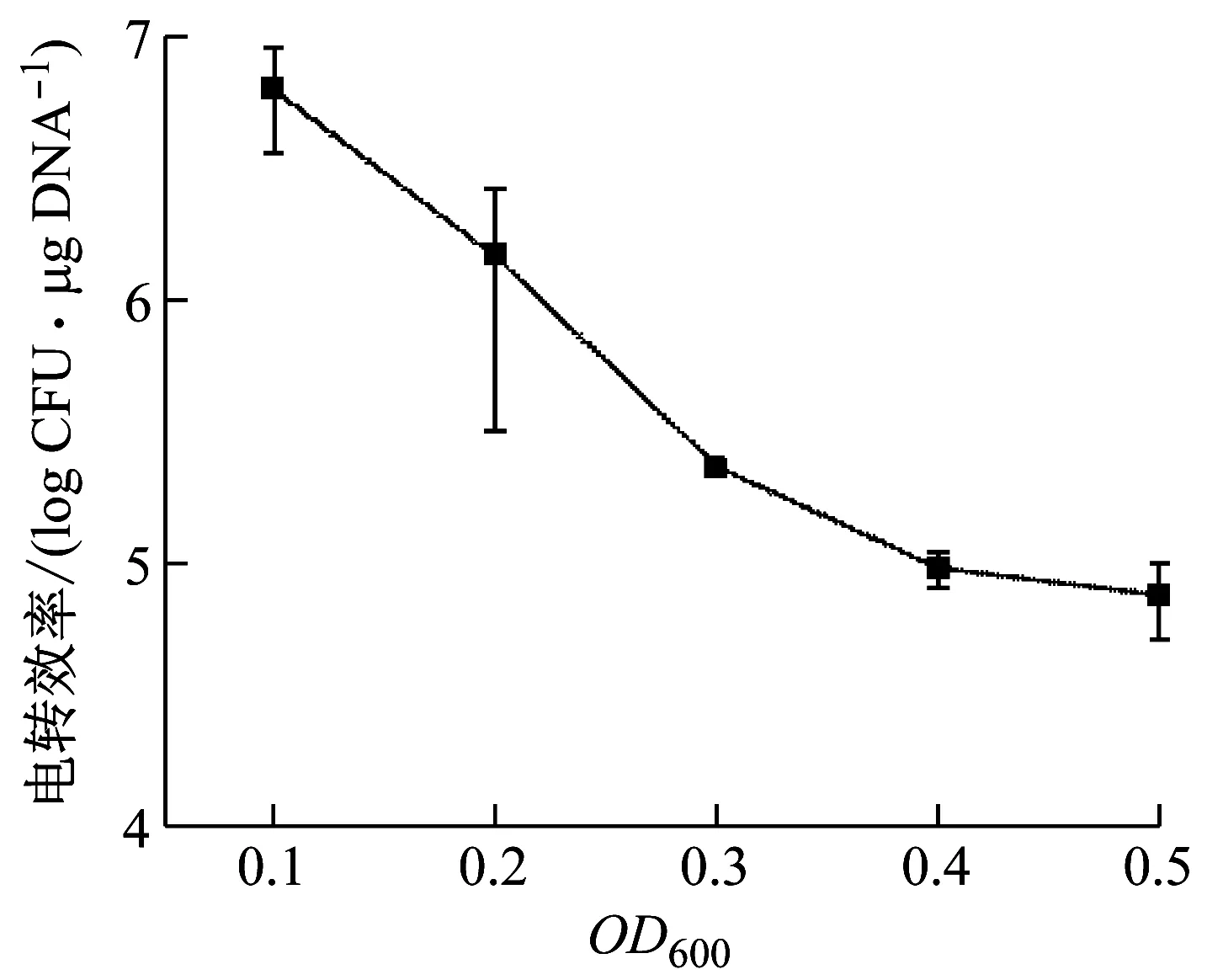
图2 唾液乳杆菌培养状态对电转效率的影响
现有文献报道的唾液乳杆菌感受态制备OD600通常为0.3~0.6[15-17]。洛雪等[18]制备嗜热链球菌感受态细胞时,细菌生长至稳定期,即OD6000.8时电转效率最高。在乳酸菌感受态制备的方法中,很少有使用生长至OD6000.1的细胞制备感受态。乳酸菌胞外多糖一般大量产生于稳定期[19]。LIU C T等[4]研究表明,唾液乳杆菌的胞外多糖产量在13株乳杆菌中最高,胞外多糖可能限制了外源分子进入细胞。本文研究的唾液乳杆菌生长至OD6000.1时,为对数生长初期,细胞壁结构疏松,胞外多糖产量较低,更利于外源分子转入;细胞活力较高,经过电击后也更容易存活[20]。
2.2 甘氨酸浓度对电转效率的影响
革兰氏阳性菌细胞壁的主要成分是肽聚糖。甘氨酸是细菌感受态制备最常用的细胞弱化剂,能取代细胞壁肽链上的L-丙氨酸和D-丙氨酸,影响N-乙酰葡萄糖胺和N-乙酰胞壁酸组成的双糖单位、短肽链和肽桥组成的肽聚糖的结构,使细胞合成过程中形成较为松散的肽聚糖层,起到弱化细胞壁的作用,利于外源DNA的转入[21,22]。但过高的甘氨酸浓度会抑制细菌生长[23]。
甘氨酸浓度对唾液乳杆菌电转化效率的影响见图3。当甘氨酸浓度从0增加到5 g/L,电转效率略有降低,这可能是因为甘氨酸浓度增高对菌株生长造成抑制。当甘氨酸浓度增加到10 g/L,电转效率最高,达到6.74×107CFU/μg DNA,此时甘氨酸对电转效率的增强作用超过了对细菌生长的抑制作用。随着甘氨酸浓度继续增加,电转化效率降低。
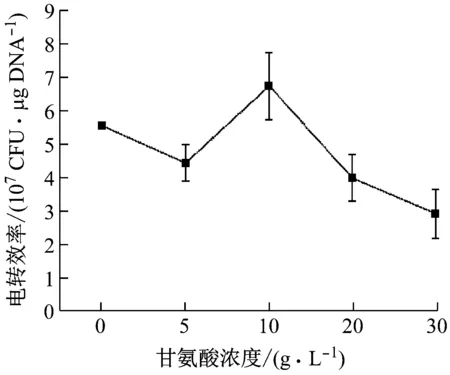
图3 甘氨酸浓度对电转效率的影响
2.3 蔗糖浓度对电转效率的影响
蔗糖是渗透稳定剂,电转培养基中加入蔗糖可显著提高转化效率[24]。研究表明,这可能是因为蔗糖存在缓解了甘氨酸引起的细胞裂解[25]。蔗糖浓度对电转化效率的影响见图4。随着蔗糖浓度增加,电转化效率呈现先增加后降低的趋势。当蔗糖浓度为0.3 mol/L时,电转效率最高,为1.59×108CFU/μg DNA。
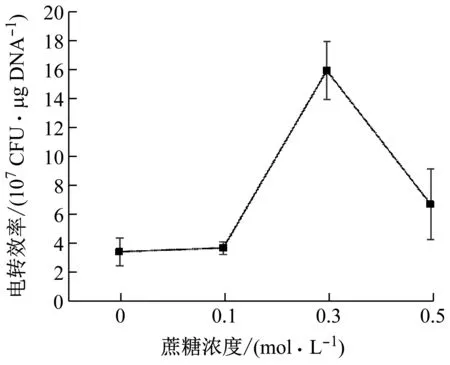
图4 蔗糖对电转效率的影响
2.4 电压对电转效率的影响
电转化是在电压的作用下,使细胞膜上的电荷分离,产生高强度的跨膜电位差,电位差超过临界水平时,细胞膜表面形成暂时的孔道,外源分子得以进入细胞内部[20]。电压过低,细胞膜上难以形成足够大小的孔洞,外源分子难以转入;提高电压,细胞膜上产生的孔洞增多,细胞膜通透性增强,外源分子更易进入细胞;但电压过大超过细胞承受能力时,会导致细胞死亡[26]。
电压对电转化效率的影响见图5。当电压在7.5至10 kV/cm范围时,可获得较高的电转化效率(2.11~2.12×107CFU/μg DNA)。由于考虑到电压提高会对细胞造成损伤,因此选择电压为7.5kV/cm-1进行下一步实验。
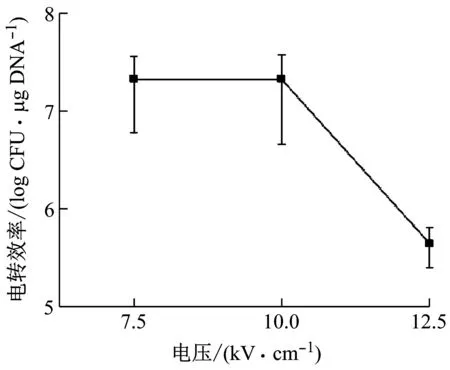
图5 电压对电转效率的影响
2.5 复苏时间对电转效率的影响
感受态细胞电击后,在不含抗生素的复苏培养基中培养一段时间,有利于细胞恢复活性[27]。若复苏时间较短,细胞膜上由于电击产生的孔洞来不及闭合,影响细胞正常生长;复苏时间过长,缺少抗性选择压力,容易造成质粒丢失[28]。复苏时间对电转化效率的影响见图6。随着复苏时间增加,电转化效率逐渐增大,3 h后电转效率的增长幅度趋于平缓。为节省实验时间,选择复苏时间为3 h。
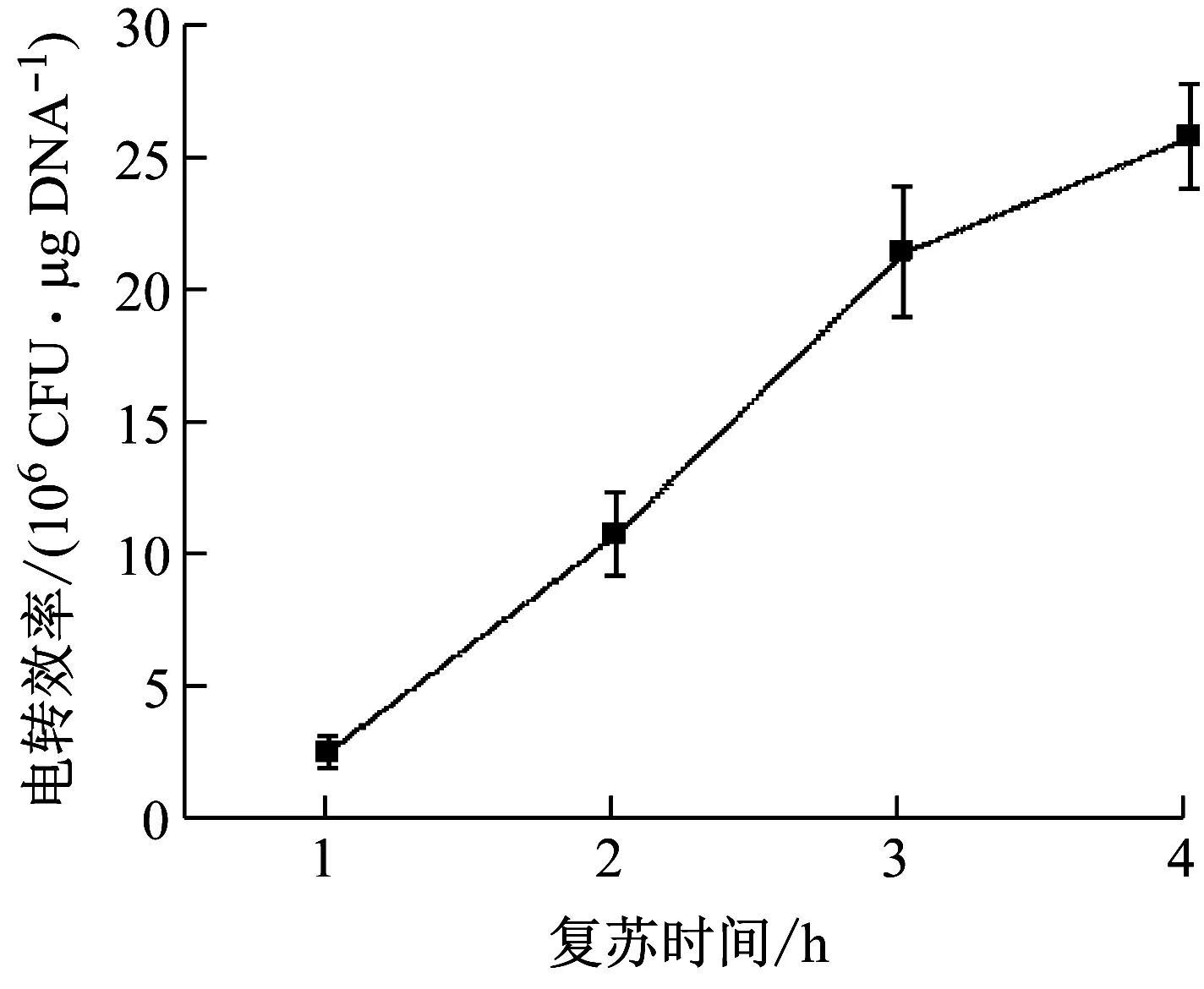
图6 复苏时间对电转效率的影响
3 总结与讨论
唾液乳杆菌作为可食用益生菌,对人体健康具有重要意义。由于其细胞壁的结构特点,尚无高效的外源基因导入方法,制约了该菌株在功能基因、益生机制等方面的基础研究。采用电转化方法,可以较高转化效率使外源DNA稳定的转入唾液乳杆菌细胞中,这是对其进行遗传操作的基础。
影响乳酸菌电转化效率的因素比较复杂,如菌体的培养状态、培养基成分、缓冲液成分、电压、复苏时间、质粒浓度等。本文优化了一株唾液乳杆菌L.salivariusAR612的电转化参数,确保外源质粒能高效转入细胞,满足了后续遗传操作的需要。试验确定唾液乳杆菌的最佳电转化参数为:OD6000.1,甘氨酸浓度10 g/L,蔗糖浓度0.3 mol/L,电压7.5kV/cm,复苏时间3 h。在该条件下,唾液乳杆菌AR612的电转化效率最高可达1.16×108CFU/μg DNA。与优化前相比,转化效率提高了3个数量级。其中细菌生长状态和电压对电转化效率的影响远大于甘氨酸浓度、蔗糖浓度和复苏时间。据文献中已报道的唾液乳杆菌电转化效率,最高为103~105CFU/μg DNA[29],本文优化后的方法在效率上更具优势。
质粒浓度也会影响乳酸菌电转化效率。在一定浓度范围内,电转化效率随质粒浓度提高而提高,超过一定范围后,转化效率出现不同程度的降低[23,30-32]。但本研究所用唾液乳杆菌AR612,质粒浓度从10 ng增加至1 μg,转化效率未见差异。前人研究结果也显示,质粒浓度在一定范围内,质粒浓度对电转化效率影响不大[33,34],这与本文的发现一致。
乳酸菌具有较强的菌株特异性,不同乳酸菌的最佳电转化方法存在差异。将本文优化所得参数用于实验室保藏的另一株唾液乳杆菌AR809,电转化效率可提高至102~103CFU/μg DNA,但与本研究所用的唾液乳杆菌AR612相比,转化效率存在明显差异。唾液乳杆菌AR809的胞外多糖产量高于AR612,这可能是限制AR809转化效率的主要原因之一。通过比较基因组杂交方法证明唾液乳杆菌具有较高的基因多样性。与对照基因组相比,高达23.6%的基因是可变的[35]。此外,研究还显示某些乳酸菌中存在限制性修饰机制,该机制相当于原核生物的免疫系统,可抵御外源DNA进入细菌内部,从而降低了电转化效率[36]。另有研究者发现,当质粒直接转入植物乳杆菌时,无法稳定获得转化子,但通过植物乳杆菌的无细胞提取物对质粒DNA进行体外修饰后,可成功绕过限制性修饰机制,将转化效率提高至5.8×105CFU/μg DNA[37]。综上所述,乳酸菌的电转化仍需具体问题具体分析,针对特定菌株找出最有效的转化方法。

