牛樟芝固态发酵成分缓解L-O2细胞酒精损伤的研究
夏永军,衣振伟,梁丽红,赵创谦,汤柳茜,章 羽,杨怡琳,王光强,艾连中
上海理工大学医疗器械与食品学院,上海食品微生物工程技术研究中心,上海 200093
牛樟芝(Antrodiacamphorata)作为台湾民间传统的食药用真菌[1],具有抗肿瘤[2]、抗癌[3]、抗炎[4]等多种活性,但由于子实体自然产量稀少,难以满足市场需求,因此人工培养成为近年来的研究热点。固态发酵、液态发酵和段木培养是目前主要的人工培养方式[5]。其中固态和液态发酵获得的是牛樟芝菌丝体,段木培养获得的是最接近野生牛樟芝活性成分的子实体。但是段木培养成本高、周期长、易染杂菌[6],不适合实验研究及大规模生产。因此,固态发酵和液态发酵成为目前实验室牛樟芝培养的主要方式。研究表明,从牛樟芝菌丝体内分离出的马来酸琥珀酸衍生物能显著抑制丙型肝炎病毒(HCV)的活性,其中Antrodin A抑制作用最为明显[7]。KUMAR[8]等人研究发现,牛樟芝菌丝体提取物Antroquinonol提高了肝脏抗氧化能力,可以保护肝细胞免受酒精诱导的氧化应激伤害。HSIAO[9]等人发现牛樟芝发酵液干物质和牛樟芝子实体水提物对CCl4诱导的肝脏疾病具有保肝作用。此外,牛樟芝菌丝体还可以显著抑制急性乙醇中毒大鼠血清中谷丙转氨酶、谷草转氨酶、碱性磷酸酶和胆红素的升高,对肝脏起到保护作用,但作用机制尚不明确[10]。
乙醇体内代谢过程中发生氧化应激反应会诱导线粒体功能障碍,肝脏脂肪变性,炎症和纤维化[11-14]。乙醇在体内代谢产生的活性氧也已被证明是酒精性肝病产生与发展过程中的关键成分[15],大量活性氧可以诱导自由基链反应,进而诱发II型糖尿病、心脑血管疾病、癌症等一系列重大疾病[16-18]。前期研究显示,采用不同培养方式所得牛樟芝发酵产品中活性成分差异较大[19]。其中,以青稞为基质的固态发酵,菌丝体内活性成分种类多、含量高。主要以Antrodins和Antroquinonols类化合物为主;而常规液态发酵菌丝体内活性成分主要为Antrodins类化合物,几乎不含Antroquinonols 类成分[20]。目前这些化合物的功能研究主要集中在抗炎、抗癌等方面[21,22],但针对酒精性肝损伤的保护机制研究则较少。本文利用人正常肝细胞L-O2酒精干预模型,考察牛樟芝青稞固态发酵产物中的活性成分对肝细胞损伤的保护作用,为进一步开发牛樟芝活性成分奠定基础。
1 材料与方法
1.1 材料
1.1.1菌株
牛樟芝A.camphorataS-29来源于上海食品生物技术研究所,菌种保存于中国普通微生物菌种保藏中心,保藏编号为CGMCC No.9590。人正常肝细胞L-O2,购于上海细胞生物学研究所。
1.1.2培养基
液体种子培养基(g/L):葡萄糖 20 g,大豆蛋白胨5 g,MgSO40.5 g,KH2PO40.5 g,柠檬酸0.5 g,调节pH至5.0;
固体发酵培养基(1 L锥形瓶):青稞100 g、MgSO40.5 g、KH2PO40.5 g和大豆蛋白胨0.4 g,初始含水量70%(m/v),初始pH 5.0,固态发酵接种量为30% (v/m),28 ℃培养25 d;
1.1.3仪器与试剂
酶标仪(SpectraMax i3x,MD,奥地利);倒置显微镜(DMi8,Leica,德国);细胞培养箱(INC108,Memmert,德国);中高压制备色谱(Reveleris PREP,BUCHI,瑞士)、硅胶柱(FP Si 40 g,BUCHI,瑞士);离心机(3-18K,Sigma德国);色谱柱HP-C18柱(Sepax,苏州);噻唑蓝(MTT)购于上海源叶生物科技有限公司;1640细胞培养基、胎牛血清、胰蛋白酶、DMEM培养基和青霉素-链霉素溶液购于上海维森特生物技术有限公司;ALT、AST、MDA、SOD、GSH、总蛋白等测试盒购于南京建成生物工程研究所。
1.2 方法
1.2.1牛樟芝固态发酵原料成分制备
牛樟芝固态发酵结束后,将瓶内固态发酵产物打碎取出,60 ℃粉碎过筛(100目)。将过筛后粉末以10∶1(g/L)的比例加入无水乙醇,55 ℃热水浸提60 min,每隔20 min搅拌一次,使提取更加充分。提取结束后抽滤得到乙醇提取液,旋蒸浓缩后得到牛樟芝乙醇提取物。
利用Reveleris PREP纯化系统对提取物进行硅胶柱层析分离,流动相为A:正己烷,B:乙酸乙酯,C:甲醇,梯度洗脱程序如表1所示。色谱柱为FP Si 40 g,流速35 mL/min,检测波长为254 nm,收集的组分利用HPLC进行成分检测。

表1 流动相梯度洗脱比例
1.2.2L-O2细胞的培养
从液氮罐中取出L-O2细胞冻存管,放在37 ℃浴锅中加热,轻微晃动使其快速解冻。按照90%RPMI-1640培养基+10%胎牛血清+1%双抗的比例配制完全培养基,将L-O2接入完全培养基中置于37 ℃、5%的CO2培养箱中培养,注意观察细胞状态,细胞贴壁生长后更换新鲜培养基。
1.2.3MTT法[23]确定酒精损伤L-O2细胞浓度与时间
L-O2细胞贴壁生长至皿底80%以上时进行细胞铺板,收集对数生长期细胞,调整细胞浓度至1×105个/mL加入96孔板中培养。设置模型组及对照组。每组6个复孔,每孔加入200 μL细胞悬液。对照组采用正常培养液,模型组分别加入含有不同浓度酒精的细胞培养液,酒精浓度分别为0.2%、0.4%、0.6%、1.2%、2.4%、3.6%、5%和10%,置于细胞培养箱内分别培养24 h、48 h,每孔加入已配制好的MTT溶液20 μL,细胞培养箱内孵育4 h。吸去旧液,每孔加入150 μL DMSO,置于振荡器上振荡10 min,用酶标仪检测490 nm波长下的吸光度(OD490)。
细胞存活率(%)=不同酒精处理组OD值/对照组OD值×100%。
1.2.4牛樟芝活性成分作用浓度的确定
L-O2细胞贴壁生长至皿底80%以上时,收集对数生长期细胞,调整细胞浓度至1×105个/mL加入96孔板中。设置药物组和对照组,每组6个复孔,每孔加入200 μL细胞悬液。铺板结束后将96孔板放于细胞培养箱内继续培养24 h,使细胞贴壁生长。吸去旧培养液,更换新培养液,其中对照组采用正常培养液,药物组分别加入含有不同浓度化合物的细胞培养液,浓度分别为2.5 μg/mL、5 μg/mL、10 μg/mL、15 μg/mL、25 μg/mL、50 μg/mL 和100 μg/mL,置于细胞培养箱内分别培养24 h、48 h。化合物作用结束后,每孔加入已配制好的MTT溶液20 μL,细胞培养箱内孵育4 h。吸去旧液,每孔加入150 μL DMSO,置于振荡器上振荡10 min,用酶标仪测OD490值,计算细胞存活率。
1.2.5L-O2细胞形态学观察
收集对数期生长期细胞,调整细胞浓度至1×105个/mL加入24孔板中培养。组别设为空白组、模型组及牛樟芝活性成分与酒精共培养组,每组4个复孔,每孔加入1 mL细胞悬液,培养时间为48 h,培养期间用倒置显微镜观察各组细胞,包括细胞大小、形态及贴壁生长,有无染菌等情况,拍照记录细胞状态变化。
1.2.6细胞外ALT和AST的活性测定
收集对数期生长期细胞,调整细胞浓度至1×105个/mL加入24孔板中培养。组别设为空白组、模型组及牛樟芝活性成分与酒精共培养组,每组4个复孔,每孔加入1 mL细胞悬液,培养时间为48 h,收集细胞上清液,依据南京建成生物工程研究所的试剂盒说明书测定ALT和AST的活性。
1.2.7细胞内MDA、SOD和GSH的活性测定
收集对数期生长期细胞,调整细胞浓度至1×105个/mL加入24孔板中培养。组别设为空白组、模型组及牛樟芝活性成分与酒精共培养组,每组4个复孔,每孔加入1 mL细胞悬液,培养时间为48 h,收集细胞,依据南京建成生物工程研究所的试剂盒说明书测定MDA、SOD和GSH的活性。
1.2.8牛樟芝活性成分HPLC分析
色谱柱为Sepax HP-C18柱,4.6 mm×250 mm(5 μm),梯度洗脱程序如表2所示,流速1 mL/min,进样方式为自动,进样量20 μL,紫外检测波长254 nm。
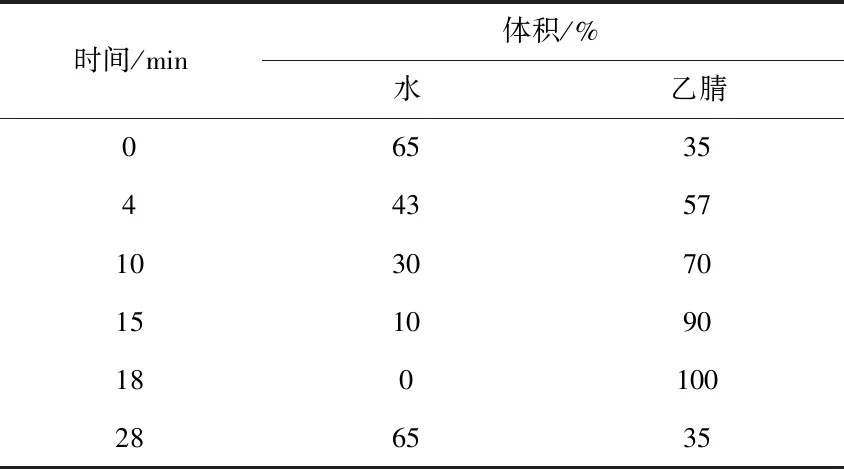
表2 HPLC分析洗脱条件
1.2.9数据统计分析
实验数据表示为均值±标准偏差,每组6个样品。使用SPSS 17.0软件进行统计分析。采用单因素方差分析(ANOVA)及Tukey检验分析组间差异(p<0.05时具有显著差异,p<0.01时具有极显著差异)。
2 结果与讨论
2.1 牛樟芝固态发酵成分HPLC分析
使用高效液相色谱鉴定分析硅胶柱层析收集的10组样品。如图1所示,牛樟芝固态发酵和液态发酵产物中活性成分种类数量存在较大差异,固态发酵产物中含有更为丰富的活性成分。将各组样品保留时间与前期从牛樟芝菌丝体中分离鉴定的马来酸琥珀酸衍生物和泛醌类化合物的保留时间进行比对,最终确定Antroquinonol B(AqB)、Antrodin C(AdC)、Antrodin A(AdA)和Antroquinonol(Aq)这4种活性物质(图2)。
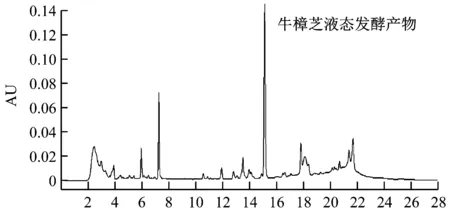
图1 牛樟芝发酵产物HPLC图谱
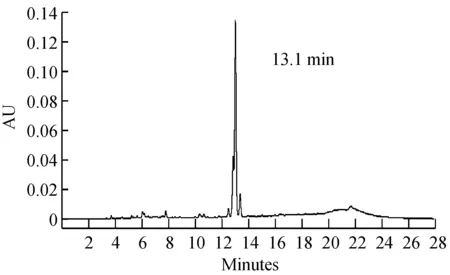
图2 纯化制备的4种牛樟芝活性成分HPLC分析
2.2 人正常肝细胞L-O2酒精损伤模型的建立
如表3所示,当各组培养时间相同时,随着细胞培养液中酒精浓度的升高,L-O2细胞活力逐渐降低,表明L-O2细胞存活率与酒精浓度呈负相关;当酒精浓度相同时,培养48 h的L-O2细胞的存活率要低于培养24 h的细胞,表明酒精长时间处理对细胞活性有抑制作用,而细胞存活率也随培养时间的增加而降低。根据细胞存活率半数或者接近半数为条件造模[23],从表3可知,当酒精浓度为5%、处理48 h时,L-O2细胞活性为55.47%,接近半数。结合培养期间L-O2细胞在倒置显微镜下的形态学观察,确定造模条件为乙醇浓度5%,处理48 h。
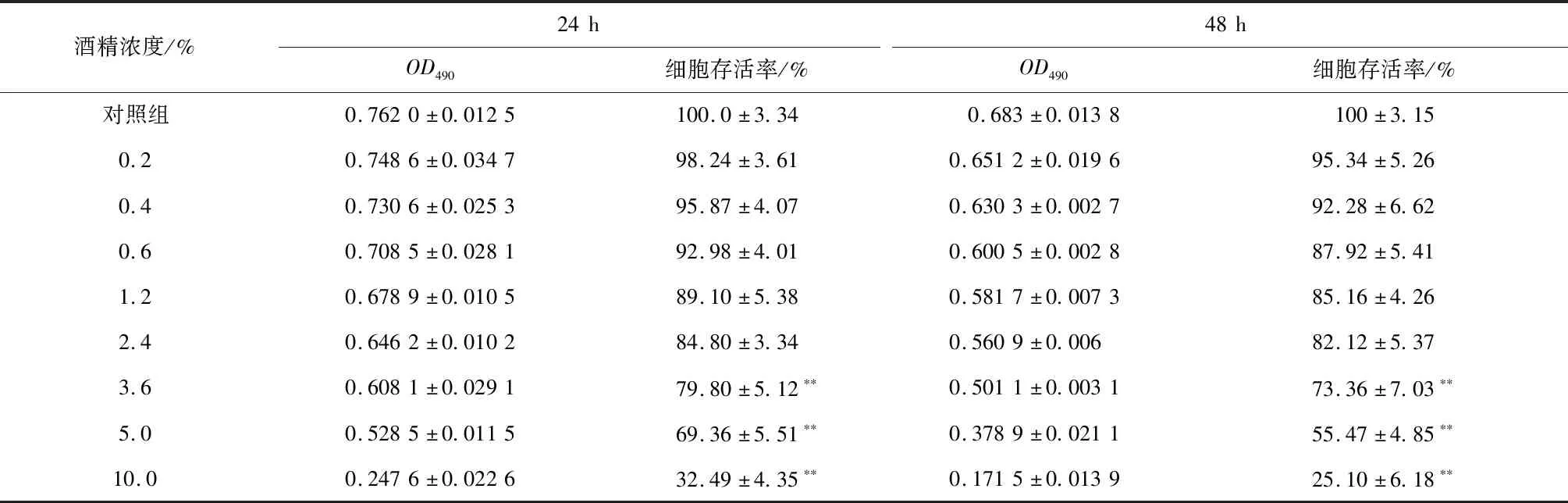
表3 不同浓度酒精处理24 h和48 h后的L-O2细胞活力
2.3 牛樟芝活性成分作用浓度确定
如表4和表5所示,随着细胞培养液中牛樟芝活性物质浓度的升高,L-O2细胞活力逐渐降低。当活性物质的浓度小于或等于10 μg/mL时,细胞存活率与Control组相比无统计学差异。当活性物质的浓度大于或等于15 μg/mL时,细胞存活率与Control组相比具有统计学差异(p<0.05),对L-O2细胞产生毒性,因此选择10 μg/mL作为诱导浓度。
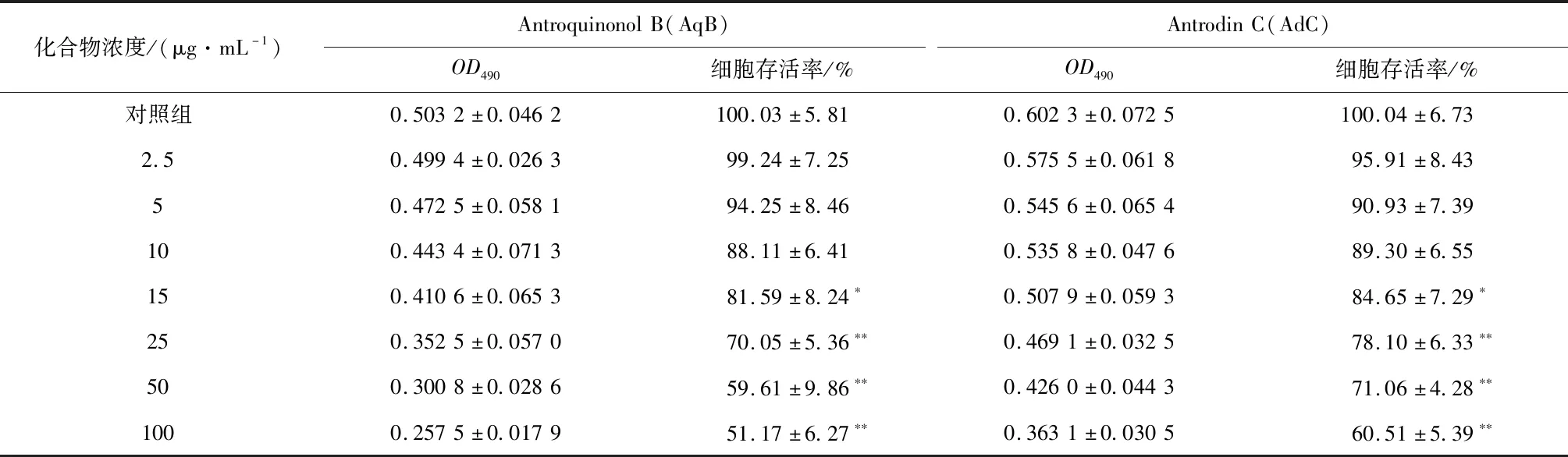
表4 不同浓度Antroquinonol B和Antrodin C对L-O2细胞活性的影响
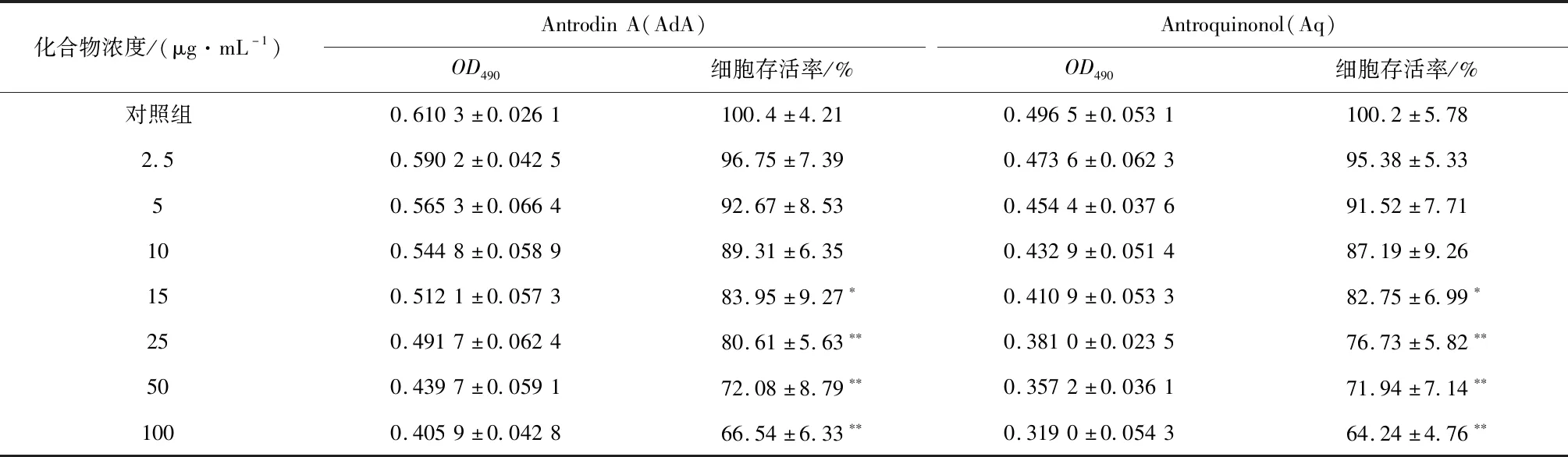
表5 不同浓度Antrodin A和Antroquinonol对L-O2细胞活性的影响
2.4 L-O2细胞形态学观察
培养过程中细胞形态的变化可直接反映细胞状态及受损情况。酒精诱导可引起细胞形态改变,原本贴壁生长的细胞会发生漂浮,甚至死亡[24]。如图3所示,在倒置显微镜观察下,正常组(NC)L-O2细胞轮廓清晰,排列紧密,形态相似,呈抱团生长趋势,状态良好。乙醇处理组(AL)组L-O2细胞因受酒精诱导刺激,出现细胞收缩,变亮变圆,部分细胞离壁飘起,导致细胞状态较差,活力降低。从两组细胞形态对比可直观看出浓度5%的乙醇对正常L-O2细胞造成明显损害。在活性物质与酒精联合培养的四组当中,AqB组和AdC组与AL组类似,部分细胞形态发生了明显改变,出现收缩变圆,贴壁性降低;AdA组和Aq组则仅少部分细胞发生形态变化,大多数细胞仍排列紧密抱团生长,细胞状态好于AL组。
因此,通过细胞形态观察,可以初步判定:经AdA和Aq干预后,细胞受损量降低。但各活性物质对酒精性肝细胞损伤的保护作用还需进一步通过检测细胞培养液内肝损伤标志酶活性和细胞内抗氧化酶活性来进行分析。
2.5 细胞外ALT和AST的活性
肝细胞损伤后,即使细胞内少量ALT和AST酶进入血中,也会导致血清中这两种酶的活性明显升高,因此ALT和AST是肝细胞损伤的标志酶[25]。通过检测细胞培养液中ALT和AST酶的活性,可以确定L-O2细胞损伤情况。
如图4所示,与对照组NC相比,AL组的ALT和AST酶活性显著升高(p<0.05),说明酒精诱导造成L-O2细胞损伤。
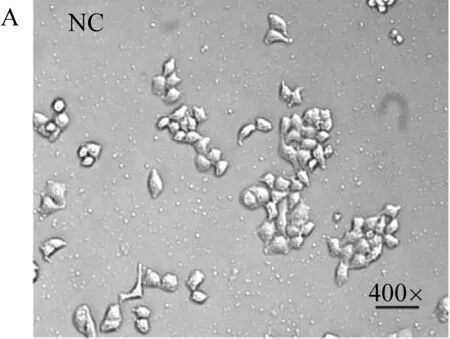
NC:未经任何处理,作为对照组;AL(Alcohol):酒精处理48 h图3 牛樟芝活性物质对酒精诱导的L-O2细胞损伤的影响
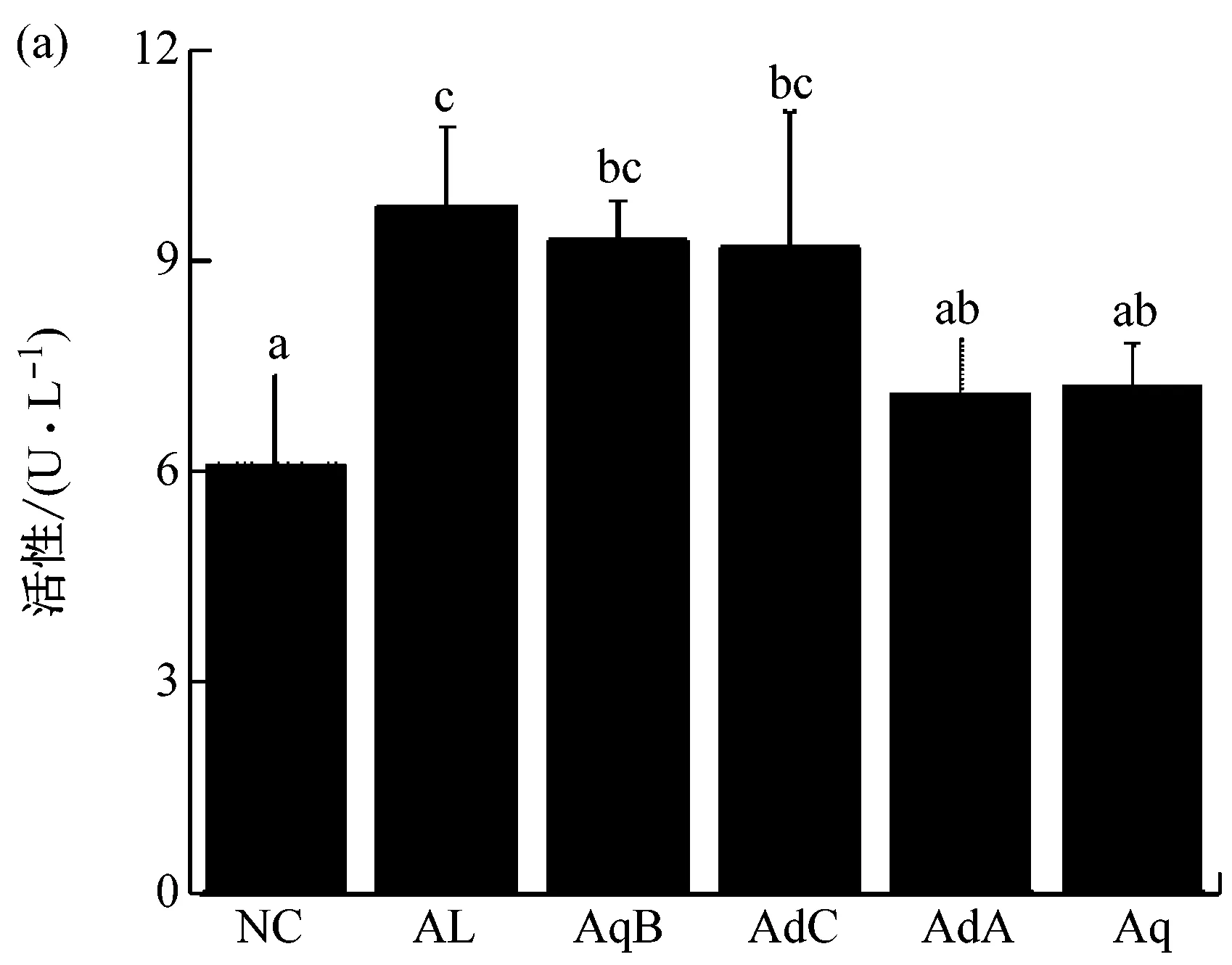
(a) 4种活性成分与酒精联合培养48 h后细胞培养液中ALT酶活性;(b) 4种活性成分与酒精联合培养48 h后细胞培养液中AST酶活性图4 4种牛樟芝固态发酵产物中的生物活性成分对ALT和AST酶活性水平的影响
AdA和Aq组细胞培养液中两酶活性与AL组相比明显降低(p<0.05),其中,Aq组的酶活水平与对照组NC无显著差异(p>0.05);然而,AqB和AdC组两酶活性水平与AL组比较,并无统计学意义上的差异(p>0.05)。从比较结果可以看出,AdA和Aq在抵抗酒精性肝细胞损伤方面的效果优于AqB和AdC。
2.6 细胞内MDA、SOD和GSH的活性
酒精代谢过程中会诱发氧化应激反应,导致细胞死亡或凋亡[26,27]。通过检测细胞内MDA、SOD和GSH的含量,可以确定L-O2细胞抗氧化能力[28]。如图5所示,与NC组相比,AL组细胞中SOD和GSH的含量分别降低了28.9%和60.8%,且两组之间有统计学差异(p<0.05),说明酒精诱导造成细胞抗氧化能力受损。与AL组相比,4种不同活性成分与酒精联合培养48 h后,SOD和GSH含量均出现了不同程度的升高。与AL组相比,AdA组、AdC组和Aq组细胞中GSH的含量分别升高了89.5%、49.3%和40.3%。AdA组和Aq组细胞中SOD的含量升高了26.5%和23.4%;AqB组组虽有升高的趋势,但与AL组相比并无显著性差异(p>0.05)。因此,AdA和Aq能够通过提高肝细胞抗氧化能力的方式缓解酒精性损伤。
此外,AL组细胞中MDA的含量较NC组显著升高,说明酒精诱导引起L-O2细胞脂质过氧化程度增加[29]。与AL组相比,4种活性成分与酒精联合培养48 h后,细胞中MDA含量出现不同程度的降低。与AL组相比,AdA组、AdC组和Aq组细胞中MDA的含量显著降低(分别为40.5%、24.3%和43.2%);AqB组的MDA含量水平与AL组相比无显著性差异(p>0.05)。通过培养期间细胞形态观察,以及培养结束后培养液中和肝细胞内各生理指标的检测进行综合分析,发现AdA和Aq在抵抗酒精性肝细胞损伤,提高细胞抗氧化能力方面的效果要明显优于AqB和AdC。这两种生物活性成分可用于后续动物实验验证及抗酒精性肝损伤机制研究。
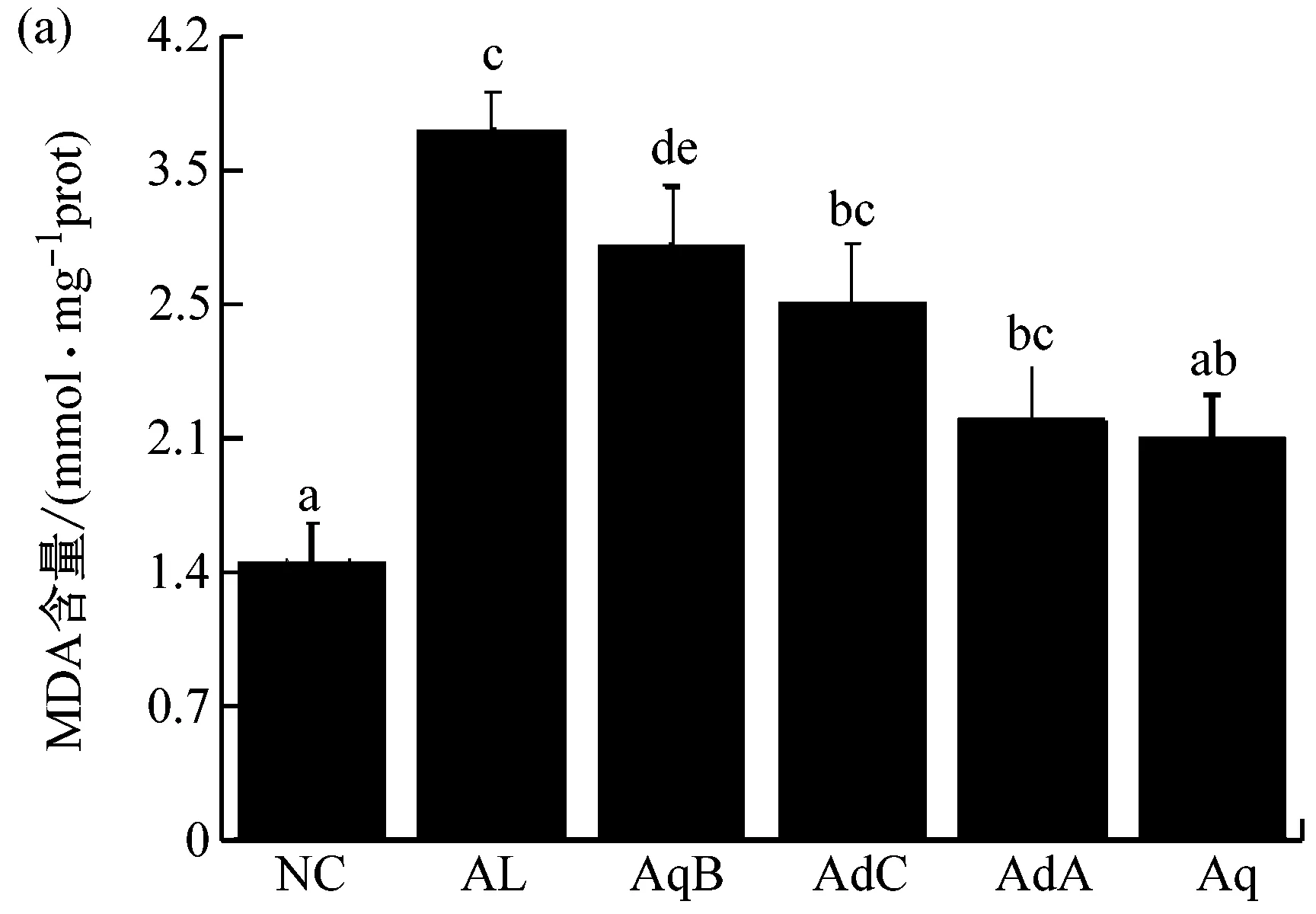
(a) MDA含量;(b) SOD含量;(c) GSH含量图5 4种牛樟芝固态发酵产物中的生物活性成分对肝细胞内MDA、SOD和GSH含量的影响
3 结论
本文从牛樟芝固态发酵产物中成功分离获取了4种活性成分:Antroquinonol B(AqB)、Antrodin C(AdC)、Antrodin A(AdA)和Antroquinonol(Aq)。对这4种活性成分进行了抗酒精性肝细胞损伤活性评价。结果表明,当酒精造模条件为:酒精浓度为5%、处理48 h,L-O2细胞活性为55.47%。MTT法评价显示,当活性物质的浓度大于或等于15 μg/mL时,细胞存活率与对照组相比具有统计学差异。酒精诱导会对L-O2细胞产生毒性。通过细胞胞内酶活性水平及相关指标测定,结合肝细胞形态学观察,我们发现AdA和Aq在抵抗酒精性肝细胞损伤方面的效果要优于AqB和AdC,二者能够显著提升肝细胞抗氧化能力,减少酒精性肝损伤。

