清血消脂方调节脂肪酸结合蛋白4和过氧化物酶增殖物激活受体表达对动脉粥样硬化小鼠的干预作用
康群甫 周明学 张蕾 刘红旭 刘卫红
摘要 目的:探討清血消脂方调节脂肪酸结合蛋白4(FABP4)和过氧化物酶增殖物激活受体(PPAR)表达对动脉粥样硬化小鼠的干预作用。方法:选取45只ApoE-/-小鼠经高脂喂养9周后,随机分为模型组(n=15)、立普妥(阿托伐他汀钙)组(n=15)、清血消脂方组(n=15);继续高脂喂养并药物干预9周后,测其血脂及血清同型半胱氨酸水平,主动脉斑块面积与斑块中胶原纤维含量;同时,测定FABP4、PPARα与PPARγ在肝脏及主动脉中mRNA及蛋白表达水平。结果:与模型组比较,清血消脂方可显著降低血清三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)与血清同型半胱氨酸(Hcy)水平,差异有统计学意义(P<0.05),且明显缩小主动脉斑块相对面积,差异有统计学意义(P<0.05)。清血消脂方显著降低主动脉中FABP4的mRNA及蛋白表达(P<0.05),并促进PPARγ mRNA及蛋白表达,差异有统计学意义(P<0.05);同时,清血消脂方可显著降低肝脏中FABP4的蛋白表达,并促进PPARγ的蛋白表达,差异有统计学意义(P<0.05)。结论:清血消脂方对动脉粥样硬化具有一定的防治作用,其机制可能与显著降低主动脉与肝脏中FABP4的mRNA及蛋白表达,并促进PPARγ的表达有关。
关键词 动脉粥样硬化;清血消脂方;脂肪酸结合蛋白4;过氧化物酶增殖物激活受体-α;过氧化物酶增殖物激活受体-γ;ApoE基因敲除小鼠;同型半胱氨酸;中医药
Qingxue Xiaozhi Formula on Atherosclerosis Intervention in Mice by Regulating the Expression of FABP4 and PPARs
KANG Qunfu1,2,ZHOU Mingxue2,ZHANG Lei2,LIU Hongxu3,LIU Weihong2
(1 Cardiovascular Department,Shunyi Hospital,Beijing Traditional Chinese Medicine Hospital,Beijing 101300,China; 2 Beijing Hospital of Traditional Chinese Medicine Affiliated to Capital Medical University/Beijing Institute of Traditional Chinese Medicine, Beijing 100010,China; 3 Cardiovascular Department,Beijing Hospital of Traditional Chinese Medicine Affiliated to Capital Medical University, Beijing 100010,China)
Abstract Objective:To explore the therapeutic mechanism of Qingxue Xiaozhi Formula(QXXZ) on atherosclerosis mice model via inhibiting FABP4 and promoting PPARγ in the aorta and liver.Methods:A total of 45 ApoE-knockout (ApoE-/-) mice fed with high-fat diet for 9 weeks were randomly divided into a model group (n=15),a Lipitor group (n=15) and a QXXZ group(n=15).For an additional 9 weeks with high-fat diet and drug intervention,blood lipids and homocysteine (Hcy) in serum,plaque areas in aorta,and collagen fibers in plaques were determined.The mRNA and protein expression levels of FABP4,PPARα and PPARγ in the liver and aorta were measured.Results:1) QXXZ significantly decreased the TGs,LDL-C and Hcy levels compared with the model group.And it significantly reduced the relative area of aortic plaque (P<0.05) 2) QXXZ significantly reduced FABP4 protein expression levels in the aorta (P<0.05),and promoted PPARγ mRNA and protein expression levels (P<0.05); at the same time,QXXZ can significantly reduce FABP4 protein expression levels in the liver and promote the protein expression of PPARγ (P<0.05).Conclusion:QXXZ has a certain preventive effect on atherosclerosis,and its mechanism may be related to significantly reducing the mRNA and protein expression levels of FABP4 in the aorta and liver,and promoting the expression of PPARγ.
Keywords Atherosclerosis; Qingxue Xiaozhi Formula; Fatty acid binding protein 4 (FABP4); Peroxisome proliferator-activated receptor-α (PPARα); Peroxisome proliferator-activated receptor-γ (PPARγ); Peroxidase proliferator activated receptor-γ; ApoE-knockout mic; Homocysteine,Traditional Chinese Medicine (TCM)
中图分类号:R285.5;R541文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.04.010
动脉粥样硬化是包括冠心病、心力衰竭等多数心血管疾病的重要病理基础。据统计,在我国每5例死亡患者中便有2例死于心血管疾病[1]。在心血管疾病整个病程中,脂代谢紊乱均发挥着重要作用[2];同时,同型半胱氨酸作为心血管疾病独立危险因素,在血管内皮细胞损伤、血管平滑肌细胞增殖以及抑制血管再生方面起着重要作用[3-5]。脂肪酸结合蛋白4(FABP4)与脂代谢过程中的胆固醇的代谢、转运与储存具有密切关系;FABP4在巨噬细胞内的高表达会增加胆固醇在巨噬细胞内的聚集,而当敲除FABP4基因时,则会促进巨噬细胞内胆固醇流出[6-8]。过氧化物酶增殖物激活受体(Peroxisome Proliferator-activated Receptor,PPAR)是核激素受体超家族;其中,PPARα与PPARγ在脂代谢紊乱、炎症反应及氧化应激等反应过程中均发挥重要作用,促进其表达可增强细胞内胆固醇的流出与体内胆固醇逆转运过程[9-10]。然而,在脂肪细胞组织中,FABP4可通过抑PPARγ的表达而促进脂质的合成,从而引起脂代谢紊乱,加速动脉粥样硬化的进展[11]。
清血消脂方(虎杖15 g、姜黄10 g、蒲黄10 g、茵陈15 g、大黄10 g、白术12 g、石菖蒲10 g、泽泻15 g、萆薢10 g、红花5 g)是首都医科大学附属北京中医医院国家中医药管理局中医心病学重点学科学术带头人、国家级名老中医黄丽娟教授研制的院内制剂,全方以化痰活血立法,在长期临床实践中获得良好疗效。前期临床与动物实验均表明,清血消脂方可通过降低人体及实验动物血清总胆固醇(TC)、三酰甘油(TG)水平、升高高密度脂蛋白膽固醇(HDL-C)水平抑制血管内斑块的形成;并且,可通过改善代谢性炎症反应小鼠血清内炎症介质减轻血管内皮炎症反应[12-13]。研究表明,在细胞水平上,清血消脂方亦可抑制巨噬细胞摄入胆固醇而演变为泡沫细胞,进而干预动脉粥样硬化进展[14]。但清血消脂方干预脂代谢紊乱的具体机制尚不明确。本研究将以ApoE-/-小鼠为研究对象,从mRNA及蛋白表达探讨清血消脂方干预脂代谢紊乱可能机制。
1 材料与方法
1.1 材料
1.1.1 动物 45只健康雄性ApoE-/-小鼠,品系C57BL/6J、6~8周龄、体质量(20±2)g;购于北京维通利华实验技术有限公司,许可证号:SCXK(京)2012-0001。动物实验符合首都医科大学附属北京中医医院实验动物伦理委员会的要求。
1.1.2 药物 清血消脂方各饮片购于首都医科大学附属北京中医医院中药房,按照李梦杰等[14]方法制备清血消脂方冻干粉;阿托伐他汀钙片(立普妥,辉瑞公司,批号:1337102)。
1.1.3 试剂与仪器 血脂检测试剂盒均购自英科新创(厦门)科技有限公司,批号:总胆固醇(TC):110821、三酰甘油(TG):110541、低密度脂蛋白胆固醇(LDL-C):120531、高密度脂蛋白胆固醇(HDL-C):120501。同型半胱氨酸(Hcy)测定试剂盒(雅培制药有限公司,美国,批号:#6502);VG染色试剂盒(福州市迈新生物技术开发公司,批号:1312178002);TRIzol总RNA提取试剂(北京天根生化科技有限公司,货号:DP405-02);FABP4抗体(abcam ab92501,1∶1 000),PPARα多克隆抗体(abcam,ab24509,1∶1 000),PPARγ多克隆抗体(ImmunoWay,货号:YM3443,1∶2 000)。
1.2 方法
1.2.1 分组与模型制备 45只ApoE-/-小鼠均饲养于SPF级动物室,环境条件:温度:22~24 ℃,湿度50%,光照时间7:00~19:00,自由采食摄水)。普通饲料喂养3 d后,更换为高脂饲料[21%脂肪(wt/wt)、0.15%胆固醇(wt/wt)]。9周后随机分为模型组(n=15)、阿托伐他汀钙组(立普妥组、n=15),清血消脂方组(n=15);继续高脂饲料喂养9周。
1.2.2 给药方法 依据体质量系数比计算各组小鼠给药量[15];其中,阿托伐他汀钙组按3 mg/kg体质量给予阿托伐他汀钙给药,清血消脂方组按4.541 g/kg体质量给予以清血消脂方给药;给药前将药物溶解于蒸馏水中,灌胃给药1次/d;同时,模型组给予等量蒸馏水灌胃。
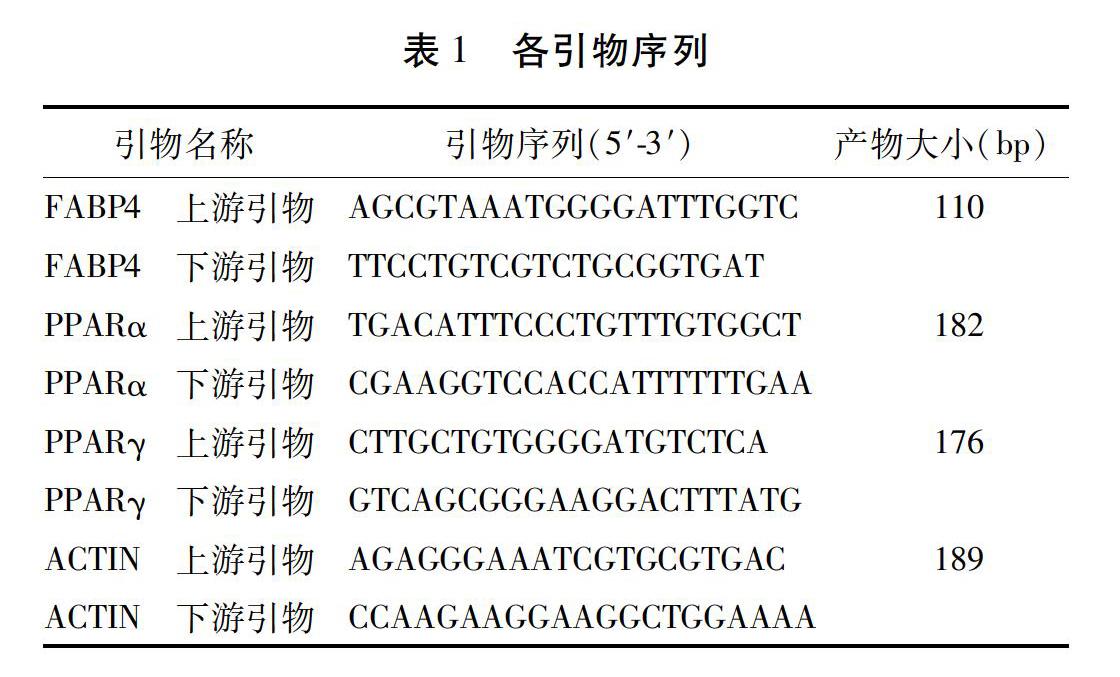
1.2.3 检测指标与方法 1)实验动物取材:末次给药后,所有小鼠禁食12 h;给予0.1%戊巴比妥钠腹腔麻醉(50 mg/kg体质量);即刻眶下眼静脉取血,经室温静置2 h后,离心分离血清,将血清置于-80 ℃冻存备用。同时,无菌条件下留取小鼠心脏、主动脉与肝脏标本,置于4%甲醛溶液固定。2)血清生化指标检测:各组所得血清2周内用于测定血清TC、TG、HDL-C、LDL-C及Hcy含量。具体实验操作步骤严格按照试剂盒说明书进行。3)病理学测定:各组小鼠心脏标本,经4%甲醛溶液固定72 h后,给予常规脱水、石蜡包埋、切片等。参照Suzuki等[16]建立的方法,留取主动脉瓣起始横断面,每隔100 μm取4张切片,切片厚5 μm,40 ℃温水中展平后贴于载玻片上,60 ℃烤片2 h。行常规HE染色与VG染色,使用Image Proplus6.0软件测量各组小鼠心脏标本斑块面积及斑块内胶原纤维含量,以百分率形式呈现。4)mRNA表达水平检测:每组随机取冻存主动脉及肝脏组织样本5例,采用TRIzol总RNA提取试剂进行RNA提取,采用PrimeScript RT reagent Kit with gDNA Eraser进行cDNA反转录,用ABI7500型荧光定量PCR仪进行扩增,扩增条件为95 ℃ 30 s,(95 ℃ 5 s,60 ℃ 40 s)×45个循环,采用2-△△Ct法进行相对定量分析。引物序列见表1。5)蛋白表达水平检测:每组随机取冻存主动脉及肝脏组织样本各3例,采用RIPA蛋白抽提试剂提取蛋白;采用BCA蛋白定量试剂盒测定蛋白浓度,以RIPA调整蛋白浓度,样品终浓度为4 mg/mL。后经常规电泳、转膜、封闭,随后加入一抗及FABP4、PPARα与PPARγ抗体;加入显影剂后,经化学发光法显色,成像扫描分析系统保存图像。
1.3 統计学方法
采用GraphPad Prism6.01软件对数据进行统计分析,实验数据以均数±标准差(±s)表示。2组间比较采用独立样本t检验,多组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
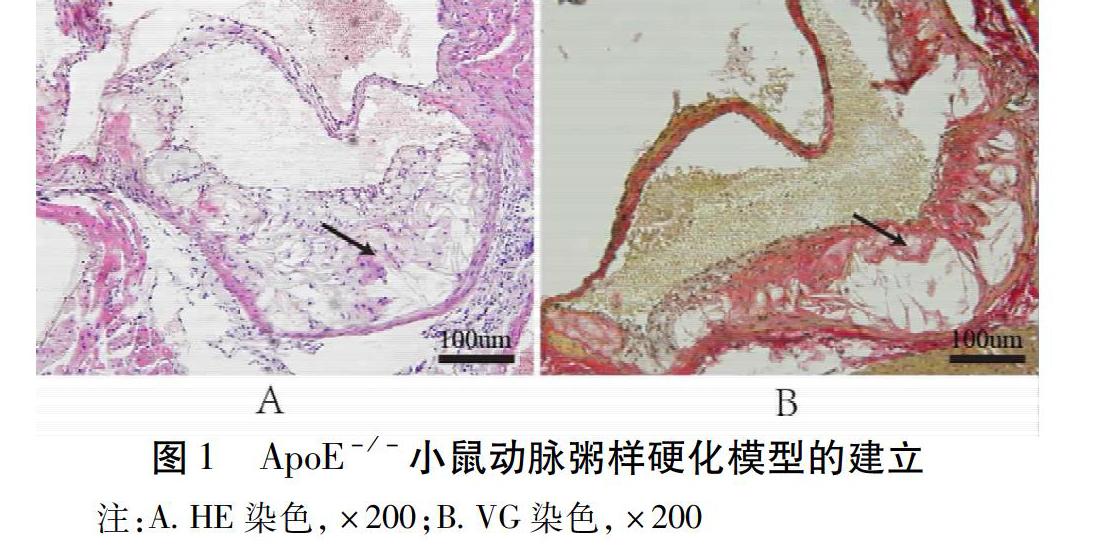
2.1 ApoE-/-小鼠动脉粥样硬化模型的建立
经HE染色,可见ApoE-/-小鼠主动脉根部形成明显斑块,斑块内大量胆固醇结晶及泡沫细胞聚集。见图1A。VG染色,可见模型组小鼠动脉粥样硬化斑块内胶原纤维含量减少。见图1B。
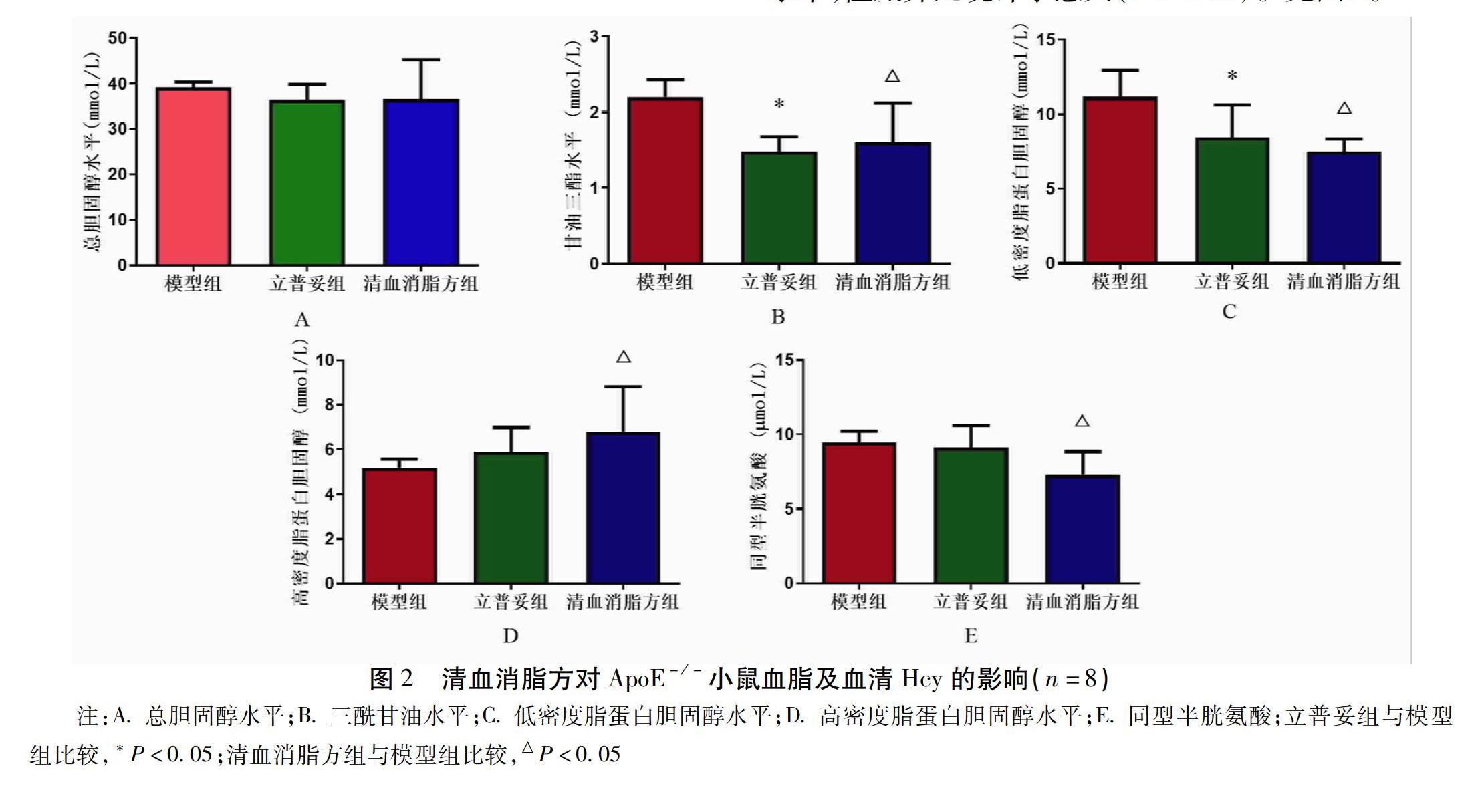
2.2 清血消脂方对各组小鼠血脂及血清同型半胱氨酸的影响
高脂喂养18周后,与模型组比较,清血消脂方可显著降低血清TG、LDL-C与血清Hcy水平,差异有统计学意义(P<0.05),并且升高HDL-C水平升高,差异有统计学意义(P<0.05)。同时,清血消脂方组与立普妥组均可一定程度上降低血清TC水平,立普妥可一定程度升高HDL-C水平,并降低血清Hcy水平,但差异无统计学意义(P>0.05)。见图2。
2.3 清血消脂方对ApoE-/-小鼠动脉粥样硬化斑块相对面积及胶原纤维含量的影响
经IPP软件拍照并观察、测量各组小鼠动脉粥样硬化斑块面积及斑块内胶原纤维含量。见图3。后计算各小鼠动脉粥样硬化斑块所占管腔相对面积及斑块内胶原纤维含量。结果显示,与模型组比较,立普妥组与清血消脂方组小鼠主动脉内斑块相对面积明显降低,差异有统计学意义(P<0.05)(图3A)。然而,立普妥组与清血消脂方组动脉粥样硬化斑块内胶原纤维含量较模型组虽均有升高(图3B),但差异无统计学意义(P>0.05)。
2.4 清血消脂方对ApoE-/-小鼠主动脉及肝脏中FABP4、PPARα与PPARγ mRNA表达的影响
与模型组比较,清血消脂方显著降低主动脉中FABP4 mRNA表达水平,并可促进PPARα与PPARγ mRNA的表达,差异有统计学意义(P<0.05)。同时,清血消脂方亦可促进PPARα在肝脏中的mRNA表达,差异有统计学意义(P<0.05)。见图4。
2.5 清血消脂方对ApoE-/-小鼠主动脉及肝脏中FABP4、PPARα与PPARγ蛋白表达的影响
与模型组比较,清血消脂方可显著降低主动脉及肝脏中FABP4的蛋白表达,差异有统计学意义(P<0.05),并且显著增加主动脉及肝脏中PPARγ的蛋白表达,差异有统计学意义(P<0.05)。见图5。
3 讨论
动脉粥样硬化是一种主要发生在大、中弹力型动脉,病变由内膜开始,先后出现脂质条纹、纤维组织增生、粥样斑块形成的血管性疾病[17]。以动脉粥样硬化为病理基础的冠心病、脑梗死等心脑血管疾病是引起我国居民患病死亡的首要原因[1]。在整个动脉粥样硬化进程中,脂代谢紊乱发挥重要作用;其中,以胆固醇及三酰甘油代谢紊乱最为显著[18]。通过改善脂代谢紊乱,可减轻冠状动脉狭窄程度,从而干预动脉粥样硬化的进展[19]。
动脉粥样硬化的一系列症状可归属于中医学“胸痹”“真心痛”“眩晕”“头痛”“血瘀”与“痰证”等病证之中;此类病证多以气血亏虚在本,痰、瘀阻滞为标[20]。对此类病证的治法,则多以益气活血、化痰祛瘀为主。清血消脂方以祛浊化瘀法组方,全方由虎杖、姜黄、蒲黄、泽泻、萆薢、茵陈、红花、酒大黄、白术、石菖蒲等组成,方中酒制大黄通腑泄浊、活血祛瘀,蒲黄行血活血、补中气,姜黄破气行血,兼可防大黄过寒而为君;泽泻、萆薢、茵陈助君药利湿泄浊而为臣,佐以白术健脾祛湿、菖蒲开窍醒脾化湿浊,红花活血通络;全方共奏利湿兼行血,活血兼化痰,祛瘀重通脉,通腑以泻浊的功效。清血消脂方的前期研究显示,清血消脂方可显著改善高脂血症患者及动物血脂水平以及代谢性炎性小鼠血清炎症介质水平[12-13]。体外实验表明,清血消脂方可通过抑制巨噬细胞摄入胆固醇从而演变为泡沫细胞,进而干预动脉粥样硬化进展[14]。本研究表明,清血消脂方对血脂水平及同型半胱氨酸的有效干预作用,并且从干预FABP4及PPARs表达的作用探讨清血消脂方干预动脉粥样硬化炎症反应进展及斑块形成的机制。
FABP4是细胞脂质结合蛋白超家族中的一种,在脂代谢过程中发挥着重要的转运及靶向定位功能[21]。有研究表明,FABP4在胆固醇代谢及炎症反应等病理过程中发挥着重要的调节作用,通过敲除FABP4基因可促进巨噬细胞内胆固醇的逆转运过程,而FABP4的过表达则会促进巨噬细胞内胆固醇的沉积[7-8,22]。本研究通过高脂喂养ApoE-/-小鼠制备动脉粥样硬化模型,经清血消脂方干预9周后,结果显示:清血消脂方可显著降低主动脉中FABP4的mRNA及蛋白表达,并且对肝脏中FABP4的mRNA表达起到一定抑制作用。另外,研究结果还显示,清血消脂方可显著降低动脉粥样硬化小鼠模型血清Hcy水平。有体外实验发现,Hcy水平的升高可引起FABP4基因在巨噬细胞中的表达,进而导致巨噬细胞内胆固醇的积聚,加速巨噬细胞向泡沫细胞的演变,促进动脉粥样硬化的进展[22]。因此,我们推测清血消脂方降低血中Hcy水平,有可能是抑制FABP4表达的机制之一。
过氧化物酶增殖物激活受体(Peroxisome Proliferator-activated Receptor,PPAR)属Ⅱ型核受体超家
族成员之一,经研究证实,PPARα与PPARγ在脂肪细胞分化、糖脂代谢、炎症反应及动脉粥样硬化过程中均发挥着重要作用[9]。其中,在肝脏的能量代谢过程中,PPARα可通过调节脂肪酸的氧化从而控制脂肪酸的摄入,减轻肝脏内脂质的沉积[23]。通过激活PPARα可有效抑制巨噬细胞炎症反应,从而延缓动脉粥样硬化进程[24]。PPARγ是目前研究最多的一个亚型,其可促进脂代谢紊乱中胆固醇的逆转运,从而抑制巨噬细胞演变为泡沫细胞,干预动脉粥样硬化的进程[25]。有实验表明,通过上调组织中PPARγ含量可改善小鼠胰岛素抵抗、降低血液中TC、TG水平,从而改善脂代谢紊乱,发挥抗动脉粥样硬化作用[26]。另有研究证实,在脂肪细胞组织中,FABP4可通过抑PPARγ的表达而促进脂质的合成,从而引起脂代谢紊乱,促进动脉粥样硬化的进展[11]。本实验结果表明,清血消脂方可显著升高PPARγ在主动脉中的mRNA及蛋白表达以及在肝脏中的蛋白表达;并且可显著升高主动脉及肝脏中PPARα的mRNA表达。
综上所述,清血消脂方对动脉粥样硬化小鼠模型具有显著的干预作用,这种干预作用与其降低血脂及血清Hcy水平有直接关系;而清血消脂方抑制主动脉及肝脏中FABP4的表达,并促进PPARα与PPARγ的表达,可能是其干预动脉粥样硬化的机制之一。
参考文献
[1]胡盛寿,高润霖,刘力生,等.《中国心血管病报告2018》概要[J].中国循环杂志,2019,34(3):209-220.
[2]田海涛,曹芳英,朱智明,等.心血管疾病不容忽视的问题:血管内皮细胞损伤[J].转化医学杂志,2013,2(3):173-177.
[3]Dalton ML,Gadson PF,Wrenn RW,et a1.Homocysteine signal cascade:production of phospholipids,actiration of protein kinase C,and the induction of cfoscmyc in smooth muscle cells[J].FASEB J,2008,11(8):703-711.
[4]Sen S,McDonald SP,Coates PT,et al.Endothelial progenitor cells:novel biomarker and promising cell therapy for cardiovascular disease[J].Clin Sci(Lond),2011,120(7):263-283.
[5]Yin Y,Pastrana JL,Li X,et al.Inflammasomes:sensors of metabolic stresses for vascular inflammation[J].Front Biosci(Landmark Ed),2013,18:638-649.
[6]楊茜,邹大进.脂肪细胞型脂肪酸结合蛋白与胆固醇代谢[J].中华内分泌代谢杂志,2015,31(7):625-628.
[7]Makowski L,Brittingham KC,Reynolds JM,et al.The fatty acid binding protein,aP2,coordinates macrophage cholesterol trafficking and inflammatory activity.Macrophage expression of aP2 impacts peroxisome proliferator activated receptor and IB kinase activities[J].J Biol Chem,2005,280(13):12888-12895.
[8]Fu Y,Luo L,Luo N,et al.Lipid metabolism mediated by adipocyte lipid binding protein(ALBP/aP2)gene expression in human THP-1 macrophages[J].Atherosclerosis,2006,188(1):102-111.
[9]Xu P,Xu K,Wang J,et al.Pioglitazone:a promising therapeutic toolin sodium taurocholate-induced severe acute pancreatitis[J].Dig Dis Sci,2011,56(4):1082-1089.
[10]Hiukka A,Maranghi M,Matikainen N,et al.PPARalpha:an emerging therapeutic target in diabetic microvascular damage[J].Nat Rev Endocrinol,2010,6(8):454-463.
[11]Garin-Shkolnik T,Rudich A,Hotamisligil GS,et al.FABP4 attenuates PPARγ and adipogenesis and is inversely correlated with PPARγ in adipose tissues[J].Diabetes,2014,63(3):900-911.
[12]罗海,张婷,王振国.荷丹片联合阿托伐他汀对血脂异常患者血清同型半胱氨酸和炎症因子水平及血管内皮舒张功能的影响[J].中国医药,2020,15(10):1518-1522.
[13]尹珉,薛孔芳,王莒生,等.清血消脂片降血脂作用的试验研究[J].中国实验方剂学杂志,2001,7(4):62-63.
[14]黎美欢,李颖,陈铭泰,等.脂必泰胶囊联合他汀调节冠心病患者血脂水平的Meta分析[J].中国中药杂志,2020,45(12):2966-2974.
[15]Zhou M,Xu H,Pan L,et al.Rosiglitazone promotes atherosclerotic plaque stability in fat-fed ApoE-knockout mice[J].Eur J Pharmacol,2008,590(1-3):297-302.
[16]Suzuki H,Kurihara Y,Takeya M,et al.A role for macrophage scavenger receptors in atherosclerosis and susceptibility to infection[J].Nature,1997,386(6622):292-296.
[17]Lusis AJ.Atherosclerosis[J].Nature,2000,407(6801):233-241.
[18]Ai D,Chen C,Han S,et al.Regulation of hepatic LDL receptors by mTORC1 and PCSK9 in mice[J].J Clin Invest,2012,122(4):1262-1270.
[19]王沛堅.激活TRPV1上调UCP2防治糖脂代谢紊乱致动脉粥样病变的机制研究[D].重庆:第三军医大学,2013.
[20]王隆均.痰病证治浅谈[J].医学信息(下旬刊),2013,26(12):511-512.
[21]Hertzel AV,Bernlohr DA.The mammalian fatty acid-binding protein multigene family:molecular and genetic insights into function[J].Trends Endocrinol Metab,2000,11(5):175-180.
[22]梁宇.FABP4表达变化在Hcy诱导THP-1单核细胞源性巨噬细胞胆固醇聚积中的作用及其机制的研究[D].银川:宁夏医科大学,2013.
[23]Misra P,Reddy JK.Peroxisome proliferator-activated receptor-α activation and excess energy burning in hepatocarcinogenesis[J].Biochimie,2014,98:63-74.
[24]杨蓉蓉,张莉,张向颖,等.过氧化物酶体增殖物激活受体α(PPARα)对脂多糖刺激巨噬细胞引发炎症反应的影响[J].中华微生物学和免疫学杂志,2015,35(6):431-435.
[25]Chawla A,Boisvert WA,Lee CH,et al.A PPAR gamma-LXR-ABCA1 pathway in macrophages is involved in cholesterol efflux and atherogenesis[J].Mol Cell,2001,7(1):161-171.
[26]陈俊,肖万泽.辛润苦泄法对胰岛素抵抗大鼠TNF-α和PPAR-γ表达的影响[J].新中医,2013,45(1):147-150.
(2019-12-08收稿 责任编辑:杨觉雄)

