基于网络药理学探讨清肺化痰方改善慢性阻塞性肺疾病的作用机制
薛艳 许嘉慧 高艳荣 陈飞飞 孙仕奇 张炜
摘要 目的:通過网络药理学及分子对接技术探究清肺化痰方改善慢性阻塞性肺疾病急性加重期(AECOPD)气道黏液高分泌的有效成分和潜在分子机制。方法:首先使用中药系统药理学分析平台(TCMSP)收集清肺化痰方的活性成分和潜在靶点,利用GeneGards等多个数据库筛选AECOPD气道黏液高分泌的疾病靶点;然后将疾病靶点与药物预测靶点取交集,借助Cytoscape3.7.2软件构建交集靶点网络以及蛋白质-蛋白质相互作用网络,利用DAVID进行GO和KEGG富集分析。最后,将药物活性成分与疾病靶点进行分子对接。结果:清肺化痰方中54个有效活性成分可通过67个潜在靶标改善AECOPD的气道黏液高分泌,涉及TNF信号通路、IL-17、PI3K-Akt等相关信号通路。槲皮素、木犀草苷、β-谷甾醇等成分与AKT1、IL6、EGF等靶标蛋白结合稳定。结论:初步揭示清肺化痰方可直接改善AECOPD气道黏液高分泌,以及其多靶点、多通路的潜在作用机制,为后续研究提供思路。
关键词 网络药理学;分子对接;气道黏液高分泌;慢性阻塞性肺疾病急性加重期;清肺化痰方
Exploring the Mechanism of Therapeutic Effect of Qingfei Huatan Decoction on Chronic Obstructive Pulmonary Disease Based on Network Pharmacology
XUE Yan1,XU Jiahui2,GAO Yanrong1,CHENG Feifei1,SUN Shiqi1,ZHANG Wei1
(1 Department of Respiratory Diseases,Shuguang Hospital Affiliated to Shanghai University of Traditional Chinese Medicine,Shanghai 201203,China; 2 Department of Endocrinology,Shuguang Hospital Affiliated to Shanghai University of Traditional Chinese Medicine,Shanghai 201203,China)
Abstract Objective:To explore the potential active components and underlying molecular mechanisms of Qingfei Huatan Decoction to improve the hypersecretion of airway mucus in acute exacerbation of chronic obstructive pulmonary disease(AECOPD)through the network pharmacology and molecular docking technology.Methods:First,the active components and potential targets of Qingfei Huatan Decoction were collected through the traditional Chinese medicine system pharmacology analysis platform(TCMSP),and the targets related to airway mucus hypersecretion in AECOPD were screened by GeneCards database.Then,the disease target and the drug prediction target were intersected,and the intersection target network and protein interaction network were constructed with the help of Cytoscape 3.7.2 software,and the GO and KEGG enrichment analysis were performed by DAVID.Finally,the active ingredient of the drug was molecularly docked with the disease target.Results:A total of 54 effective active ingredients of Qingfei Huatan Decoction were obtained,which could act on AECOPD airway mucus hypersecretion through 67 potential targets,involving TNF signaling pathway,IL-17,epidermal growth factor receptor tyrosine kinase inhibitors resistance,PI3K-Akt,HIF-1,MAPK and other related signaling pathways.Molecular docking results showed that quercetin,luteolin,beta-sitosterol and other pharmaceutical active ingredients could bind to AKT1,IL6,EGF and other target proteins stably.Conclusion:The molecular docking technique reveals that Qingfei Huatan Decoction can directly improve the airway mucus hypersecretion of AECOPD and achieve therapeutic effects.Through the network pharmacology,the potential mechanism of its multi-target and multi-pathway was initially revealed,which provides ideas for further research.
Keywords Network pharmacology; Molecular docking; Airway mucus hypersecretion; Acute exacerbation of chronic obstructive pulmonary disease(AECOPD); Qingfei Huatan Decoction
中图分类号:R285文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.04.006
慢性阻塞性肺疾病(Chronic Obstructive Pulmonary Disease,COPD)是一种临床常见疾病,具有高患病率、高死亡率、高致残率、高疾病负担的特点,2020年其患病率位列第3位[1]。COPD急性加重期(Acute Exacerbation of Chronic Obstructive Pulmonary Disease,AECOPD)是指患者呼吸道症状的急性恶化,是COPD患者死亡的独立危险因素,也是造成疾病负担的重要部分,严重影响患者生命质量及预后[2]。
AECOPD属中医学“咳嗽、喘证、肺胀”等范畴,痰热壅肺、痰瘀互阻为AECOPD的病机关键[3-4]。痰热壅肺证为其最常见证型[5]。清热化痰兼以化瘀为AECOPD的关键治法,治疗AECOPD疗效确切[6-7]。清肺化痰方为张炜教授经验方,由经方千金苇茎汤加减化裁而成,针对AECOPD痰、热、瘀的核心病机,组方包括开金锁、冬瓜子、桃仁、杏仁、芦根、桔梗、橘红、橘络、败酱草、虎杖、鱼腥草、枳壳,具有清热化痰、祛瘀通络、止咳平喘之功。本研究前期临床试验提示,清肺化痰方联合西医常规治疗可以协同增效,能够有效改善AECOPD患者咳嗽、咳痰等临床症状,改善痰液性状积分、改善痰黏蛋白等指标,但其有效作用的具体机制尚未明确。网络药理学的不断进步和应用,为清肺化痰方的临床效应机制研究提供了有力的帮助,本研究使用网络药理和分子对接的技术和方法,构建清肺化痰方治疗AECOPD的成分-靶点网络,并分析该方多成分-多靶点间复杂网状关系,预测其改善AECOPD气道黏液高分泌的潜在作用靶点和内在机制,为深入的研究提供一定依据。
1 材料与方法
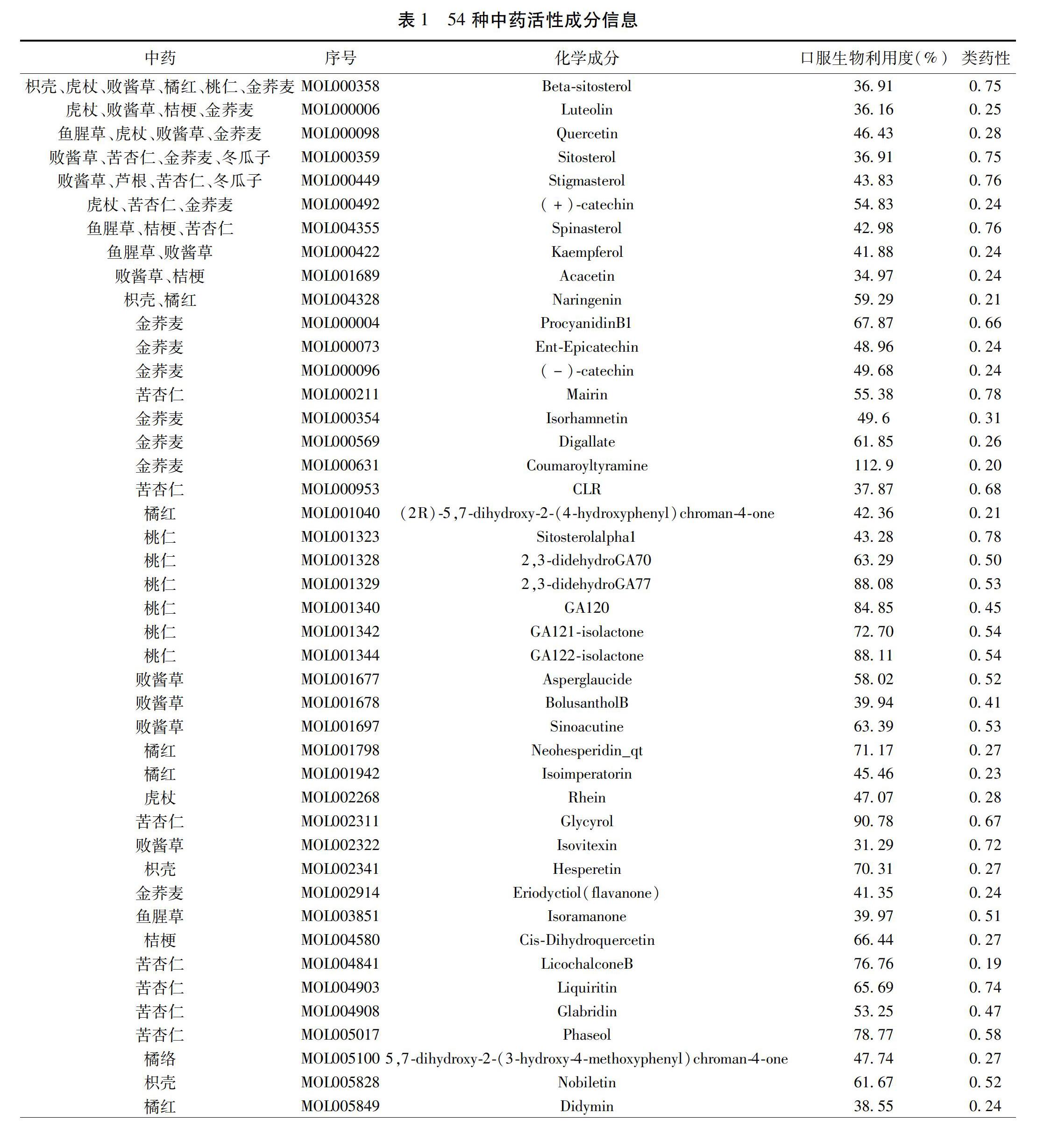
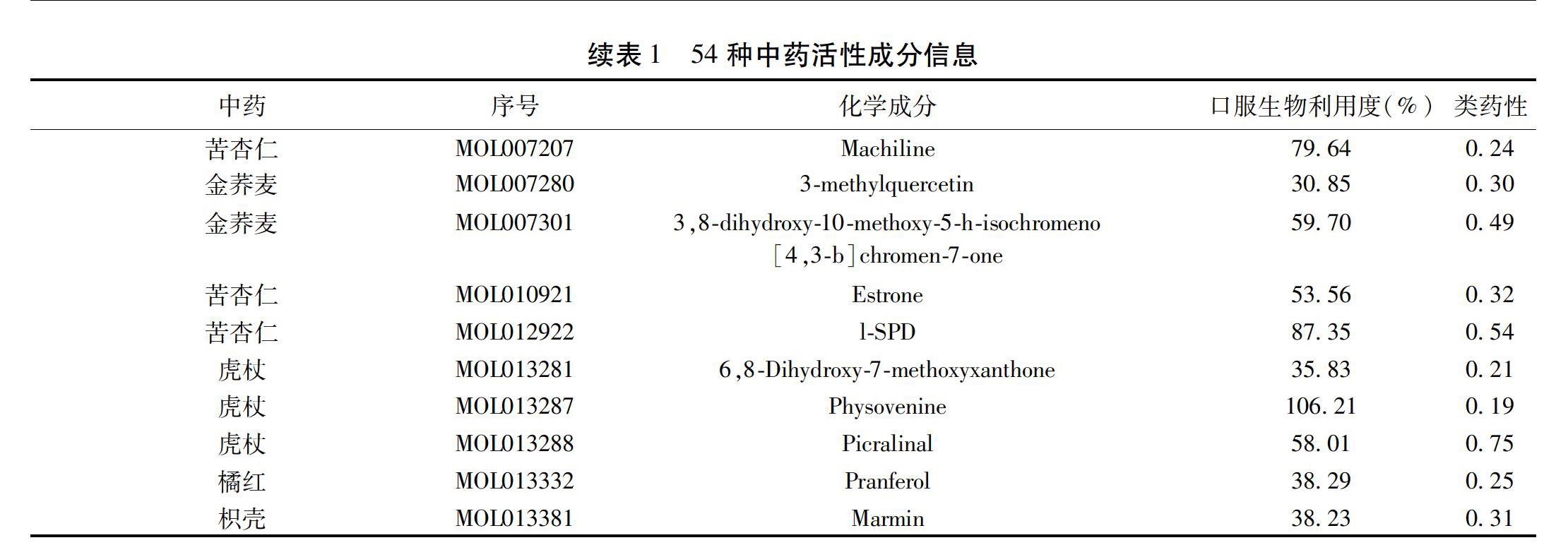
1.1 清肺化痰方的活性成分和预测靶点 借助中药系统药理学数据库与分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP)(http://tcmspw.com/tcmsp.php)分别检索了清肺化痰方中12味中药相关的活性成分,筛选出其中口服生物利用度(Oral Bioavailability,OB)≥30%和类药性(Drug Likeness,DL)≥0.18者,并结合Uniprot数据库将符合标准的活性成分靶点信息基因名规范化。
1.2 AECOPD气道黏液高分泌机制相关靶点的预测 以“Acute exacerbation of chronic obstructive pulmonary disease airway mucus hypersecretion”,“AECOPD airway mucus hypersecretion”为关键词在GeneCards数据库(https://www.genecards.org/)和OMIM数据库(https://omim.org/)中检索相关基因,删重,最终得到AECOPD气道黏液高分泌相关靶基因。
1.3 活性成分-靶点网络构建 将清肺化痰方有效成分靶点与AECOPD气道黏液高分泌相关靶点进行映射,取交集,借助Cytoscape3.7.2软件完成活性成分-疾病靶点网络图。
1.4 构建蛋白质-蛋白质相互作用(Protein-Protein Interaction,PPI)网络筛选关键靶点 将筛选后交集靶点导入STRING数据库中,选择物种为“Homo Sapiens”,置信度>0.4,获得的信息数据,输入Cytoscape进行可视化做图。
1.5 生物信息富集分析 将清肺化痰方的作用靶标导入DAVID数据库(https://DAVID.ncifcrf.gov),进一步进行基因本体论(Gene Ontology,GO)分析和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析,借助R包(Ggplot2)将其中P.adjust<0.05的生物过程及信号通路可视化。
1.6 基因-通路网络构建 为清晰展示经过网络药理学分析,清肺化痰方治疗AECOPD气道黏液高分泌,所涉及的信号通路及基因,本研究进行了进一步的网络可视化。将KEGG分析所获得的信号通路,及交集靶点富集到相关信号通路的基因,输入Cytoscape,进行了基因通路网络的构建。此网络代表了清肺化痰方治疗AECOPD气道黏液高分泌所涉及的全部通路及基因。
1.7 活性成分与关键靶点的分子对接验证 将上述网络中结合靶点数目最多的活性成分与PPI网络中“Degree”值最大的靶点进行分子对接,以对接分数值(Docking Score)对潜在核心成分与关键靶点之间的结合活性进行评价。我们采用ChemBioDraw Ultra 17.0画出化合物槲皮素(Quercetin)、木犀草苷(Luteolin)、山柰酚(Kaempferol)、川陈皮素(Nobiletin)、刺槐素(Acacetin)和β-谷甾醇(Beta-sitosterol)的结构,然后用ChemBio3D Ultra 17.0转化为三维结构,并使用MMFF94力场进行优化。AKT1(Degree值為57),IL6(Degree值为55),CASP3(Degree值为53),VEGFA(Degree值为53)和EGF(Degree值为52)的三维结构从RCSB Protein Data Bank(www.rcsb.org)下载得到,我们选取了AKT1的三维结构(PDB ID:4gv1)、IL6的三维结构(PDB ID:4ni9)、CASP3的三维结构(PDB ID:4qub)、VEGFA的三维结构(PDB ID:5fv1)和EGF的三维结构(PDB ID:2kv4)作为本课题对接所用的蛋白质。蛋白质和化合物Genistein均使用AutodockTools 1.5.6[8-9]转化为PDBQT格式。本课题采用Autodock vina 1.1.2[10]进行分子对接研究。除了特别说明,其他参数均采用默认值。最后,选取打分值最高的构象用Free Maestro 11.9进行结果分析。
2 结果
2.1 清肺化痰方活性成分及作用靶点信息收集 通过TCMSP检索到符合标准的清肺化痰方活性成分共112個,其中开金锁15个、冬瓜子2个、桃仁23个、杏仁19个、芦根1个、桔梗7个、橘红9个、橘络1个、败酱草13个、虎杖10个、鱼腥草7个、枳壳5个。利用Uniprot数据库将以上活性成分最后的预测靶点进一步规范化,删重后,最终总计得到作用靶点基因236个。
2.2 AECOPD气道黏液高分泌机制相关靶点的收集 使用GeneCards、OMIM数据库总计收集到AECOPD气道黏液高分泌机制相关靶点764个。
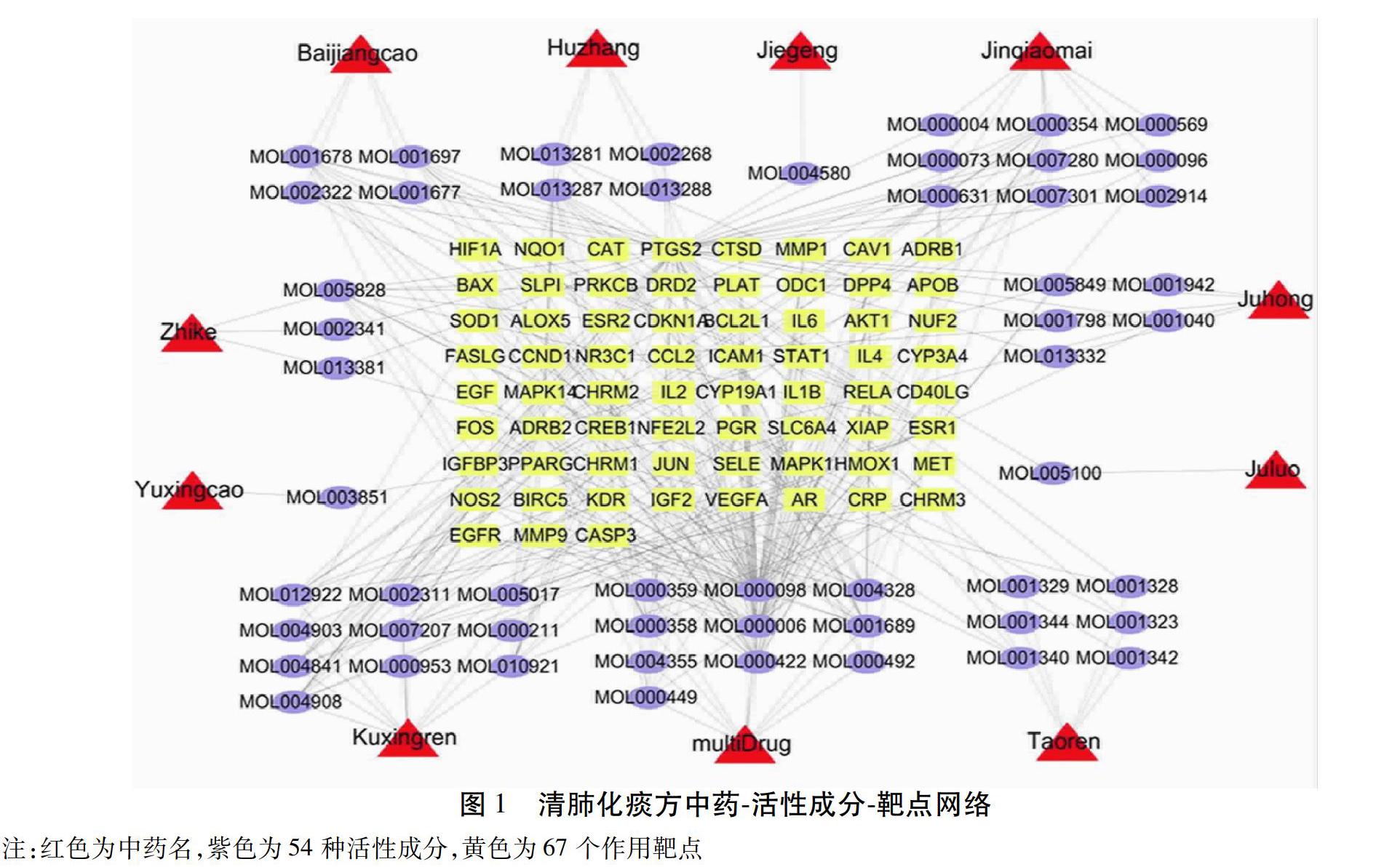
2.3 活性成分-靶点网络分析 计算得到67个交集靶点,提示清肺化痰方可通过以上67个靶点改善AECOPD气道黏液高分泌。67个靶点对应54种有效活性成分,详细信息见表1。利用Cytoscape软件构建活性成分-靶点网络,其涵盖132个节点与366条表示活性成分和靶点之间的相互关系的边。见图1。
2.4 PPI网络 PPI网络包含67个节点(蛋白),918条边(蛋白质之间的相互作用关系)。图中颜色由外到内颜色越深表示该蛋白质-蛋白质相互作用程度(Degree)越高。本研究筛选出在网络图中起关键作用的——颜色最深的、节点度值最大的5个靶点蛋白,分别是AKT1(Degree值为57)、IL6(Degree值为55)、CASP3(Degree值为53)、VEGFA(Degree值为53)、EGF(Degree值为52)。见图2。
2.5 GO功能富集与KEGG通路富集分析 将最终的关键靶点进行GO与KEGG富集分析,最终本文将P-adj<0.05排名前20的GO中生物过程(BP)条目绘制柱状图。见图3。包括腺体发育、生殖结构发育、DNA结合转录因子活性的调节等生物过程,筛选出6条KEGG显著富集的通路,包括TNF信号通路、IL-17信号通路、表皮生长因子受体酪氨酸激酶抑制剂抵抗、PI3K-Akt信号通路、HIF-1信号通路、MAPK信号通路。见图4。
2.6 基因-通路网络分析 使用Cytoscape软件将TNF、IL-17信号通路等6条KEGG通路信息和富集基因构建了包含35个核心目标基因和6条通路的基因-通路网络。见图5。
2.7 分子对接 根据以上结果,将槲皮素(Quercetin)、木犀草苷(Luteolin)、β-谷甾醇(Beta-sitosterol)、刺槐素(Acacetin)等预测靶点最多的活性成分与AKT1、IL6、CASP3、VEGFA、EGF等度值最大的靶点进行分子对接,结果提示均具有良好的结合活性。见表2,图6。
3 讨论
AECOPD常以喘息、咳嗽加剧,咳吐大量黄浓痰为典型表现,属于中医学肺脏、喘病范畴,气道黏液高分泌是引起患者咳嗽咳痰病理生理机制[11],贯穿着COPD发生发展全过程,是影响病情和预后的独立危险因素[2],管理气道黏液高分泌为COPD治疗的重要目标[12],而中医药治疗在AECOPD改善气道黏液高分泌中具有关键作用。痰、热、瘀为AECOPD的病机关键,久病入络,AECOPD患者多见痰热瘀搏结损伤肺络,故清热化痰、化瘀通络以复肺之宣肃,为重要治法,千金苇茎汤具有清肺化痰,逐瘀排脓之功,为临证常用经方,既往多项研究表明苇茎汤为基础的方药治疗AECOPD具有确切疗效[13-14],以清热化痰法为代表的中医药能显著改善AECOPD患者咳嗽咳痰等症状、有效改善COPD大鼠或患者的气道黏液高分泌状态[15-19]。在此基础上张炜教授以千金苇茎汤加减、结合现代研究及临证经验,拟清肺化痰方,作为曙光医院呼吸科AECOPD痰热壅肺证患者协定方,能明显改善患者咳嗽、咳痰症状及气道黏液高分泌情况,然而其具体作用机制尚未明晰。因此,我们采用网络药理学及分子对接方法探究其作用的有效成分和可能机制。
本研究结果显示,基于“药物活性成分-疾病靶点”可视化调控网络图,揭示了清肺化痰方多成分、多靶点的作用特点,研究得到了54种活性成分,主要包括槲皮素(Quercetin)、木犀草苷(Luteolin)、山柰酚(Kaempferol)、川陈皮素(Nobiletin)、刺槐素(Acacetin)等黄酮类化合物,β-谷甾醇(Beta-sitosterol)等植物甾醇类化合物,通过STRING数据库构建PPI后筛选出前5个节点度值的靶点蛋白,分别是AKT1(Degree值为57),IL6(Degree值为55),CASP3(Degree值为53),VEGFA(Degree值为53),EGF(Degree值为52),AKT是PI3K下游的关键蛋白,抑制PI3K/Akt信号通路能有效降低MUC5AC蛋白的表达[20-21];白细胞介素-6(IL-6)是最重要的炎症介质之一,在AECOPD过程中明显升高,可有效预测AECOPD的进展,是影响AECOPD发生发展的危险因素[22],可通过调节核因子 -κB通路参与AECOPD的炎症反应及黏液高分泌过程[23];MUC5B为气道黏蛋白的重要成分之一,IL-6介导JAK2依赖的自分泌或旁分泌途径可促进MUC5B基因的表达,同时还可通过ERK信号传导通路上调MUC5B基因的表达[24],也有研究提示COPD及AECOPD大鼠、患者IL-6水平与MUC5AC等气道黏蛋白正相关[25-27];血管内皮生长因子(VEGF)是在肺组织的气管中表达的一种糖基化多肽因子,在气道重塑中发挥重要作用,可通过IL-13依赖和非依赖机制诱导黏液化生[28]。在呼吸道中,香烟烟雾(CS)可诱导表皮生长因子(EGF)的受体EGFR活化,从而导致GCM和凝胶形成黏蛋白MUC5AC的过表达[29]。
KEGG富集得到的通路主要是TNF信号通路、IL-17信号通路、EGFR酪氨酸酶抑制剂抵抗、PI3K-AKT信号通路、HIF-1信号通路、MAPK信号通路等。TNF-α能上调气道上皮细胞EGFR的表达而直接刺激黏蛋白合成,也可通过影响核因子 -κB核使MUC基因表达增加,从而使黏液合成增多[30-31];EGFR酪氨酸酶抑制剂抵抗路径可通过激活下游PI3K-AKT、MAPK信号通路来促进细胞的增殖或分化,EGFR的表达和活化与气道上皮杯状细胞增生、黏液产生正相关[32];在激活IL-17通路后最终也会促进MUC5AC、MUC5B基因表达,引起气道黏液高分泌[33]。PI3-KAkt通路的激活可干扰p38MAPK而下调MUC基因转录,抑制PI3K/Akt信号通路能够有效降低MUC5AC蛋白的表达[21];HIF-1是多种炎症反应输入的一种中心调控递质,可作为顺式激活调控因子启动小鼠MUC5AC的活性[34],而香烟烟雾能上调HIF-1α的活性,并通过EGFR介导的信号传导途径诱导MUC5AC的表达进而刺激黏液分泌[35],临床研究证明HIF-1α在COPD的患者中过表达,其激活不仅可引起下游EGFR/PI3K/AKT途径上调炎症介质的表达,又可通过负反馈作用上调自身HIF-1α的表达,加剧COPD的病理变化,影响气道黏液高分泌[36];钟云青等[37]通过临床患者支气管活检数据证明,p-p38MAPK免疫阳性在稳定的COPD患者中显著增加,提示p-p38MAPK的激活可能在COPD支气管炎症反应的诱导中起重要作用,而MAPK途径亦可通过配体依赖的方式来诱导MUC的合成。使用分子对接对最终筛选的小分子与蛋白之间的关系进行验证,并进一步打分以评估其相互作用强度大小,分值>5.0表明有较好的结合活性,分值>7.0表明具有强烈的结合活性,AKT1、IL-6、CASP3、VEGFA、EGF这5个核心靶点蛋白对应亲和力数值最高的成分包括quercetin、acacetin、luteolin、beta-sitosterol对应结合能分别为-8.2 kcal/mol、-6.7 kcal/mol、-9.2 kcal/mol、-5.5 kcal/mol、-7.4 kcal/mol,提示主要靶标蛋白与清肺化痰方关键活性成分结合性均较好,表明清肺化痰方能直接改善AECOPD气道黏液高分泌。
综上所述,本研究研究了清肺化痰方的主要活性成分,借助网络药理学的方法分析并阐述了其改善AECOPD氣道黏液高分泌的重要靶标以及相关通路,同时结合分子对接进一步验证了清肺化痰方的主要活性分子能较好与关键作用靶点发生相互作用,揭示了清肺化痰方改善AECOPD气道黏液高分泌的可能机制,为后续深入验证和探究清肺化痰方改善AECOPD气道黏液高分泌的分子机制提供了基础。
参考文献
[1]Wang C,Xu J,Yang L,et al.Prevalence and risk factors of chronic obstructive pulmonary disease in China(the China Pulmonary Health[CPH]study):a national cross-sectional study[J].Lancet,2018,391(10131):1706-1717.
[2]Global Initiative for Chronic Obstructive Lung Disease.Global Strategy for the Diagnosis,Management and Prevention of Chronic Obstructive Pulmonary Disease(2020 Report)[R/OL].(2019-11-05)[2021-02-28].https://goldcopd.org/gold-reports/.
[3]安亚娟,何海浪,虞蓓蓓,等.探析风药在慢性阻塞性肺疾病急性加重期中的应用[J].中国中医急症,2018,27(12):2162-2164.
[4]胡小梅,赵擘,刘建媛,等.化痰行瘀通腑汤保留灌肠治疗慢性阻塞性肺疾病急性加重期临床疗效及对肺功能和炎症因子的影响[J].河北中医,2019,41(6):844-848,854.
[5]邹鹏,蔡海荣,袁康,等.慢性阻塞性肺疾病急性加重期中医证型与客观指标的相关性研究[J].中国中医急症,2018,27(10):1801-1804.
[6]陈善夫,封继宏,魏葆琳.清热化痰法治疗慢性阻塞性肺疾病急性加重痰热郁(蕴)肺证研究进展[J].吉林中医药,2015,36(12):1295-1298.
[7]王虹,王余民.清肺活血化痰方治疗痰瘀互结型慢性阻塞性肺疾病急性加重期临床观察[J].河北中医,2019,41(11):1637-1642.
[8]Sanner M F.Python:A programming language for software integration and development[J].J Mol Graph Model,1999,17(1):57-61.
[9]Garrett M.Morris,Ruth Huey,William Lindstrom,et al.AutoDock4 and AutoDockTools4:Automated docking with selective receptor flexibility[J].J Comput Chem,2009,30(16):2785-2791.
[10]Oleg Trott,Arthur J Olson.AutoDock Vina:improving the speed and accuracy of docking with a new scoring function,efficient optimization,and multithreading[J].J Comput Chem,2010,31(2):455-461.
[11]Rose MC,Voynow JA.Respiratory tract mucin genes and mucin glycoproteins in health and disease[J].Physiol Rev,2006,86(1):245-78.
[12]Vogelmeier CF,Román-Rodríguez M,Singh D,et al.Goals of COPD treatment:Focus on symptoms and exacerbations[J].Respir Med,2020,166:105938.
[13]许光兰,徐长青.加味苇茎汤治疗AECOPD(痰热壅肺型)30例临床疗效观察[J].内蒙古中医药,2014,33(14):12-13.
[14]袁乐东,黎林盛,蒙斌.苇茎汤加减治疗慢性阻塞性肺疾病急性加重期患者临床疗效及其对TNFα、IL-8的影响[J].哈尔滨医药,2017,37(2):177-178.
[15]徐贵华,史苗颜,张炜,等.复方龙星片联合西医常规治疗慢性阻塞性肺疾病稳定期痰热蕴肺证临床研究[J].中国中医药信息杂志,2018,25(5):23-26.
[16]李杰,王琦,张立山,等.清热化痰法对慢性阻塞性肺疾病急性加重期痰热证大鼠气道黏液高分泌的影响[J].北京中医药大学学报,2015,38(9):601-605.
[17]朱汉平,刘小虹,王鹏,等.清肺理痰方治疗痰热夹瘀型慢性阻塞性肺疾病急性加重期临床研究[J].河北中医,2019,41(8):1167-1171.
[18]王风秀,张廷明,丁长玲.清肺化浊汤辅助治疗急性加重期慢性阻塞性肺疾病(痰热壅肺证)50例[J].中国实验方剂学杂志,2015,21(3):187-190.
[19]蒋晨露,刘克琴.清金化痰汤对慢性阻塞性肺疾病患者气道炎症反应和黏液高分泌的影响[J].吉林中医药,2019,39(12):1605-1608.
[20]Coffer PJ,Jin J,Woodgett JR.Protein kinase B(c-Akt):a multifunctional mediator of phosphatidylinositol 3-kinase activation[J].Biochem J,1998,335(Pt 1):1-13.
[21]王璨丽.PM2.5致人支气管上皮细胞MUC5AC高分泌的机制研究[J].世界最新医学信息文摘(连续型电子期刊),2019,19(98):281-284.
[22]Wei Y,Wang S,Wang D,et al.Expression and clinical significance of serum amyloid A and interleukin-6 in patients with acute exacerbation of chronic obstructive pulmonary disease[J].Exp Ther Med,2020,19(3):2089-2094.
[23]Huan W,Tianzhu Z,Yu L,et al.Effects of Ergosterol on COPD in Mice via JAK3/STAT3/NF-κB Pathway[J].Inflammation,2017,40(3):884-893.
[24]Chen Y,Thai P,Zhao YH,et al.Stimulation of airway mucin gene expression by interleukin(IL)-17 through IL-6 paracrine/autocrine loop[J].J Biol Chem,2003,278(19):17036-17043.
[25]付潇潇,韩校鹏,刘剑波.气道黏液高分泌对慢性阻塞性肺疾病急性加重期患者预后及炎症因子的影响[J].中国临床研究,2019,32(3):321-323.
[26]毛梦迪,尚立芝,徐莉莉,等.二陈汤加味对慢阻肺大鼠Th1/2/9细胞相关淋巴因子及IL-4R1/IL-13RA1的调节作用[J].中国实验方剂学杂志,2020,26(20):16-24.
[27]王晶,李亚,李建生,等.调补肺肾系列方药对PM2.5致肺损伤大鼠炎症和氧化应激的影响[J].中医杂志,2019,60(5):415-421.
[28]Lee CG,Ma B,Takyar S,et al.Studies of vascular endothelial growth factor in asthma and chronic obstructive pulmonary disease[J].Proc Am Thorac Soc,2011,8(6):512-515.
[29]Kato K,Chang EH,Chen Y,et al.MUC1 contributes to goblet cell metaplasia and MUC5AC expression in response to cigarette smoke in vivo[J].Am J Physiol Lung Cell Mol Physiol,2020,319(1):L82-L90.
[30]Barnes PJ.The cytokine network in chronic obstructive pulmonary disease[J].Am J Respir Cell Mol Biol,2009,41(6):631-638.
[31]Lai H,Rogers DF.New pharmacotherapy for airway mucus hypersecretion in asthma and COPD:targeting intracellular signaling pathways[J].J Aerosol Med Pulm Drug Deliv,2010,23(4):219-231.
[32]Takeyama K,Tamaoki J,Kondo M,et al.Role of epidermal growth factor receptor in maintaining airway goblet cell hyperplasia in rats sensitized to allergen[J].Clin Exp Allergy,2008,38(5):857-865.
[33]Fujisawa T,Chang MM,Velichko S,et al.NF-κB mediates IL-1β-and IL-17A-induced MUC5B expression in airway epithelial cells[J].Am J Respir Cell Mol Biol,2011,45(2):246-252.
[34]Evans CM,Koo JS.Airway mucus:the good,the bad,the sticky[J].Pharmacol Ther,2009,121(3):332-348.
[35]Yu H,Li Q,Kolosov VP,et al.Regulation of cigarette smoke-mediated mucin expression by hypoxia-inducible factor-1α via epidermal growth factor receptor-mediated signaling pathways[J].J Appl Toxicol,2012,32(4):282-292.
[36]Zhang HX,Yang JJ,Zhang SA,et al.HIF-1α promotes inflammatory response of chronic obstructive pulmonary disease by activating EGFR/PI3K/AKT pathway[J].Eur Rev Med Pharmacol Sci,2018,22(18):6077-6084.
[37]鐘云青,王秀峰,刘春光.COPD气道粘液高分泌分子机制研究进展[J].临床肺科杂志,2014,19(6):1094-1095.
(2020-07-21收稿 责任编辑:魏庆双,徐颖)

