发光杆菌产几丁质酶的工艺优化
陈立功,吴家葳,张 冉,张庆芳,迟乃玉,王晓辉,*
(1.大连大学生命科学与技术学院,辽宁大连116600;2.辽宁省海洋微生物工程技术研究中心,辽宁大连116600)
几丁质(chitin)又称甲壳质、壳多糖,为天然生物聚合物,是海洋中含量最丰富的可再生资源,每年形成量超过1011吨[1-3]。海洋几丁质主要通过海洋低温微生物分泌的低温几丁质酶完成降解,参与海洋物质循环[4]。几丁质广泛存在于动植物及微生物中,在虾蟹壳中的含量极高,主要起支撑和保护作用[5-7]。几丁质水解后生成的几丁寡糖、几丁单糖及其衍生物,具有良好的组织兼容性及免疫抗菌作用,具有重要应用价值[8-10]。粉状晶体几丁质为白色或淡黄色固体,性质稳定,不溶于水,自然状态下不易降解。每年有超过8万吨几丁质被视为废物丢弃,既污染了环境,又造成了资源浪费[11-13]。
几丁质酶(chitinase,EC 3.2.1.14)是专一降解几丁质的一类糖苷水解酶的总称,能够完成几丁质到几丁寡糖及几丁单糖的转化[14-15]。几丁质酶通过对几丁质的降解作用,可对病原真菌及昆虫的生长造成有效的抑制和杀伤[16-18]。目前对几丁质酶的研究,大多集中在微生物来源的几丁质酶上,包括假单胞菌、链霉菌和芽孢杆菌等[19-20]。已研究的几丁质酶主要集中于中高温几丁质酶,随着几丁质酶在生产生活中的应用,人们发现中高温几丁质酶虽然高温下降解效率较高,但稳定性差,且高温的降解条件对设备要求较高,增加了生产成本,已经不能满足工业化生产的需要[21-22]。低温酶在较低温度下有较高的降解效率且稳定性高,发现、发掘、开发低温几丁质酶日渐成为研究热点[23]。目前低温几丁质酶的主要来源为低温微生物(cold-adapted microorganism),根据其生长繁殖温度可分为嗜冷菌(psychrophile)和耐冷菌(psychrotroph),0℃是否能生长繁殖,最适生长温度是否低于15℃是二者划分的主要依据,嗜冷菌比耐冷菌更耐寒[24]。
海洋中有丰富的微生物资源未被开发利用,其天然的低温环境和平均含盐量3.5%的高盐环境,是低温微生物的天堂,其内生活的微生物大多具有嗜冷或耐冷特性,并对高盐环境具有一定的耐受性[15-26]。海洋微生物所产生的酶,往往在低温下仍具有较高催化效率[27]。为满足工业生产需求,解决几丁质酶在低温下降解效率不高的问题,越来越多的学者聚焦于海洋,期待从海洋筛选到高产低温几丁质酶的菌株,且已发现假单胞菌属(Pseudomonas sp.BK1)和节杆菌属(Arthrobacter sp.TAD20)等多种可产低温几丁质酶的微生物,但酶活力均较低[28-30]。目前,国内外研究中未见发光杆菌属菌株产低温几丁质酶的发酵条件优化的相关报道。
本文从海泥中筛选到高产几丁质酶的发光杆菌,命名为Photobacterium sp.LG-1,前期对其进行了形态学和分子生物学鉴定及单因素发酵条件优化,单因素优化后菌株产几丁质酶活为4.57 U/mL[31]。为了满足几丁质酶工业应用的大量需求,提高几丁质酶的产量,本研究利用Plackett-Burman、Box-Behnken实验对LG-1产低温几丁质酶的发酵条件进行进一步优化,提高几丁质酶的产量及活性。
1 材料与方法
1.1 材料与仪器
发光杆菌(Photobacterium sp.LG-1)筛选自中国辽宁大连渤海海域近海底泥5~100 m(123°391'E,39°6972'N);发酵培养基 胶体几丁质12.0 g/L、酵母膏6.0 g/L,原地海水,自然p H;几丁质 博奥拓达(北京)公司;酵母膏 奥博星(北京)生物公司;琼脂粉 北京索莱宝生物科技有限公司。
LTI-700低温恒温培养箱 上海爱朗仪器有限公司;CRY-2112恒温摇床 上海茸研仪器有限公司;Thermo Multiskan1510酶标仪 芬兰Labsystems公司。
1.2 实验方法
1.2.1 胶体几丁质制备 根据王晓辉等[16]的方法进行1%胶体几丁质的制备:取10 g几丁质置于研钵,缓慢加入100 mL浓盐酸并不断搅拌1 h,保鲜膜封口后于冰箱4℃下过夜。大量超纯水反复洗至中性,离心后用0.1 moL/L磷酸缓冲液定容为1 L。
1.2.2 酶活测定 取0.5 mL 1%胶体几丁质与0.5 mL粗酶液混合,25℃下水浴保温15 min,10000 r/min离心5 min,取上清200μL煮沸5 min,冷却后,加入200μL DNS溶液煮沸5 min,冷却后加入600μL超纯水,10000 r/min离心10 min,取200μL于96空板中测定OD520,三组平行实验。酶活单位定义(U):在上述条件下,催化产生lμmol N-乙酰-D-氨基葡萄糖所需的酶量。
1.2.3 菌悬液的制备及产酶发酵工艺 挑取单菌落至5 mL发酵培养基,15℃220 r/min摇床振荡培养至OD6000.5~0.6,作为发酵优化实验种子液。种子液接种至发酵培养基,培养96 h,将发酵液6000 r/min离心去沉淀,得粗酶液,测定酶活性。
1.2.4 Plackett-Burman实验 为确定影响菌株LG-1几丁质酶活的三个主要因素,根据前期单因素优化结果:胶体几丁质12.0 g/L、酵母膏6.0 g/L、发酵温度15℃、初始p H7.0、转速为220 r/min、装液量75 mL/250 mL、接种量1%、发酵时间96 h,以软件Minitab 15对胶体几丁质浓度、酵母膏浓度、转速、发酵温度、装液量、接种量(种子液菌体浓度OD6000.5~0.6)、初始p H、发酵时间8个因素设计N=12的8因素2水平Placket-Burman实验。3组平行试验。各因素对应因子代码如表1所示。

表1 Plackett-Burman实验设计各因素水平及分析Table 1 Levels of the variables and statistical analysis of Plackett-Burman design
1.2.5 最陡爬坡实验 以三个影响酶活的主要因素设计最陡爬坡实验,以实验值变化的梯度方向为爬坡方向,3组平行试验。
1.2.6 Box-Behnken实验设计 根据Plackett-Burman实验及最陡爬坡实验结果,以软件Minitab 15设计N=17的3因素3水平的Box-Behnken实验,自变量为发酵温度X1、发酵时间X2、酵母膏X3。3组平行试验并进行数据分析,如表2所示。
1.3 数据处理
运用Minitab 15软件通过响应面分析法对实验结果进行优化分析,得到最优结果后,运用Minitab 15软件对预测值进行验证。所有实验均重复三次。
2 结果与分析
2.1 发酵实验的Plackett-Burman设计
根据表1影响酶活的各因素及水平,利用Minitab 15软件设计N=12的P-B实验,发酵后离心发酵液,取上清进行酶活检测。3组平行实验,结果如表3所示。
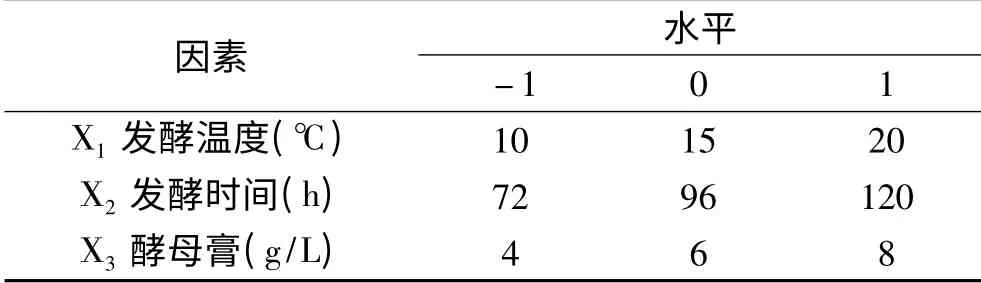
表2 响应面试验因素水平表Table 2 Factors and levels of response surface methodology
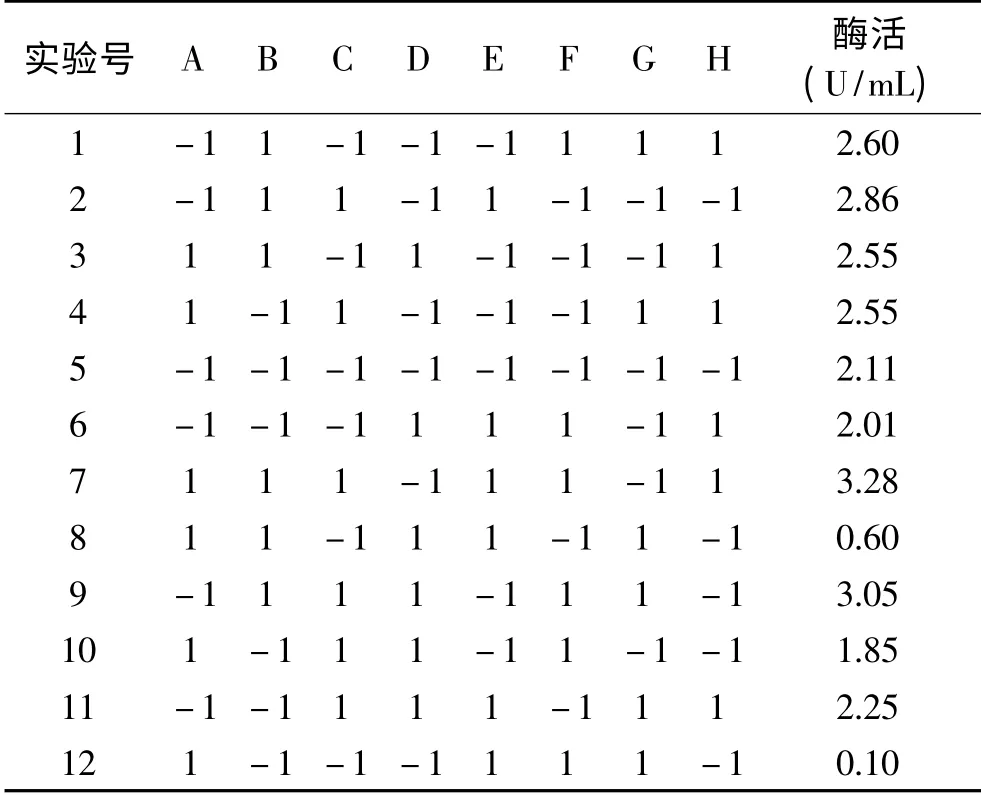
表3 Plackett-Burman实验设计及结果Table 3 Experimental design and result of Plackett-Burman influencing
P-B实验结果(表4)显示,P值<0.05的因素有胶体几丁质、酵母膏、发酵温度、装液量、接种量及发酵时间,以上因素对菌株LG-1产几丁质酶活性的影响均>95%,达到显著水平。其它影响因素选值为单因素实验优化结果。其中发酵温度、发酵时间和酵母膏添加量三个因素影响效果最为显著。因此以这三个因素进行响应面试验。
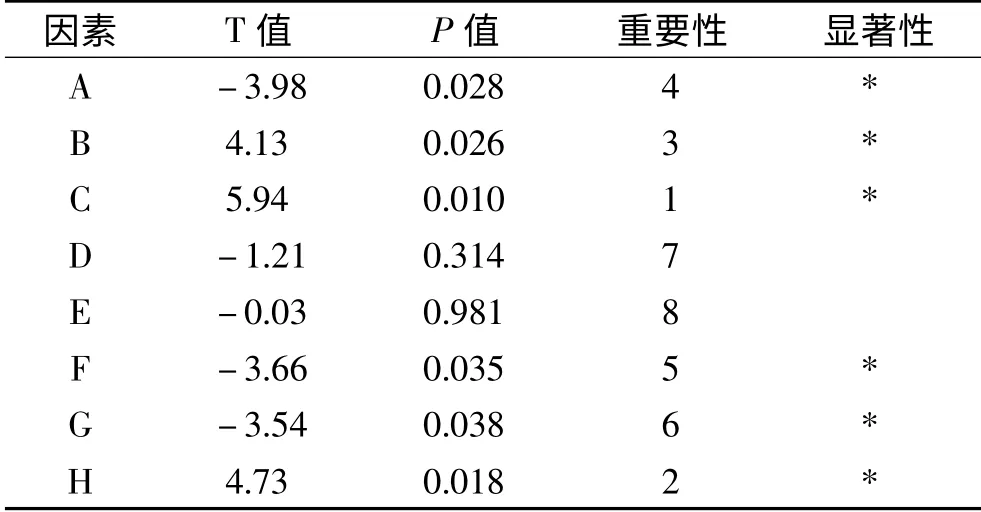
表4 P-B实验设计各因素主效应分析结果Table 4 Results of the variables and effect in P-B design
2.2 最陡爬坡试验
由最陡爬坡实验确定中心点结果(表5)可知,3组平行实验得到最佳因子组为第2组。最佳因子组条件为:发酵温度(X1)15℃,发酵时间(X2)96 h,酵母膏添加量(X3)6 g/L。
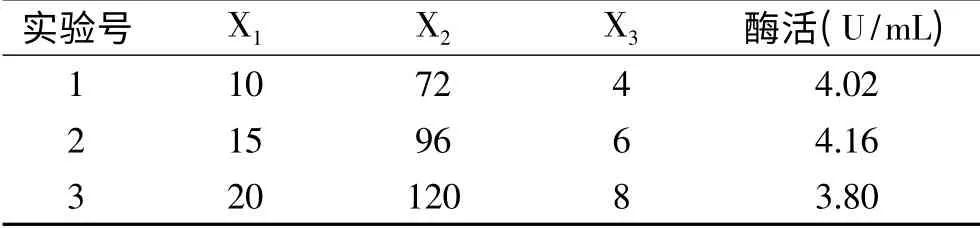
表5 最陡爬坡实验设计及结果Table 5 Experimental design and result of steepest ascent
2.3 响应面实验优化培养条件
2.3.1 Box-Behnken实验 根据最陡爬坡实验结果,以X1(发酵温度)、X2(发酵时间)、X3(酵母膏)为自变量设计N=17的3因素3水平的Box-Behnken实验。3组平行实验结果如表6所示。
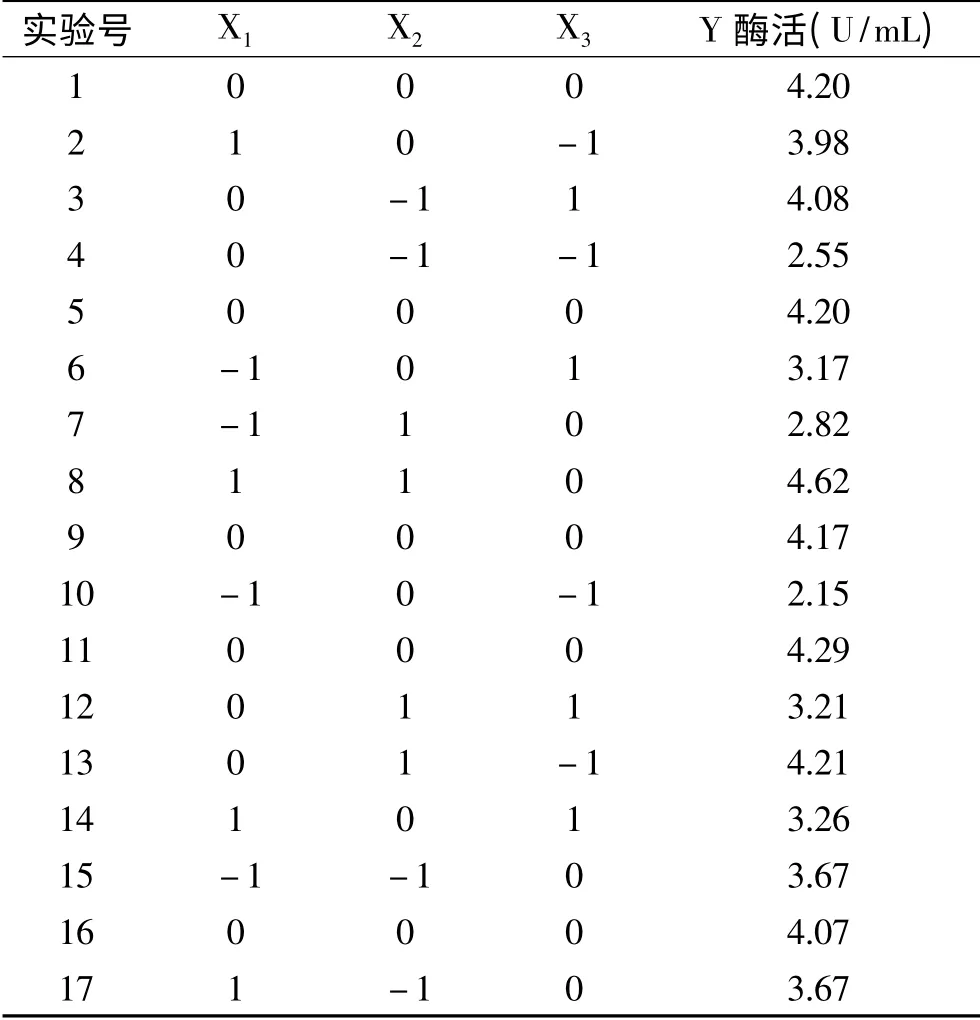
表6 Box-Behnken设计及结果Table 6 Design and results of Box-Behnken design
2.3.2 回归方程的建立及其显著性 Box-Behnken实验结果经Minitab 15软件进行分析确定影响菌株LG-1产低温几丁质酶活性的二次回归方程:Y=4.19+0.46X1+0.11X2+0.10X3+0.45X1X2-0.44X1X3
该方程进行回归系数显著性检测和方差分析结果(见表7)显示,该回归模型的P值<0.01,而失拟项的P值>0.05,证明模型建立成功。其自变量X2,X3对响应值的影响显著(P<0.05),自变量X1、对响应值影响极显著(P<影响不显著(P>0.05)。回归系数R2=98.85%大于90%,校正决定系数表明模型相关度很好。此模型可用来分析和预测实验结果。
2.3.3 响应面分析及最优条件确定 根据二次多项式模型利用Minitab 15软件绘出响应面分析图(图1~图3)。由响应面图可以看出:发酵温度X1、发酵时间X2、酵母膏X3三个因素两两之间存在交互作用。当发酵温度X1、发酵时间X2、酵母膏X3分别为20℃,120 h,4.42 g/L时达到最佳,几丁质酶活的理论值为5.10 U/mL。
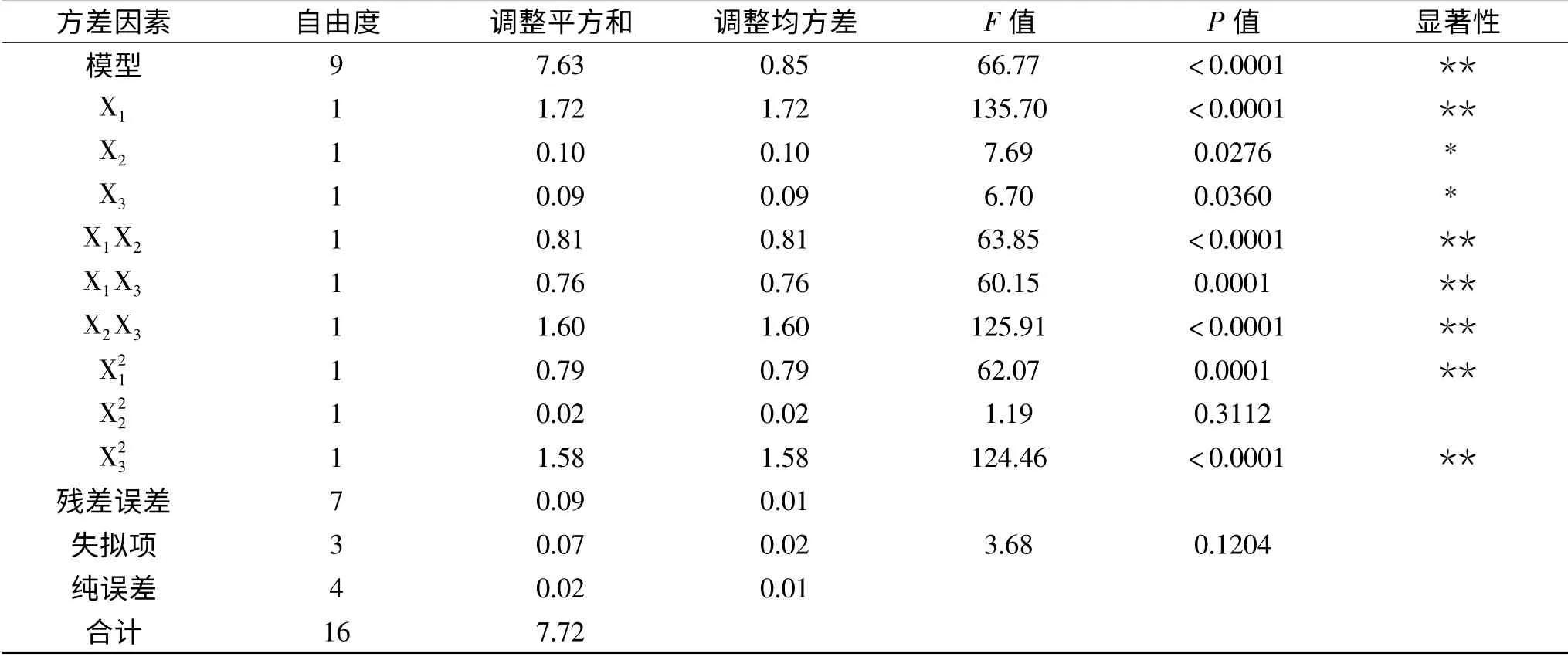
表7 回归方程方差分析Table 7 Variance analysis of the quadratic model
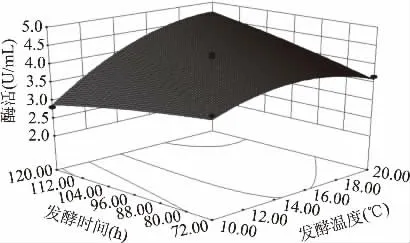
图1 发酵温度与发酵时间对酶活的交互影响Fig.1 Response surface plot of the effects of fermentation temperature and fermentation time on the enzyme activity
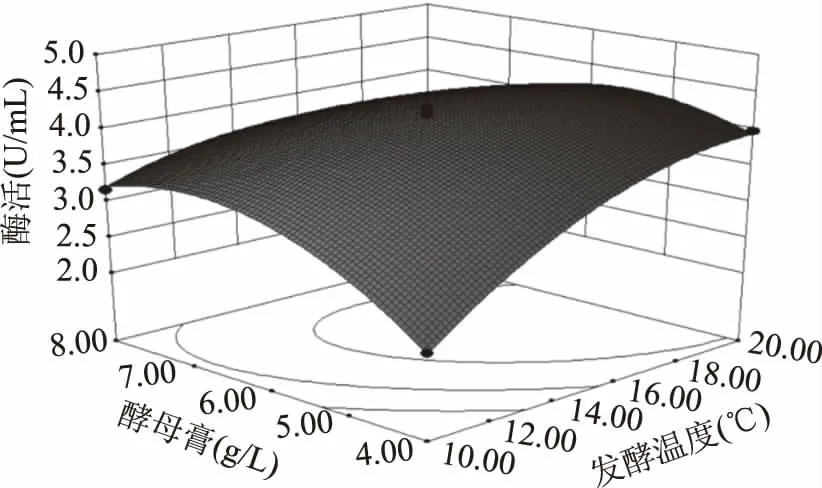
图2 发酵温度与酵母膏对酶活的交互影响Fig.2 Response surface plot of the effects of fermentation temperature andyeast extract on the enzyme activity
在考虑到实际实验操作的基础上,对模型的准确性进行验证,将软件分析得出的最佳发酵条件进行调整:胶体几丁质浓度12.0 g/L、酵母膏浓度4.5 g/L、发酵温度20℃、初始p H7.0、转速为220 r/min、装液量75 mL/250 mL、接种量1%、发酵时间120 h,3次平行实验所得几丁质酶的平均酶活为5.10 U/mL,与理论值相同,表明响应面法所得结果准确可靠。与优化前酶活4.57 U/mL相比,响应面优化后的酶活提高了11.50%。
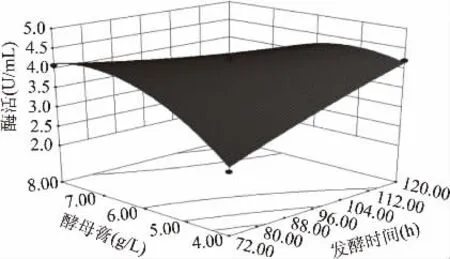
图3 发酵时间与酵母膏对酶活的交互影响Fig.3 Response surface plot of the effects of fermentation timeandyeast extract on the enzyme activity
3 结论与讨论
根据嗜冷菌和耐冷菌的划分依据[24],发光杆菌Photobacterium sp.LG-1最适生长产酶温度为20℃,高于15℃,初步判断菌株LG-1为耐冷菌。本研究在前期单因素优化的基础上对菌株LG-1的发酵产酶条件进行了响应面优化,完成了发酵产酶条件的系统性优化过程。确定了发酵温度、发酵时间和酵母膏是影响菌株Photobacterium sp.LG-1产酶的重要因素。最陡爬坡实验及响应面实验联合优化,确定了三个最显著影响因素的最佳培养条件为发酵温度20℃、发酵时间120 h和酵母膏浓度4.42 g/L。根据实际情况,调整后的菌株产几丁质酶最佳条件为:胶体几丁质浓度12.0 g/L、酵母膏浓度4.5 g/L、发酵温度20℃、初始p H7.0、转速为220 r/min、装液量75 mL/250 mL、接种量1%、发酵时间120 h。此最优发酵条件下,菌株产几丁质酶活力达5.10 U/mL,较优化前酶活4.57 U/mL提高了11.50%。本研究为菌株LG-1发酵产酶提供了更好的条件,利于实验中高产量、高活性几丁质酶的获取,为低温几丁质酶的降解机制研究和产业化应用提供了有力支撑。

