甜瓣子发酵过程细菌菌群与发酵过程的对应关系分析
张小凤,胡涛,于松峰,夏梦雷,郑宇,*,石磊,万守朋*,王敏
(1.食品营养与安全国家重点实验室,天津市微生物代谢与发酵过程控制技术工程中心,天津科技大学生物工程学院,天津 300457;2.天津市利民调料有限公司,天津 300308)
豆瓣辣椒酱味美色艳又营养丰富,是川菜烹调中必不可少的调味品,以蚕豆、辣椒、盐、小麦粉为主要原料[1]。其中,甜瓣子是豆瓣辣椒酱的重要组成,是以蚕豆为原料,浸泡蒸煮后拌以小麦粉并接种米曲霉(Aspergillus oryzae)后进行制曲,随后拌以食盐进行3~6个月的甜瓣子发酵[2-4]。甜瓣子的品质是决定豆瓣辣椒酱品质的关键,甜瓣子在自然发酵过程中受到发酵条件、微生物组成等多种因素的影响[5]。甜瓣子发酵过程中参与的微生物种类众多,主要有霉菌、酵母菌、乳酸菌、芽孢杆菌等微生物,在蛋白酶、淀粉酶等酶系作用下将原料中大分子物质分解,并代谢产生多肽、氨基酸、有机酸和各种挥发性风味物质[5-7]。有报道采用传统分离方法和现代分子生物学相结合的手段从中分离出8个属的微生物菌群,其中细菌主要为Bacillus属、Lactobacillus属、Weissella属、Staphylococcus属,优势细菌芽孢杆菌在发酵体系中具有丰富的类群,主要包括枯草芽孢杆菌(B.subtili)、解淀粉芽孢杆菌(B.amyloliquefacuens)、地衣芽孢杆菌(Bacillus licheniformis)和甲基营养型芽孢杆菌(B.methylotrophicus)等;真菌主要为 Aspergillus属、Lichtheimia 属、Zygosaccharomyces属、Yarrowia属,发酵过程中细菌浓度高于真菌[8]。微生物组成、盐度和发酵模式等因素对产品品质有很大影响,利用高效乳酸菌和米曲霉强化甜瓣子发酵,提高了甜瓣子风味物质含量,使终产品质量有明显提升[9-10]。盐度对甜瓣子中总酸、氨基酸态氮和还原糖等成分有着显著影响,12%盐度下发酵甜瓣子感官品质最佳,另外,采用先低盐后高盐、先低温后高温的分段发酵模式进行甜瓣子发酵,可使产品品质有明显提高[11]。
以往研究更多关注甜瓣子发酵微生物组成,采用传统培养、非传统培养及高通量测序的方法研究了不同酱类的细菌群落演替规律及风味物质组成[12-18],但对甜瓣子发酵过程中微生物群落演替及其与发酵条件之间的关系认识不够深入。本研究利用高通量测序技术解析豆瓣辣椒酱甜瓣子发酵过程中细菌群落与发酵过程的对应关系,挖掘甜瓣子发酵过程中核心功能性微生物,可以为传统甜瓣子发酵过程和品质管理提供理论依据,从而进一步保障豆瓣辣椒酱品质。
1 材料与方法
1.1 材料与试剂
采集生产车间蚕豆曲发酵 0、7、60、120、240 d 的样品,样品依次标记为T1~T5。自发酵池表面30 cm处五点法取样,混匀后装入无菌瓶中,放入冰盒中立即送往实验室保存于4℃。每个发酵时间样品取自3个发酵池,作为平行样品。
DuGreen 核酸染料、6×DNA Loading dye:宝日医生物工程(大连)有限公司;深加工食品DNA提取试剂盒:天根生化科技(北京)有限公司。
1.2 仪器与设备
微量紫外分光光度计(UVmini-1240):日本岛津仪器有限公司;聚合酶链式反应(polymerase chain reaction,PCR)仪(5331):德国 Eppendorf公司;凝胶成像仪(Gel Doc XR+):美国BioRad公司;气-质联用分析仪 (gas chromatography-mass spectroscopy,GC-MS)[6890N-5973,配有电喷雾离子源(electrospray ion source,ESI Source) 及 NIST(national institute of standards and technology)谱库]:美国安捷伦公司。
1.3 方法
1.3.1 蚕豆曲发酵过程主要参数分析
称取约5.0 g已研磨均匀的样品置于100 mL小烧杯中,加去离子水搅拌均匀后定容至100 mL,备用。参照GB/T 5009.39—2003《酱油卫生标准的分析方法》中相应的规定对不同发酵阶段样品中的总酸、氨基酸态氮、pH值、盐度、还原糖和水分进行测定,采用DNS法测定样品中的还原糖含量[19]。
1.3.2 蚕豆曲发酵过程中细菌群落组成分析
样品预处理:取蚕豆曲发酵样品10.0 g,放入50 mL的无菌离心管中,加入一定量的磷酸盐缓冲液(phosphate buffer saline,PBS)无菌水,漩涡振荡后,8 000 r/min 离心10 min,弃上清液,用PBS洗涤沉淀,8 000 r/min离心15 min,弃上清液,收集菌体[20]。采用深加工食品DNA提取试剂盒按照说明书流程提取蚕豆曲发酵样品基因组。
将细菌基因组,送金唯智基因公司测序,选择相对丰度大于1%的主要微生物进行分析,利用SILVA 123数据库对测序结果进行比对分析,选择同源性最高的菌种属来解析微生物群落组成。根据测序与比对分析结果,计算微生物的多样性指数,物种优势度-Berger-Parker(d)、物种丰富度-Margalef(dMa)、物种多样性-Simpson(D)、群落多样性-Shannon(H′)、群落的均匀程度-Pielou(Je)。
1.4 发酵条件与主要功能微生物之间的对应关系分析
本研究分别采用典范对应分析(canonical correspondence analysis,CCA)和 Person相关性检验,以发酵参数(pH值、总酸、氨基酸态氮、还原糖、盐度、水分)为环境变量,研究微生物与环境因素之间的对应关系。
2 结果与分析
2.1 甜瓣子发酵过程主要理化参数变化规律
甜瓣子发酵过程中pH值、总酸、氨基酸态氮、还原糖、盐度和水分的发酵过程曲线如图1所示。

图1 甜瓣子发酵过程曲线Fig.1 The time curves of Tianbanzi fermentation
甜瓣子的品质影响着最终豆瓣辣椒酱的品质的优劣。氨基酸态氮是是衡量营养价值的一项重要指标,也影响甜瓣子发酵品质的一个重要参数[21]。如图1所示,由于蚕豆中蛋白质等物质的水解,在甜瓣子发酵过程中其含量快速增加,随后呈下降趋势。在发酵前期蛋白质会降解成多肽、氨基酸等物质,在发酵中期和后期这些多肽和氨基酸与糖类等其它物质发生复杂的生化反应,从而形成各种风味物质。在此期间淀粉类物质也会分解成小分子糖类等。还原糖等糖类物质不仅是发酵过程微生物生长所需的碳源,也对蚕豆曲发酵及产品的色香味有重要影响。还原糖在发酵60 d时含量达到最高为(1.312±0.022)g/100 g,其后略有下降。总酸是甜瓣子发酵过程中一个重要指标,适度的酸度,能增加产品风味,产生爽口的感觉[22],随着发酵的进行,总酸的含量逐渐增加。发酵过程中乳酸菌等微生物可以发酵蚕豆曲中碳水化合物、脂肪等,产生乳酸、乙酸等小分子有机酸,使得总酸增加和pH值下降[23]。食盐是生产豆瓣酱的重要原料之一,能与氨基酸共同呈鲜味,并且较高浓度的食盐可以在一定程度上减少杂菌的污染,维持某些耐盐菌的生长环境,并增加产品的风味[5,11,18]。从图 1 可以看出,成曲食盐含量为(0.740 0±0.320 5)g/100 g,加入盐水后保持在 11 g/100 g~13 g/100 g。图1中还原糖、水分等部分指标在发酵中后期误差较大,其原因主要是由于甜瓣子采用自然发酵工艺,不同发酵池的3个平行样品之间的误差偏大,这也是许多传统发酵食品生产中存在的普遍现象。
2.2 发酵过程细菌群落分析
甜瓣子发酵过程细菌菌群组成分析结果如图2所示。

图2 甜瓣子发酵过程中细菌群落组成分析Fig.2 Composition of bacterial community during Tianbanzi fermentation
发酵初期(0 d)细菌相对浓度较高。乳酸菌是主要的微生物,主要有 La.plantarum、W.viridescens、W.diestrammenae、Le.citreum、La.siliginis等,其相对丰度分别达到10.35%、8.91%、4.99%、7.35%和10.65%。La.acidifarinae和T.halophilus同样在发酵初期就存在,但随着发酵的进行,其相对丰度呈先升高后降低的趋势,且在发酵中期(60 d)时达到最高分别为12.79%和10.03%。E.faecium是到发酵中期(60 d)时才出现,其丰度随后呈降低趋势。除此之外,甜瓣子发酵过程的优势菌还有 B.ginsengihumi、B.amyloliquefaciens、B.atrophaeus、A.lipolyticus等,这些细菌一直伴随于甜瓣子整个发酵过程中,并且具有较高的丰度。在发酵初期,细菌的浓度和种类较多,随着盐水的加入(图1),多数细菌不适应此类高盐条件而死亡,同时发酵过程酸度逐渐增加,因此发酵后期细菌的浓度低于发酵初期,此结果与他人报道的结果一致[11,13,24]。细菌群落组成多样性分析见图3。
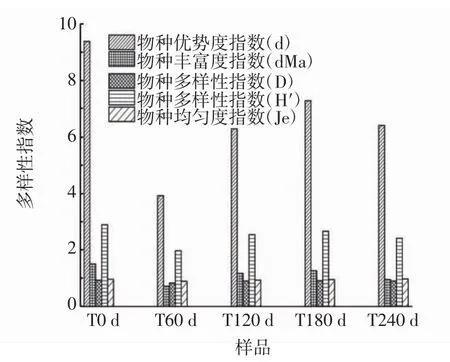
图3 细菌群落组成多样性分析Fig.3 Diversity analysis of bacterial community
进一步,对甜瓣子发酵过程细菌群落多样性进行了分析,由图3可知,物种优势度指数(d)和物种丰富度指数(dMa)在发酵过程中呈先降低后升高的趋势。物种多样性指数(H′)和物种丰富度指数(dMa)变化趋势相同,甜瓣子发酵过程中主要为乳酸菌和芽孢杆菌属,其种类和数量先减少后增加,物种多样性指数(H′)和丰富度指数(dMa)先降低后升高。成曲(发酵0 d)的物种多样性指数(D)最高,这与成曲所在的环境有关,而物种均匀度指数(Je)在发酵过程差异不大。
2.3 甜瓣子发酵过程主要细菌演替机制分析
传统发酵食品生产多以经验为主,然而发酵过程与复杂的微生物群落结构有很强的相关性。基于最近微生物生态学研究进展的启发,采用典范对应分析(CCA)结合Person相关性检验的方法探讨甜瓣子发酵过程中细菌群落与发酵环境之间的关系。典范对应分析甜瓣子发酵过程与细菌群落组成的关系见图4。
如图4所示,两轴共解释了92.6%的变量,每个参数箭头的长短代表各因素影响的大小。在起始发酵(0 d)时期,pH值与Weissella和Lactobacillus表现出显著的正相关性,但在发酵后期(120、240 d)与Weissella和Lactobacillus负相关。而氨基酸态氮、总酸和还原糖等参数在起始发酵时期与Bacillus、Leuconostoc、Tetragenococcus和Staphylococcus呈负相关,但在发酵后期却与这些微生物呈正相关。盐度和水分与Bacillus、Leuconostoc和Tetragenococcus之间具有较高的相关性,由于Bacillus和Tetragenococcus较强的耐盐能力,存在于整个发酵过程,该结果与其他高盐酱类产品的结果一致[11,25-26]。La.plantarum、La.acidifarinae、Le.citreum、T.halophilus等乳酸菌是发酵过程中优势菌,CCA分析结果表明,还原糖和氨基酸态氮与这些微生物相关性较高。在传统食品发酵过程中,乳酸菌能够产生有机酸、丁二酮和细菌素等,具有抑制致病菌和腐败菌的作用,对产品风味,以及维持产品的色泽等具有重要作用[27-29]。结合甜瓣子发酵过程动态曲线可知,随着发酵的进行,总酸含量升高及pH值下降,T.halophila相对丰度在发酵中期较高,推测其丰度的变化与总酸和pH值变化有关。K.oxytoca、La.plantarum、W.viridescens和B.ginsengihumi等微生物随着发酵时间的增长而有减少的趋势,说明这些微生物在高盐环境下的生长受到抑制。
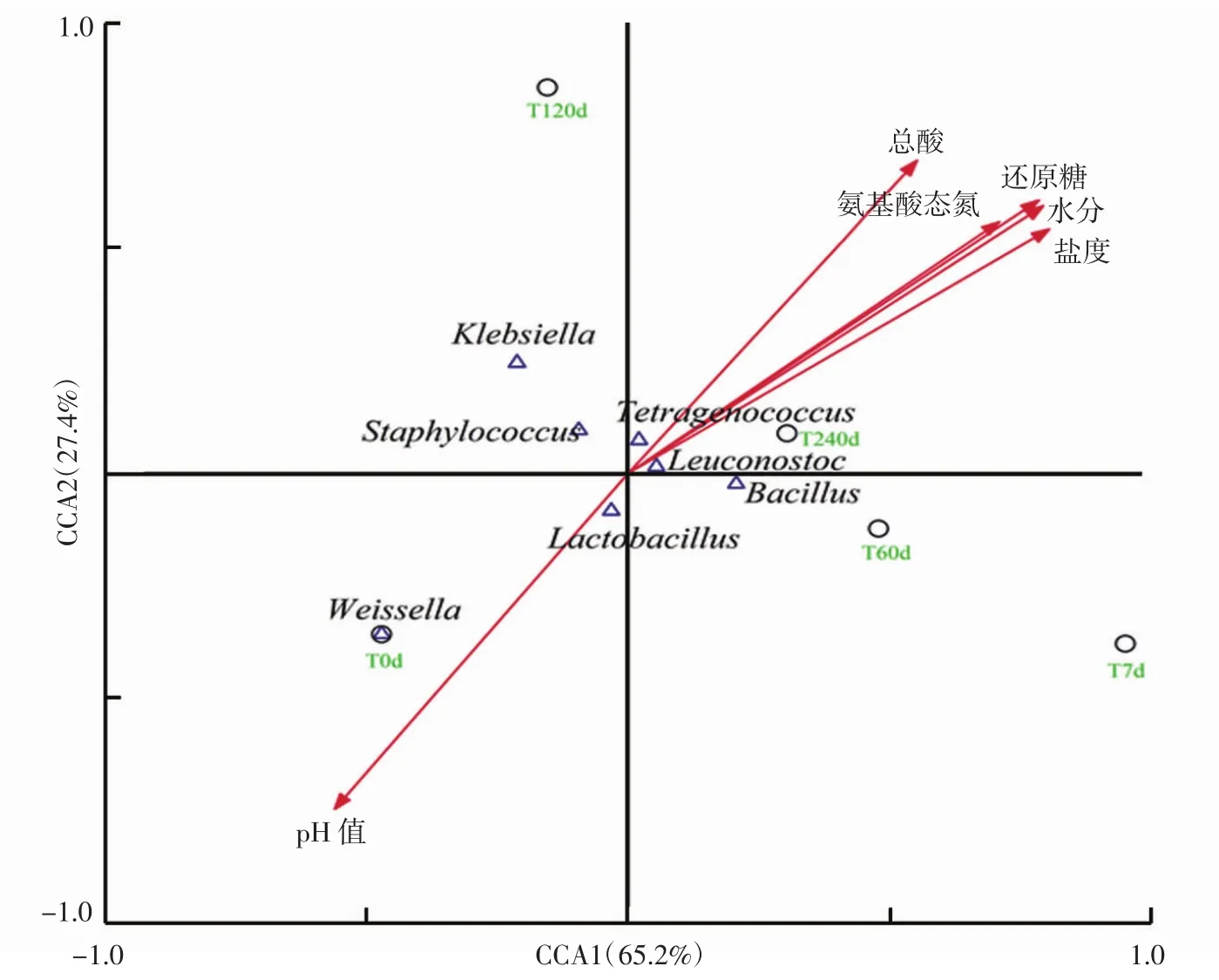
图4 甜瓣子发酵过程与细菌群落组成的典范对应关系分析Fig.4 Canonical correspondence analysis between fermentation process and bacteria compositions of Tianbanzi
甜瓣子发酵过程中主要细菌与发酵环境之间的Person相关性系数见表1。
甜瓣子发酵过程中主要细菌与发酵环境之间的Person相关性系数见表1,Person相关性检验表明,盐度、水分、氨基酸态氮、总酸和还原糖等主要与Leuconostoc、Tetragenococcus、Bacillus、Klebsiella 和 Staphylococcus的相对丰度呈正相关,而与Lactobacillus和Weissella呈负相关,该结果也与CCA分析结果一致(图4)。pH值与微生物之间的相关性表现出与盐度、氨基酸态氮、总酸和还原糖相反的结果。Tetragenococcus是一种耐盐细菌,在其他传统发酵食品也被检测到。在酱油的发酵过程中,Lactobacillus、Tetragenococcus 和Weissella均属于优势菌群,在发酵过程产生有机酸,调节发酵体系的pH值,与总酸增加及pH值的下降相关,并且这些乳酸菌还赋予了产品良好的功能和风味[30]。

表1 甜瓣子发酵过程中主要细菌与发酵环境之间的Person相关性系数Table 1 Pearson′s correlation coefficients between dominant bacterial and fermentation conditions during Tianbanzi fermentation process
3 结论
豆瓣辣椒酱甜瓣子发酵2个月的样品中还原糖及氨基酸态氮含量达到最高,与微生物旺盛的代谢活动有关。乳酸菌以及芽孢杆菌属是豆瓣辣椒酱甜瓣子发酵过程主要的细菌。发酵过程中,pH值、盐度、氨基酸态氮、总酸和还原糖等发酵条件与Lactobacillus、Leuconostoc、Tetragenococcus、Bacillus、Klebsiella 和 Weissella具有较高的相关性,说明这些细菌是发酵过程中的主要功能微生物,它们对发酵过程和产品风味的影响及其作用机制将是今后研究的重点。

