3种酿酒葡萄花色苷及其稳定性研究
于聪,李艳,2*
(1.河北科技大学生物科学与工程学院,河北 石家庄 050018;2.河北省发酵工程技术研究中心,河北 石家庄 050018)
花色苷(anthocyanin)是葡萄果皮中的主要呈色物质,属于类黄酮化合物,表现为蔬菜和水果的红色、紫色和蓝色等鲜艳的色彩[1]。酿酒葡萄中的花色苷是以C6-C3-C6为基本骨架,以糖苷键与糖结合而成的一类黄酮多酚类化合物[2-3],2-苯基苯并吡喃阳离子的多羟基或多甲氧基衍生物,含有2个被含氧杂环(C)分开的苯甲酰环(A、B),花色苷母核结构见图1。花色苷结构上的R1、R2基团有6种组合,可形成具体的花色苷[4-5],见表 1。
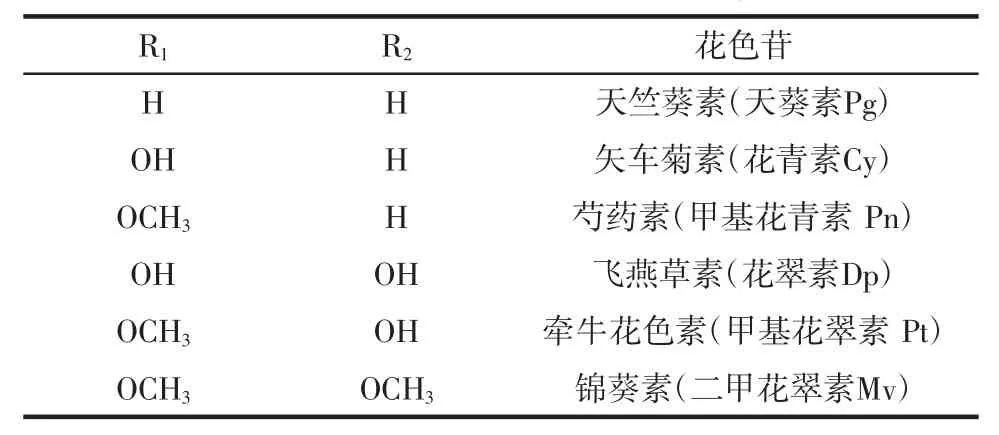
表1 最常见的花色苷Table 1 The most common anthocyanins
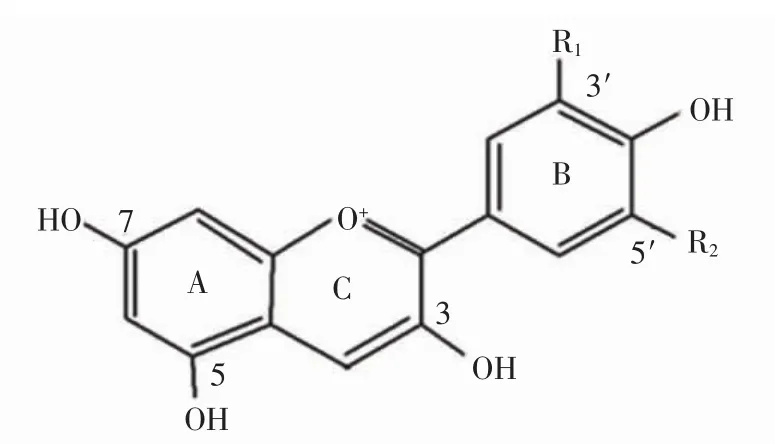
图1 花色苷母核结构Fig.1 Anthocyanin parent nucleus structure
花色苷3、5、7位上的羟基常通过糖苷键与糖结合,因糖的种类(葡萄糖、半乳糖、鼠李糖等)、数量(单糖、二糖、三糖等)、位置(3-单糖苷、5-双糖苷、3,5-二糖苷等)及结合于糖残基上芳香酸或脂肪酸的数目和性质等不同,会衍生出多种花色苷类化合物[6]。
酿酒葡萄的花色苷稳定性较差,温度、SO2浓度、光照和pH值等因素均可影响其结构和组成改变,相应的生物活性也将随之改变。适宜浓度的SO2处理对花色苷有保护作用,可减缓花色苷的褪色[8-9]。本文研究美乐、赤霞珠、马瑟兰3种酿酒葡萄的花色苷种类及稳定性,为酿造优质红葡萄酒奠定基础。
1 材料与方法
1.1 材料与试剂
美乐、赤霞珠、马瑟兰:中粮华夏长城葡萄酒有限公司;矢车菊素-3-葡萄糖苷(色谱级):上海宝曼生物科技有限公司;甲醇、乙腈(色谱级):美国fisher有限公司;甲酸(分析纯):天津永大化学试剂公司;氢氧化钠(分析纯):天津市福晨化学试剂厂;盐酸(分析纯):天津市大茂化学试剂厂;95%乙醇(分析纯):新宇三阳实业有限公司。
1.2 仪器与设备
试验仪器与设备见表2。
表2 试验仪器与设备Table 2 Experimental instruments and equipment
1.3 试验方法
1.3.1 花色苷溶液的制备
新鲜葡萄(或冷冻葡萄解冻)→打浆→乙醇提取[葡萄浆 ∶60%乙醇溶液=1∶18(g/mL),50℃浸提3 h]→50℃旋转蒸发回收乙醇→花色苷粗提液→避光保存
1.3.2 花色苷粉末的制备工艺
花色苷粗提液→真空冷冻干燥(冷阱温度-80℃,干燥24h)→花色苷冻干粉→密封于2mL试管→-20℃保存
1.3.3 总花色苷含量的测定
采用pH示差法[10-12],吸取果汁1mL,分别加入12mL pH 1.0的缓冲溶液、12 mL pH 4.5的缓冲溶液,避光放置15 min,在520 nm和700 nm波长处测定吸光度。根据以下公式计算总花色苷含量。
式中:X 为总花色苷含量,mg/L;A 为(A20-A700)pH1.0-(A520-A700)pH4.5;M为3-葡萄糖苷-矢车菊素的摩尔质量,449.2 g/mol;ε为摩尔消光系数,26900 L/(mol·cm)。
1.3.4 花色苷种类和含量的测定
超高压液相色谱-三重四极杆质谱联用仪检测3种葡萄样品60%乙醇提取后的花色苷溶液中的花色苷种类和含量。
质谱检测(mass-spectrometric detection,MSD)参数为ESI离子源,负离子模式(花色苷正离子模式);扫描模式:全自动二级质谱扫描;雾化器压力:15 psi(1 psi=6.895 kPa);干燥气流速:10 L/min;干燥气温度:350 ℃;离子扫描范围(m/z):100~1 000。分离柱为Agilent C18,2.1×50 mm,1.8μm,柱温45℃,进样量 3 μL。流动相B为0.1%甲酸水溶液,D为乙腈,流速0.3 mL/min。洗脱程序见表3。

表3 花色苷洗脱程序Table 3 Anthocyanin elution procedure
1.3.5 花色苷的稳定性测定
1.3.5.1 pH值对花色苷稳定性的影响
参考江澜[13]、李雨浩等[14]的方法,稍作修改。准确称取美乐、赤霞珠、马瑟兰3种酿酒葡萄花色苷冻干粉5 mg于5 mL水中,制成1 mg/mL的花色苷水溶液,用0.05 mol/L NaOH和0.2 mol/L HCl调花色苷水溶液的pH 值为 2、3、4、5、6、7,摇匀,室温(25 ℃)避光放置2 h,观察不同pH值下溶液的颜色变化,同时用色彩色差计测定溶液的亮度(lightness,L)、色度(chroma,C)、总色差(total color difference,TCD)值[15],试验设 3个平行。
1.3.5.2 温度对花色苷稳定性的影响
参考赵慧[16]的方法,稍作修改。将花色苷水溶液分别置于 4、25、55、75、100 ℃环境,保鲜膜封口加热 3 h,每隔1 h测定一次,取样时迅速冷却至室温(25℃),用色彩色差计测定不同温度下花色苷溶液的L、C、TCD值。
1.3.5.3 光照对花色苷稳定性的影响
参照刘芳芳等[17]的方法,稍作修改。将pH值2~4的花色苷水溶液置于白色玻璃瓶内,保鲜膜封口,分别放置于避光、日光灯加自然光(统称为自然光)、室温(25℃)超净台紫外灯下,观察7 d,每天固定时间用色彩色差计测定不同光处理下花色苷溶液的L、C、TCD值。
1.3.5.4 SO2添加量对花色苷稳定性的影响
参照张珍珍等[18]的方法,稍作修改。将50 g/L的SO2溶液,按照浓度为 30、40、50、60、70(mg/L),分别加入到美乐、赤霞珠、马瑟兰葡萄的花色苷水溶液中,混匀避光静置24 h,用色彩色差计测定花色苷溶液的L、C、TCD值。
1.4 数据处理
所有试验均重复操作3次。重复性和准确性试验的数据均由Excel 2010计算得出,Origin 8.5软件作图。
2 结果与分析
2.1 3种酿酒葡萄的总花色苷含量
3种酿酒葡萄的花色苷含量见表4。
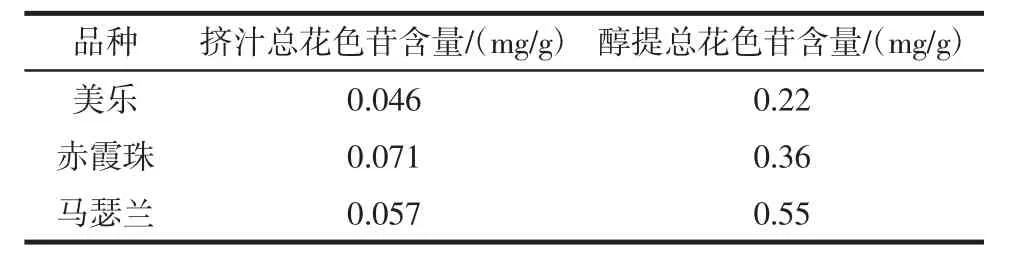
表4 美乐、赤霞珠、马瑟兰的总花色苷含量Table 4 Anthocyanin content of Merlot,Cabernet Sauvignon and Marselan
由表4可知,挤汁未经醇提的酿酒葡萄花色苷含量为赤霞珠>马瑟兰>美乐,与醇提相比花色苷含量偏低,说明有大量花色苷仍残留在葡萄皮中。醇提后3种酿酒葡萄花色苷的含量为马瑟兰>赤霞珠>美乐,说明酿酒葡萄果皮中花色苷的溶解性不同。
2.2 3种酿酒葡萄的不同花色苷种类及含量
3种酿酒葡萄的不同花色苷种类及含量测定结果见表5。

表5 美乐、赤霞珠、马瑟兰3种酿酒葡萄的花色苷种类Table 5 Anthocyanin species of Merlot,Cabernet Sauvignon and Marselan three wine grapes
花色苷是葡萄果皮中呈色的主要物质[19-21],主要存在于紫色或红色葡萄的果皮中。由表5可知,3种酿酒葡萄分别检测到11、12、11种花色苷物质,共同含有8种花色苷类物质;赤霞珠和马瑟兰葡萄均未检测到花葵素-3-芸香糖苷,美乐和马瑟兰葡萄均未检测出花葵素-3-半乳糖苷,甲基花青素-3-阿拉伯糖苷仅在美乐中未检测出;在检出的花色苷中,3′,5′-二甲花翠素葡萄糖苷含量占总花色苷含量的50%以上,而且二甲花翠素类所占比例最高[22],花青素类所占比例最低;3种酿酒葡萄以花翠素、二甲花翠素、甲基花青素为主要花色苷。一些研究者认为花青素是其他花色苷合成的前体物质[23],3种酿酒葡萄的花色苷含量依次是赤霞珠>马瑟兰>美乐,这与杨晓慧等[19]、ANA 等[24]、张娟等[25]的报道一致。
2.3 3种酿酒葡萄花色苷的稳定性
2.3.1 pH值对3种葡萄花色苷稳定性的影响
pH值影响花色苷结构的改变,pH值≤3时,花色苷以红色吡喃阳离子结构存在,结构稳定;花色苷结构在pH 4~5时是不稳定的,化学结构很容易改变。pH值对花色苷稳定性的影响见图2。

图2 pH值对3种酿酒葡萄的花色苷稳定性影响Fig.2 Effect of pH on anthocyanin stability of three kinds of wine grapes
如图2所示,pH值对3种酿酒葡萄花色苷的稳定性影响很大,甚至改变了花色苷的化学结构。花色苷溶液色泽越深,亮度(L)越小,色度(C)越大,总色差(TCD)越大。图2中3种葡萄的L值随pH值的提高先增加后下降,C值随pH值的增加而下降,TCD值随pH值的增加而增加。当pH值≤3时,3种酿酒葡萄花色苷的L值呈上升趋势,C值呈下降趋势,TCD值的增加幅度高于pH值≥4的增加幅度。pH值>5后,花色苷的L值逐渐下降。因此,花色苷在较低pH值下是稳定的,在较高的pH值条件下是不稳定的。这与文献[26]研究的结果一致。
2.3.2 光照对3种葡萄花色苷稳定性的影响
光照对花色苷有一定的降解效果,长时间的光照会造成花色苷的大量损失,而且不同的光照处理对于花色苷的影响也不同。光照对3种葡萄花色苷稳定性的影响见图3。
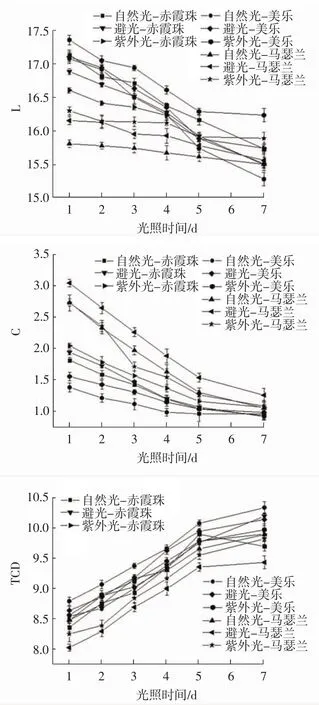
图3 光照处理对3种酿酒葡萄花色苷稳定性的影响Fig.3 Effect of light treatment on stability of anthocyanins in three wine grapes
由图3可知,随光处理时间的延长,L值、C值呈下降趋势,TCD值呈现上升趋势。光处理第3天,花色苷溶液出现明显的褪色现象,自然光和紫外线处理的花色苷溶液先出现白色和其他絮状物;光处理第5天后,花色苷溶液明显变浅,说明花色苷在长时间光照处理下是极其不稳定的。
采用3种光处理赤霞珠、美乐、马瑟兰酿酒葡萄花色苷,马瑟兰葡萄的花色苷稳定性强于美乐,赤霞珠葡萄稳定性相对较弱。避光处理3种葡萄花色苷的L值下降速度低于紫外光和自然光。相同时间内,避光处理的花色苷含量高于紫外和自然光的花色苷含量,避光花色苷的TCD值高于紫外光和自然光。可能是因为花色苷在光照条件下酰基脱落,导致稳定性下降。长时间的光照处理会影响花色苷,时间越长,花色苷降解越多,花色苷含量越低,溶液颜色越浅,这说明紫外光照和自然光照对花色苷有强降解作用,这与Azuma等[27]的研究结论相似。
综上所述,由图3可知,马瑟兰葡萄花色苷稳定性高于赤霞珠和美乐,避光环境比光照环境更利于花色苷水溶液的稳定。
2.3.3 储藏温度对花色苷稳定性的影响结果
花色苷的热降解规律符合第一热力学公式,在加热时间延长、温度升高的情况下花色苷的降解速率也随之加快。储藏温度对花色苷稳定性的影响见图4。
由图4可知,随着储藏温度的升高,葡萄花色苷的L值和TCD值上升,C值下降,颜色变浅。在4℃和25℃的较低温度下,3种酿酒葡萄花色苷溶液的L值、C值、TCD值基本无变化;50℃时,发生略微变化;而在75℃时,相对于较低温度都发生显著性变化。可见温度提高,影响葡萄花色苷溶液的稳定性。75℃以下,花色苷具有较强的热稳定性,随温度升高,耐热性逐渐降低,这是由于在高温下花色苷易氧化褪色[28],还可能是因为温度升高导致部分色素复合物的解离,从而产生无色化合物,导致颜色丧失。较高的温度可能会使花色苷的结构发生变化,花色苷上的基团和单体会发生位移[15,29]。因此,储藏温度需不超过50℃。

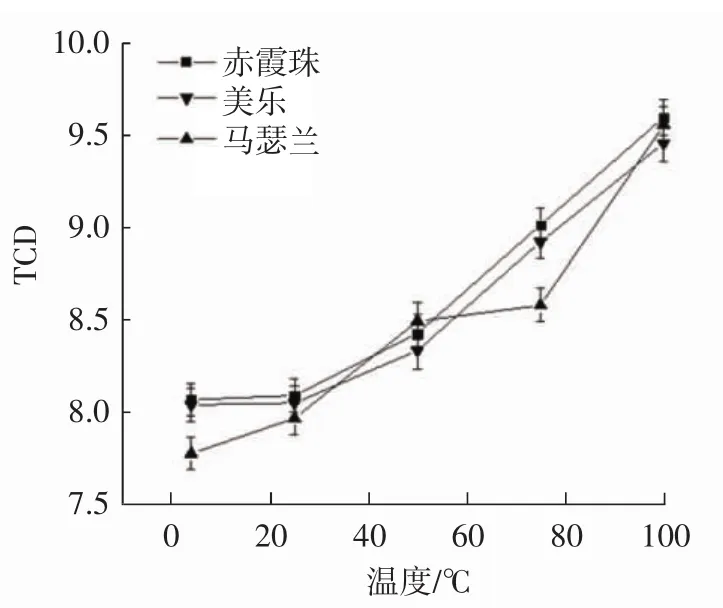
图4 储藏温度对3种酿酒葡萄花色苷稳定性的影响Fig.4 Effect of storage temperature on stability of three wine grapes anthocyanins
2.3.4 SO2浓度对酿酒葡萄花色苷稳定性的影响
当还原剂浓度较大时可严重破坏花色苷结构。SO2还原性强,SO2在常温下就能表现出强氧化性,破坏花色苷的化学结构,使花色苷褪色。SO2浓度对酿酒葡萄花色苷稳定性的影响见图5。
由图5可知,马瑟兰葡萄的花色苷稳定性强于美乐和赤霞珠。随SO2浓度增加,花色苷溶液的L值逐渐增加,C值和TCD值逐渐下降。高浓度SO2对花色苷的稳定性有一定的破坏作用;且当SO2浓度升高时,花色苷与硫酸氢根离子发生缩合反应使葡萄颜色衰退。并且由于SO2具有强还原性,因此氧化脱色的能力也随之而来。SO2浓度≤40 mg/L时,3种酿酒葡萄的花色苷溶液颜色基本上保持红色,无变化。SO2浓度过低,则抑制和杀菌能力不能发挥,因此建议SO2浓度≤40 mg/L比较合适。
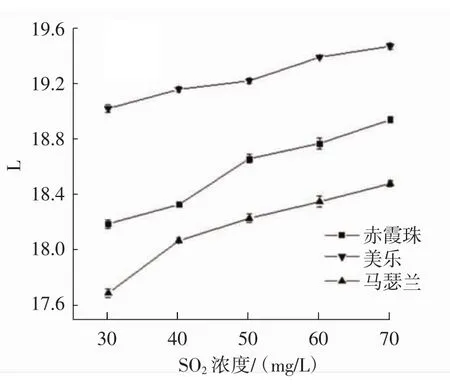
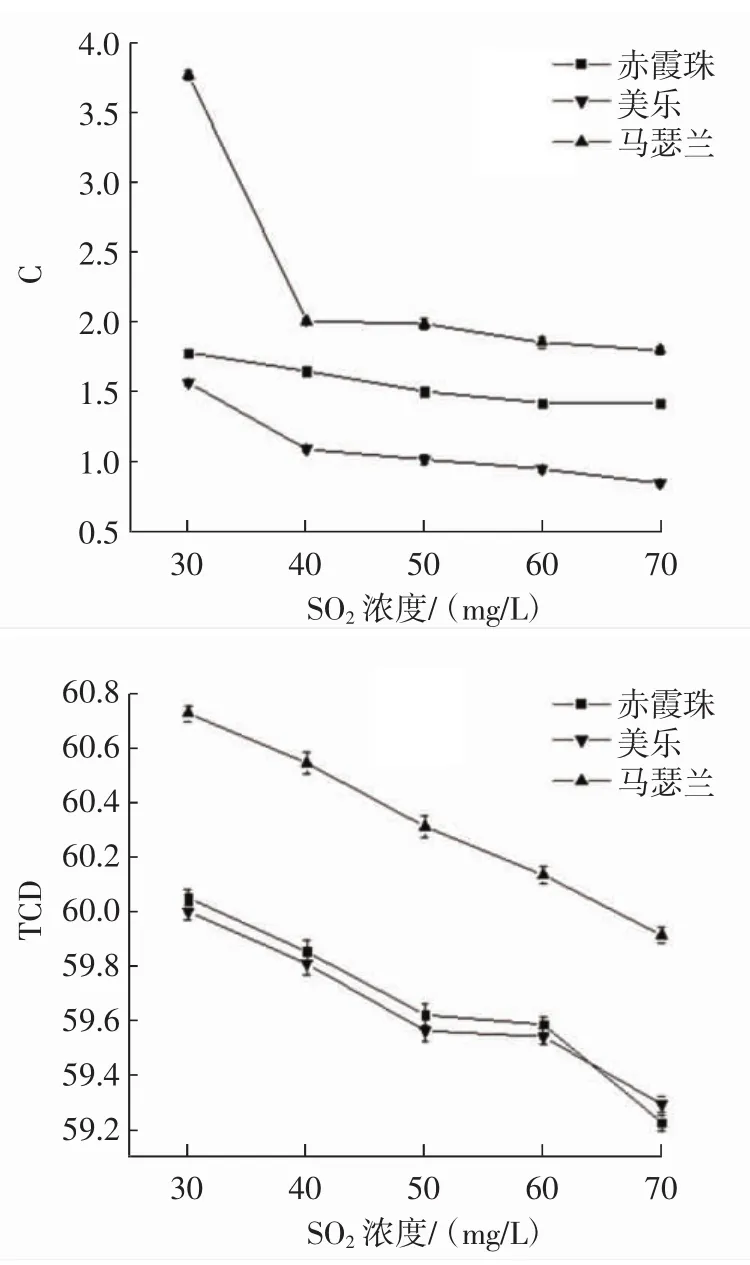
图5 SO2浓度对3种葡萄花色苷稳定性的影响Fig.5 The effect of SO2concentration on the stability of anthocyanins in three wine grapes
3 结论
花色苷是酿酒葡萄和所酿酒的重要功能指标,其自身结构和性质的稳定无疑直接影响着产品的感官、营养、安全性和功能性。本文通过超高压液相色谱质谱联用仪测定了赤霞珠、美乐和马瑟兰3种酿酒葡萄花色苷的种类及含量,其共同含有8种花色苷,赤霞珠含花色苷种类最多为12种,美乐和马瑟兰含花色苷种类为11种;3′,5′-二甲花翠素葡萄糖苷含量占绝对优势,3种酿酒葡萄均以花翠素、二甲花翠素、甲基花青素为主,含量依次为:赤霞珠>马瑟兰>美乐。温度、SO2浓度、光照和pH值等因素影响花色苷稳定性,其结构和组成会发生改变,相应的生物活性也将随之改变。适宜浓度的SO2对花色苷有保护作用,可减缓褪色。维持pH值≤3和SO2浓度≤40 mg/L,且在温度低于50℃下避光保存,花色苷较稳定,C6-C3-C6结构不易发生变化。

