5-碘代杀结核菌素对小鼠神经管的影响及其作用机制
张晓敏,李美宁,王文卓,李丹丹,牛玉虎,牛勃 ,2
1.山西医科大学生物化学与分子生物学教研室,山西太原030001;2.首都儿科研究所儿童发育营养组学北京市重点实验室,北京100020
神经管畸形(neural tube defect,NTD)是一种先天性的中枢神经系统畸形,继发于第3 和第4 周妊娠期间神经管的闭合失败。NTD 每年影响全球约30万新生儿,严重威胁新生儿的生命健康[1]。有研究表明,NTD 是由遗传因素和环境因素共同导致的,在环境致畸因素中叶酸缺乏与神经管畸形的发生密切相关[2-4]。体内叶酸在二氢叶酸还原酶的作用下转变为四氢叶酸,四氢叶酸作为一碳单位的载体,参与嘌呤和嘧啶核苷酸的合成,并为甲硫氨酸循环提供甲基,叶酸缺乏不仅会影响核酸的生成,也会干扰体内的甲基化反应,从而影响细胞的增殖、分化、凋亡等,最终诱导NTD 的发生[5-6]。全球各地报告显示,近20 年,补充叶酸可有效降低NTD 的发生率,但其潜在的分子机制尚未明确[7-10]。
腺苷激酶(adenosine kinase,ADK)是嘌呤补救合成途径的关键酶,可催化腺苷转化为AMP,该途径是叶酸代谢合成核酸的关键环节,也是腺苷在体内代谢的最主要途径。本研究采用ADK 的抑制剂5-碘代杀结核菌素(5-iodotubercidin,ITU)模拟叶酸代谢障碍,建立小鼠NTD 模型,探讨神经上皮细胞的增殖、凋亡及N6-甲基腺苷(N6-methylodenosine,m6A)甲基化在NTD 发生中的作用。
1 材料与方法
1.1 主要试剂 ITU 购自美国APExBIO 公司;腺苷、AMP、S-腺苷同型半胱氨酸(S-adenosylhomocysteine,SAH)、S-腺苷甲硫氨酸(S-adenosylmethionine,SAM)ELISA 检测试剂盒购自上海通蔚生物科技有限公司;YF®594TUNELAssayApoptosisDetectionKit 及YF®594 Click-iT EdU Stain Kit 购自苏州宇恒生物科技有限公司;鼠抗FTO 单克隆抗体、m6A RNA Methylation Quantification Kit 及兔抗METTL3 单克隆抗体购自英国 Abcam 公司;兔抗 YTHDF2、β-actin、β-tublin 单克隆抗体、兔抗caspase-3、PCNA 多克隆抗体、HRP标记的羊抗兔及羊抗鼠IgG 购自武汉三鹰生物技术有限公司。
1.2 实验动物 SPF 级 C57BL /6J 小鼠,7 ~ 8 周龄,体重19 ~22 g,购自山西医科大学实验动物中心,动物合格证号为:SCXK(晋)2015-0001。小鼠饲养于温度22 ℃,湿度40% ~60%的SPF 级实验动物房。
1.3 动物模型的建立 C57BL / 6J 小鼠适应性喂养1 周后,于晚上6 点按1 ∶1 的比例将雌雄小鼠合笼,第2 天早上8 点分笼,检查雌鼠阴栓并称重,有阴栓者确定为孕(embryo,E)0.5 d,于E7.5 d 将孕鼠随机分为 ITU 组(分别经腹腔注射 2、3、4、5、6、7 mg /kg的ITU)及对照组(经腹腔注射等体积含2%DMSO 的生理盐水)。E11.5 d 时,颈椎脱臼处死孕鼠,取小鼠胚胎,置体式显微镜下观察、拍照,测量小鼠顶臀长,胚胎称重,并记录胚胎总数、吸收胎数及畸胎数。
1.4 组织病理学检测 将对照组及NTD 组(最佳剂量ITU)胚胎用10%多聚甲醛固定,脱水、石蜡包埋,进行连续切片。切片脱蜡、水化后进行HE 染色。将切片置于显微镜下观察、拍照。
1.5 孕鼠血清中腺苷、AMP、SAH、SAM 含量的检测NTD 组小鼠注射 0、2、4、8、12、24 h 后,经眼球采血,845 × g 离心 5 min 分离血清,采用相应 ELISA 试剂盒检测腺苷、AMP、SAH、SAM 含量。
1.6 胚胎脑组织中m6A 及相关蛋白含量的检测E11.5 d 取出胚胎后,提取对照组及NTD 组小鼠胚胎脑组织总RNA,测定浓度,采用m6A RNA Methylation Quantification Kit 检测孕鼠胚胎脑组织中的m6A含量。提取两组小鼠胚胎脑组织总蛋白,BCA 法测定浓度。经10% SDS-PAGE 分离后,转移至PVDF膜,用5%脱脂奶粉于室温封闭1 h;用TBST 洗涤3次,5 min / 次,加入兔抗 METTL3、YTHDF2 单克隆抗体及鼠抗 FTO 单克隆抗体(均 1 ∶1 000 稀释),4 ℃孵育过夜;用 TBST 洗涤 3 次,5 min / 次,加入 HRP标记的羊抗兔及羊抗鼠IgG(1 ∶5 000 稀释),室温孵育 1 h;用 TBST 洗涤 3 次,5 min /次;ECL 法显色。
1.7 小鼠胚胎脑组织中神经上皮细胞增殖情况的检测 对照组及NTD 组孕鼠经腹腔注射5 mg / kg的EdU,13 h 后脱颈处死孕鼠,取胚胎,用4%多聚甲醛固定,脑组织进行连续切片。采用YF®594 Click-iT EdU Stain Kit 检测孕鼠脑组织神经上皮细胞Edu 阳性细胞数量,荧光显微镜下观察、拍照,并计算百分比。同时检测两组小鼠胚胎脑组织中增殖相关蛋白PCNA 的表达量,方法同1.6 项,其中一抗为兔抗PCNA 多克隆抗体,稀释度为1 ∶8 000。
1.8 小鼠胚胎脑组织中神经上皮细胞凋亡情况的检测 采用1.4 项方法制备组织切片,通过YF®594 TUNEL Assay Apoptosis Detection Kit 检测孕鼠脑组织神经上皮细胞TUNEL 阳性细胞,荧光显微镜下观察、拍照,并计算百分比。同时检测两组小鼠胚胎脑组织中凋亡相关蛋白caspase-3 的表达量,方法同1.6 项,其中一抗为兔抗caspase-3 多克隆抗体,稀释度为 1 ∶1 000。
1.9 统计学分析 应用SPSS 20.0 软件进行统计学分析,所有数据均采用均数± 标准差(± s)表示,组间比较采用t 检验,以P <0.05 为差异有统计学意义。
2 结 果
2.1 各组小鼠胚胎的镜下观察 对照组胚胎生长发育良好,未出现NTD;ITU 组随着ITU 剂量的增加,NTD 的发生率逐渐增加,且吸收胎和发育迟缓胚胎的比率也逐渐增加,当ITU 剂量为5 mg / kg 时,NTD 的发生率最高,达32.2%。畸形主要表现为后脑畸形,部分胚胎表现为露脑畸形,其他畸形包括颅面部畸形、无眼畸形及发育迟缓。见图1 和表1。因此选取5 mg / kg 剂量作为最佳造模剂量。对照组(n = 41)及NTD 组(n = 38)胚胎的顶臀长分别为(6.52 ± 0.31)和(5.31 ± 1.42)mm,体重分别为(22.53 ± 2.56)和(16.78 ± 5.67)mg。与对照组比较,NTD 组胚胎的顶臀长和体重均明显下降(t 分别为 8.317 和 10.13,P < 0.05)。
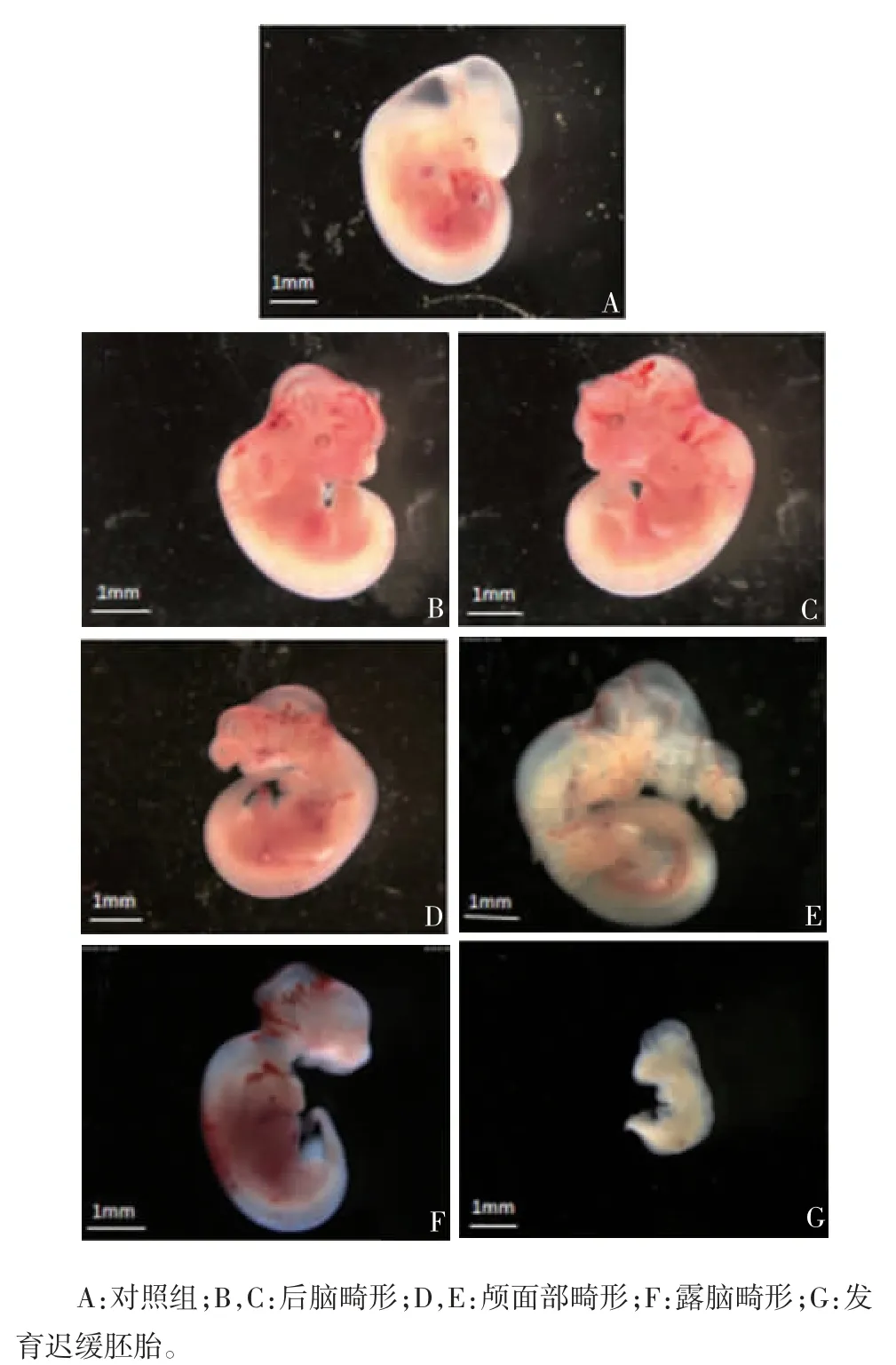
图1 ITU 致胚胎发育异常的主要类型Fig.1 Abnormal embryonic development caused by ITU
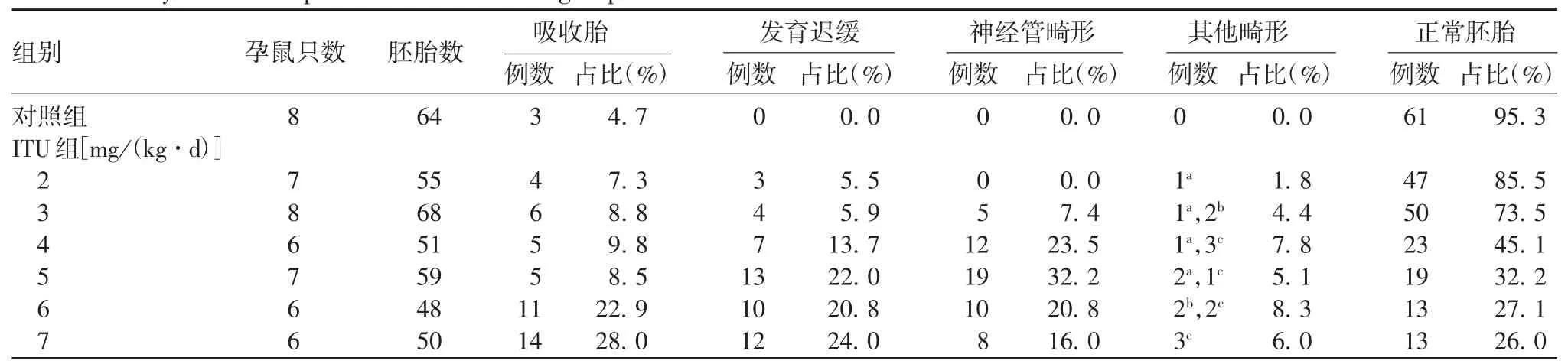
表1 各组小鼠胚胎发育情况Tab.1 Embryonic development of mice in ITU group with different doses
2.2 组织病理学检测 对照组胚胎神经管发育良好,管腔规则,神经管闭合完全,神经上皮细胞排列规则、紧密;NTD 组胚胎神经管管壁厚薄不一,管腔不规则,神经管未完全闭合,顶板处仅被一层间质和羊膜所包裹,神经上皮细胞排列紊乱、疏松。见图2。
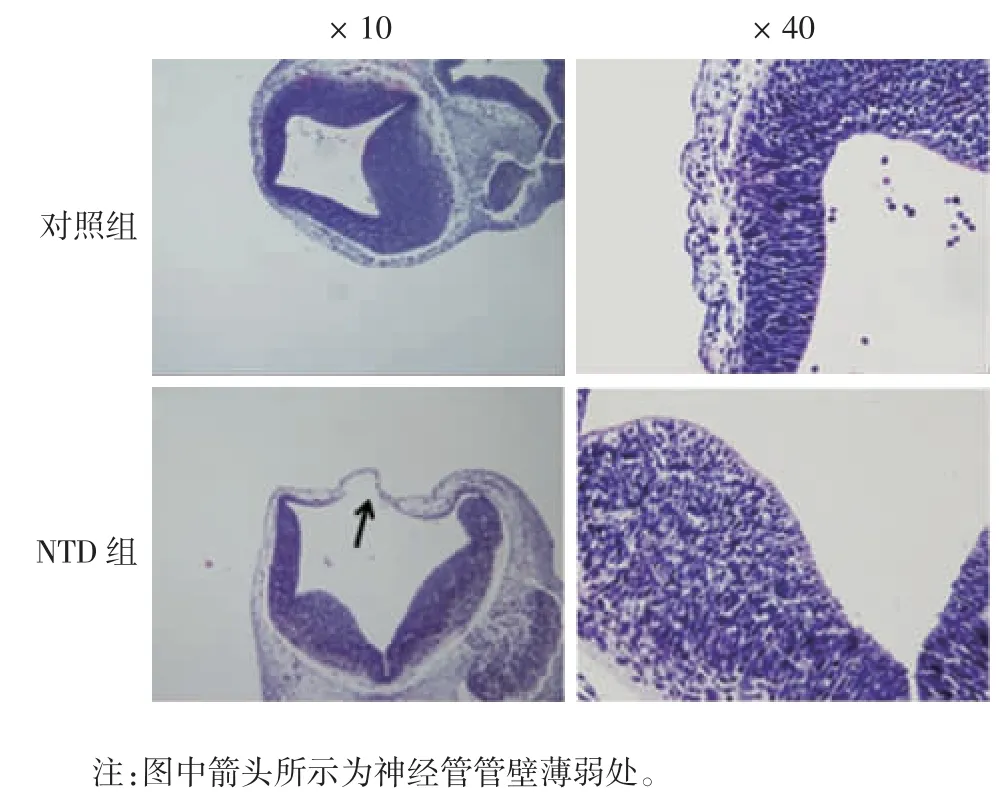
图2 小鼠胚胎在E11.5 d 后脑HE 染色结果Fig.2 HE staining of brain tissue of mouse embryos on E11.5 d
2.3 孕鼠血清中腺苷、AMP、SAH、SAM 的含量 孕鼠血清中腺苷、SAM、SAH 在注射2 h 后开始升高,8 h达高峰(t 值分别为 12.15、9.389 和 11.75,P < 0.01),8 h 后逐渐恢复至正常水平;AMP 的浓度在注射后2 h开始降低,8 h 浓度达最低(t = 6.326,P <0.05),8 h后逐渐恢复正常水平。见图3。
2.4 小鼠胚胎脑组织中m6A 及其相关蛋白的含量对照组及NTD 组小鼠胚胎脑组织总RNA 中m6A含量分别为0.35 和0.23 ng,占总RNA 的比例分别为0.175%和0.115%。NTD 组m6A 在总RNA 中所占比例明显低于对照组(t = 6.002,P <0.05)。对照组及NTD 组小鼠胚胎脑组织中METTL3 蛋白相对表达水平分别为0.98 和0.60,FTO 蛋白相对表达水平分别为0.78 和0.75,YTHDF2 蛋白相对表达水平分别为0.79 和0.82。与对照组比较,NTD 组的METTL3 蛋白表达水平明显下降(t=10.68,P <0.05),FTO 和YTHDF2 蛋白的表达水平差异无统计学意义(t 分别为 1.373 和 1.871,P > 0.05,)。见图 4。
2.5 小鼠胚胎脑组织中神经上皮细胞的增殖情况对照组和NTD 组孕鼠脑组织神经上皮细胞Edu 阳性细胞百分比分别为79%和59%,NTD 胚胎中处于增殖期的细胞明显减少(t = 5.20,P <0.05),见图5。对照组和NTD 组小鼠胚胎脑组织中的增殖相关蛋白PCNA 相对表达量分别为1.72 和1.05,后者明显降低(t = 8.567,P < 0.05),见图 6,表明 NTD 胚胎脑组织中细胞增殖减慢。
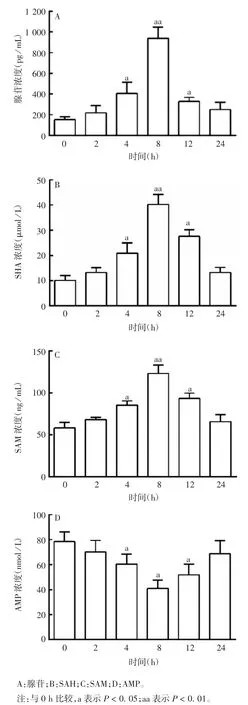
图3 小鼠血清中腺苷及相关代谢物的水平Fig.3 Levels of adenosine and related metabolites in sera of mice

图4 小鼠胚胎脑组织中METTL3(A)、YTHDF2(B)、FTO(C)蛋白的表达情况Fig.4 Expressions METTL3(A),YTHDF2(B)and FTO(C)proteins in mouse embryonic brain tissue
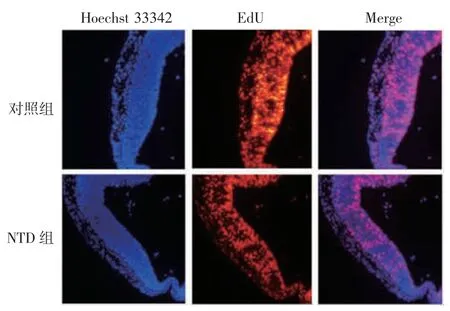
图5 ITU 对神经上皮细胞增殖的影响(× 100)Fig.5 ITU effect on proliferation of neuroepithelial cells(×100)
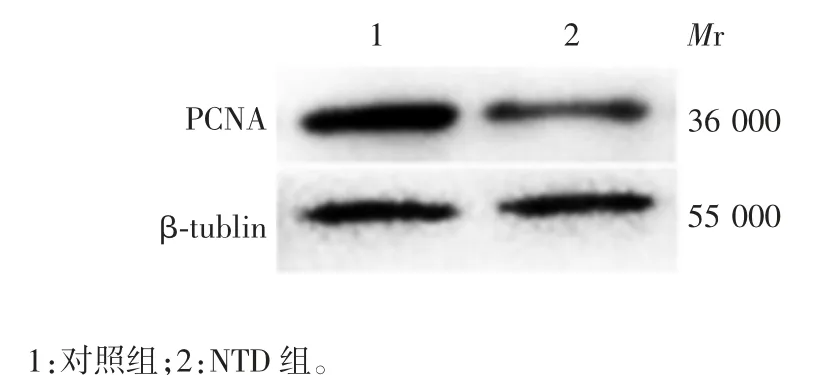
图6 小鼠胚胎脑组织中PCNA 的表达情况Fig.6 Expression level of PCNA in mouse embryonic brain tissue
2.6 小鼠胚胎脑组织中神经上皮细胞的凋亡情况对照组和NTD 组TUNEL 阳性细胞百分比分别为3.3%和13.3%,NTD 胚胎中凋亡细胞明显增多(t =5.295,P <0.05),见图7。对照组和NTD 组小鼠胚胎脑组织中的凋亡相关蛋白caspase-3 的相对表达水平分别为0.64 和1.33,后者明显增加(t=12.47,P <0.05),见图8。表明NTD 胚胎脑组织中细胞凋亡增加。
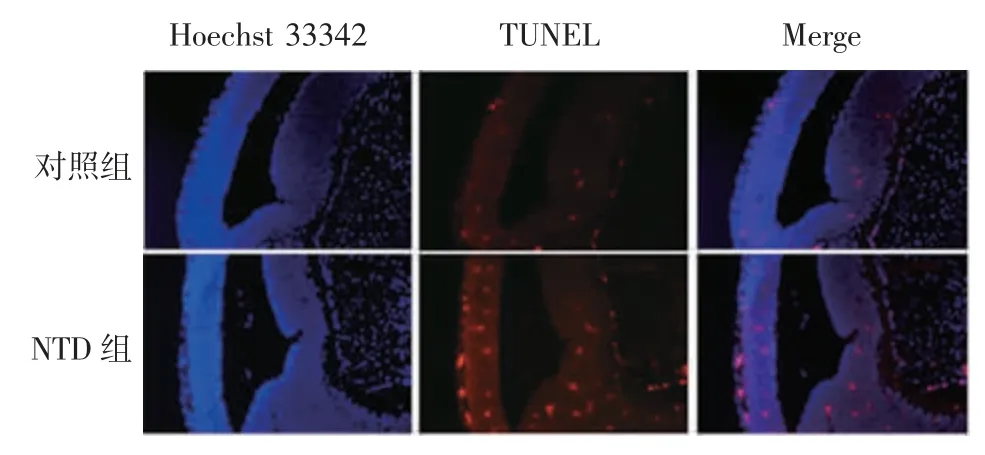
图7 ITU 对神经上皮细胞凋亡的影响(× 100)Fig.7 Effect of ITU on apoptosis of neuroepithelial cells(×100)
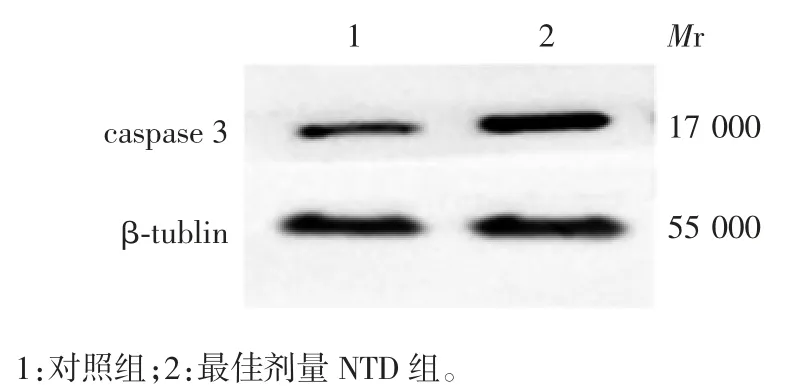
图8 小鼠胚胎脑组织中caspase-3 的表达情况Fig.8 Expression of caspase-3 in mouse embryonic brain tissue
3 讨 论
有研究表明,叶酸缺乏与NTD 明显相关[11-12],但作用机制尚未明确。本研究通过ADK 的抑制剂ITU 建立了NTD 小鼠模型,探讨由ITU 引起核酸合成障碍及腺苷含量增高对神经管发育的影响。
ADK 是催化腺苷转化为AMP 的关键酶,该途径也是腺苷在体内代谢的最主要途径,ITU 抑制腺苷激酶会导致腺苷在体内大量积聚,AMP 水平下降。本研究结果表明,ITU 抑制ADK 可引起小鼠血浆中AMP 含量下降,进而影响核酸合成。胚胎发育过程中对核酸和蛋白的需求最旺盛,该过程中核酸合成障碍将严重影响细胞的增殖及分化[13-15],从而导致神经管发育的异常。
腺苷作为甲硫氨酸循环中SAH 的分解产物,其升高会抑制SAH 的分解,从而引起SAH 积聚,进而抑制SAM 转甲基化反应,引起体内的低甲基化[16-18]。m6A 是mRNA 的一种甲基化修饰形式,m6A 修饰是动态可逆的过程,其发挥生物学功能需要甲基化酶(writer)、去甲基化酶(eraser)及 m6A 识别蛋白(reader)的参与[19-21]。其中METTL3 是甲基转移酶之一,含有一个SAM 结合区域[22-24],且能够识别特定潜在的m6A 修饰位点,并将SAM 的甲基转移至该位点上。FTO 是m6A 的一种去甲基化酶,FTO 广泛存在于成人和胚胎组织中,在大脑中表达较高[25-27]。YTHDF2 是m6A 结合蛋白,可促进mRNA 的降解。上述m6A 相关蛋白相互作用,共同影响m6A 水平。本研究结果表明,NTD 组m6A 甲基化明显减低(P <0.01),METTL3 的表达水平也明显降低(P < 0.01),FTO 和YTHDF2 蛋白的表达水平差异无统计学意义(P > 0.05)。有研究表明,m6A 对胚胎发育过程具有重要的作用,在哺乳动物中,m6A 可维持胚胎干细胞(ES)细胞分化,维持昼夜节律和剂量补偿的作用[28-29],METTL3 基因敲除的小鼠植入前胚胎干细胞和“幼稚”胚胎干细胞在mRNA 中无m6A 发生,无法充分终止其“幼稚”状态,在胚胎植入后受到异常和限制性的谱系启动,导致早期胚胎死亡[30-31]。因此ITU 通过引起体内的低甲基化,可能引起m6A 水平下降,从而影响细胞的分化、凋亡等,导致NTD 的发生。本实验结果表明,NTD 胚胎脑组织中细胞增殖明显减慢(P<0.05),细胞凋亡明显增加(P<0.05)。
综上所述,ITU 可导致小鼠NTD,其作用机制可能为:腺苷激酶受抑制,导致小鼠血浆中AMP 含量下降及腺苷含量增加,进而影响核酸的合成,干扰RNA 甲基化,引起m6A 含量下降,导致细胞增殖和凋亡失衡,从而导致小鼠NTD。

