人甲型H7N9 流感病毒全病毒灭活疫苗的稳定性
段鹏,石玮,周欣,许文婷,柳伟君,杨月莲,王石磊
上海生物制品研究所有限责任公司,上海200051
截至 2018 年 9 月,WHO 共报道了 1 567 例甲型H7N9 流感病毒感染确诊病例,致死率高达40%,对人类的健康造成重大威胁[1-2]。甲型H7N9 流感病毒是一种源自鸟类的禽流感病毒毒株基因重配的新型病毒,人类对其无特异性免疫力。目前,尽管磷酸奥司他韦和扎那米韦对该病毒感染有确切疗效,但两种药物均需在感染后48 h 内及时使用方可达到理想的治疗效果,也不排除病毒会出现广泛耐药变异的可能[2]。疫苗接种是预防流感流行和病毒感染的有效方法[3]。有研究表明,添加佐剂的甲型H7N9流感病毒疫苗可诱导产生针对H7N9 病毒较强的免疫反应[4]。
疫苗的稳定性对疫苗免疫程序的设计至关重要[5],可通过一系列物理化学和生物化学实验评估疫苗中抗原含量的变化情况[6]。流感病毒囊膜外层主要有血凝素(hemagglutinin,HA)和神经氨酸酶(neuraminidase,NA)两种抗原物质[7-8]。研究表明,HA 是流感病毒的关键抗原之一,在流感病毒感染宿主细胞过程中起着至关重要的作用[9],是流感疫苗中有效的免疫物质[10-12],因此,HA 含量是衡量疫苗效力的主要指标。传统检测方法是单向免疫扩散法,该方法基于琼脂糖凝胶技术,采用菌株特异性多克隆抗体试剂,通过与参考抗原标准的指定HA 值进行比较,定量疫苗样品中流感病毒HA 的含量[13-15],该方法仍是HA 的含量检测的金标准[16]。本研究对采用 WHO 颁布的重组病毒疫苗株 A / Shanghai / 2 /2013(NIBRG-267),以氢氧化铝作为佐剂。制备的6批甲型H7N9 流感病毒全病毒灭活疫苗进行加速热稳定性和长期稳定性评价。
1 材料与方法
1.1 疫苗原液 甲型H7N9 流感病毒全病毒灭活疫苗原液由上海生物制品研究所有限责任公司采用H7N9 原始毒株 A / Shanghai / 2 / 2013(NIBRG-267)制备,并经灭活、纯化、脱糖、除菌过滤。
1.2 主要试剂 H7N9 病毒标准抗原(2013001)和标准抗血清(AB2013002)由中国食品药品检定研究院提供;琼脂糖购自美国Invitrogen 公司;去污剂及Zwittergent 3-14 Detergent 购自德国Merk 公司。
1.3 疫苗的配制 分别以 33 和 66 μg / mL HA 含量为配置点,将甲型H7N9 流感病毒全病毒灭活疫苗原液辅以氢氧化铝佐剂(铝终浓度为0.5 mg / mL)配制成两种规格的甲型H7N9 流感病毒全病毒灭活疫苗。规格为 15 μg /(0.5 mL·瓶)共 3 批,批号分别为 SS201404007、SS201404008、SS201404009,检测标准为 26.4 ~ 39.6 μg / mL;规格为 30 μg /(0.5 mL·瓶)共 3 批,批号分别为 SS2-01404010、SS201404011、SS201404012,检测标准为 52.8 ~79.2 μg / mL。将制备的 6 批疫苗成品根据《中国药典》三部(2010 年)[17]规定方法进行鉴别试验、外观、装量、pH、铝含量、无菌、异常毒性及细菌内毒素含量检测。同时将各批样品及H7N9 病毒标准抗原分别加入至装有标准抗血清的琼脂糖凝胶板上,孔径为 4 mm,于 20 ~ 25 ℃扩散20 h;干燥、染色、脱色后测量各孔形成的沉淀环直径,以标准抗原形成的沉淀环直径对其相对应的抗原浓度进行直线回归,得到直线回归方程,代入成品的沉淀环直径,即获得HA 含量。
1.4 疫苗稳定性试验
1.4.1 (37 ± 2)℃加速热稳定性试验 6 批甲型H7N9 流感病毒全病毒灭活疫苗置(37 ± 2)℃存放,分别于第 0、7、14、21、28、35 天,按 1.3 项方法检测HA 含量,并计算HA 含量相对百分比。同时按《中国药典》三部(2010 年)[17]规定方法进行全项检测。
1.4.2 (25 ± 2)℃加速热稳定性试验 6 批甲型H7N9 流感病毒全病毒灭活疫苗置(25 ± 2)℃存放,分别于保存 0、1、2、3、4 个月后,按 1.3 项方法检测HA 含量,并计算HA 含量相对百分比。同时按《中国药典》三部(2010 年)[17]规定方法进行全项检测。
1.4.3 (2 ~8)℃长期稳定性试验 6 批甲型H7N9流感病毒全病毒灭活疫苗置2 ~8 ℃存放,分别于保存 0、3、6、9、12、15、18、21、24 个月后,按 1.3 项方法检测HA 含量,并计算HA 含量相对百分比。同时于保存 0、6、12、18、24 个月取样,按《中国药典》三部(2010 年)[17]规定方法进行全项检测。
1.5 统计学分析 应用GraphPad Prism 5 统计学软件进行分析,各温度下不同批次成品疫苗HA 下降百分比差异的比较采用one way ANOVA 法,以P <0.05为差异有统计学意义。
2 结 果
2.1 疫苗的检定 6 批甲型H7N9 流感病毒全病毒灭活疫苗 HA 含量为 33.4 ~ 68.3 μg / mL,pH 均为7.4,铝含量为 0.50 ~ 0.54 mg / mL,细菌内毒素均低于20 EU / mL,见表1。鉴别试验、外观检查、装量检查、无菌检查、异常毒性检查均合格。

表1 6 批甲型H7N9 流感病毒全病毒灭活疫苗的检测Tab.1 Control tests on six batches of final products of inactivated whole virion H7N9 influenza A vaccine
2.2 疫苗稳定性试验
2.2.1 (37 ± 2)℃加速稳定性试验 6 批甲型H7N9 流感病毒全病毒灭活疫苗于(37 ± 2)℃放置35 d,HA 含量均有一定程度降低。SS201404007、SS201404008、SS201404009 批疫苗的 HA 含量分别下降了7.1、5.5、6.4 μg/mL,仍高于检测下限 26.4 μg/mL;SS201404010、SS201404011、SS201404012 批疫苗的HA 含量分别下降了 8.1、7.4、8.7 μg /mL,仍高于检测下限52.8 μg / mL,见表2。随着存放时间的延长,HA 含量呈略下降趋势,存放35 d 后HA 含量下降幅度为10%~19%,规格为15 及30 μg(/0.5 mL·瓶)疫苗批间的HA 含量下降百分差异均无统计学意义(F 分别为 2.225 0 和 0.590 5,P 分别为 0.142 5 和0.566 4),见图1。疫苗的其他各项指标均符合相关质量标准。表明疫苗于(37 ± 2)℃条件下至少可存放35 d。
2.2.2 (25 ± 2)℃加速稳定性试验 SS201404007、SS201404008、SS201404009 批甲型 H7N9 流感病毒全病毒灭活疫苗于(25 ± 2)℃存放4 个月,HA 含量分别为 32.6、31.8 和 32.3 μg / mL,均高于检测下限 26.4 μg / mL;SS201404010、SS201404011、SS20-1404012 批存放 4 个月,HA 含量分别为 64.0、66.4和 64.0 μg / mL,也远高于检测下限 52.8 μg / mL。见表3。随着存放时间的延长,HA 含量呈略下降趋势,其中SS201404007 和SS201404009 批疫苗存放1 个月时下降已较明显,4 个月时下降约10%;SS201404008 和 SS201404012 批疫苗下降约4%;SS201404010 和SS201404011 批疫苗稳定性较好,下降约 2%。规格为 15 及 30 μg /(0.5 mL·瓶)疫苗批间的HA 含量下降百分比差异均无统计学意义(F 分别为 2.378 0 和 0.898 4,P 分别为 0.135 0 和0.432 9),见图2。疫苗的其他各项指标均符合相关质量标准。表明6 批成品疫苗在(25 ± 2)℃条件下至少可存放4 个月。
2.2.3 (2 ~8)℃长期稳定性试验 6 批甲型H7N9流感病毒全病毒灭活疫苗于2 ~8 ℃存放24 个月,规格为 15 和 30 μg /(0.5 mL·瓶)疫苗的 HA 含量分别下降至 32.0 和 64.0 μg / mL,均在检测标准范围内,见表4。随着存放时间的延长,HA 含量呈略下降趋势,其中SS201404007 和SS201404009 批疫苗下降幅度约15%,其他4 批疫苗下降幅度约5%,规格为 15 及 30 μg /(0.5 mL·瓶)疫苗批间的 HA 含量下降百分比差异有统计学意义(F 分别为6.856 和3.843,P 均<0.05),见图3。疫苗的其他各项指标均符合相关质量标准。表明该疫苗可在2 ~8 ℃环境中存放至少24 个月。

表 2 6 批甲型H7N9 流感病毒全病毒灭活疫苗于(37 ± 2)℃存放不同时间的HA 含量(μg / mL)Tab.2 HA content in six batches of inactivated whole virion H7N9 influenza A vaccine after storage at(37±2)℃for various days(μg/mL)

表 3 6 批甲型H7N9 流感病毒全病毒灭活疫苗于(25 ± 2)℃存放不同时间的HA 含量(μg / mL)Tab.3 HAcontentinsixbatchesofinactivatedwholevirionH7N9influenzaAvaccineafterstorageat(25±2)℃forvariousmonths(μg / mL)
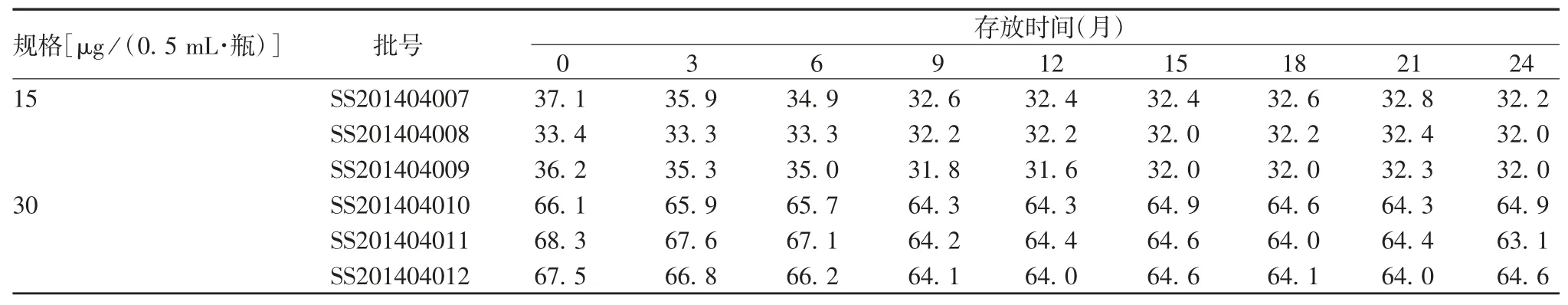
表4 6 批甲型H7N9 流感病毒全病毒灭活疫苗于2 ~8 ℃存放不同时间的HA 含量(μg / mL)Tab.4 HA content in six batches of inactivated whole virion H7N9 influenza A vaccine after storage at 2 ~ 8 ℃ for various months(μg/mL)

图1 6 批甲型H7N9 流感病毒全病毒灭活疫苗于(37 ±2)℃存放不同时间HA 含量相对百分比Fig.1 Relative percentage of HA content in six batches of inactivated whole virion H7N9 influenza A vaccine after storage at(37 ± 2)℃ for various days
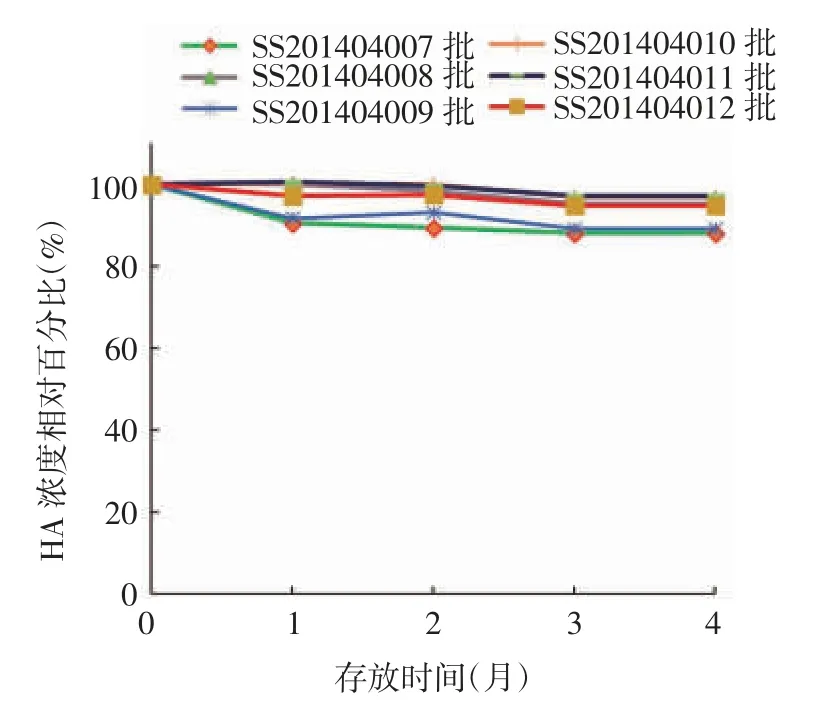
图2 6 批甲型H7N9 流感病毒全病毒灭活疫苗于(25 ±2)℃存放不同时间HA 含量相对百分比Fig.2 Relative percentage of HA content in six batches of inactivated whole virion H7N9 influenza A vaccine after storage at(25 ± 2)℃ for various months
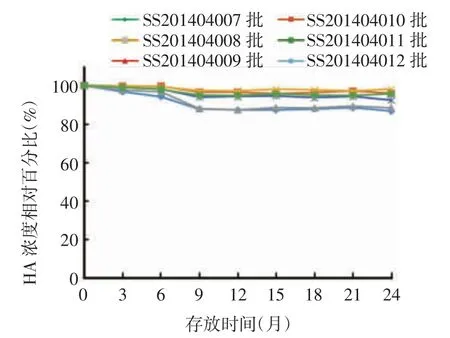
图 3 6 批甲型H7N9 流感病毒全病毒灭活疫苗于2 ~8 ℃存放不同时间HA 含量相对百分比Fig.3 Relative percentage of HA content in six batches of inactivated whole virion H7N9 influenza A vaccine after storage at 2 ~ 8 ℃ for various months
3 讨 论
疫苗接种是控制流感疫情和保障公众健康的有效方法。自20 世纪40 年代流感疫苗上市后,不仅使接种人群得到了有效保护,且限制了大流感的暴发[18]。目前上市的流感疫苗主要包括全病毒灭活疫苗、裂解疫苗、亚单位疫苗、重组表达疫苗等。
徐康维等[19]用甲型H7N9 流感病毒全病毒灭活疫苗和裂解疫苗免疫小鼠,结果显示,裂解疫苗需要免疫2 次才能达到与全病毒灭活疫苗相同的效果。贾重来等[20]对含铝佐剂和无铝佐剂的甲型H7N9 流感病毒裂解疫苗稳定性进行了比较,结果表明,含佐剂的裂解疫苗稳定性要优于无佐剂裂解疫苗。2015 年1 月,瑞士诺华公司采用鸡胚生产的甲型H7N9 流感病毒灭活疫苗完成的Ⅱ期临床试验结果显示,未添加佐剂的灭活疫苗免疫2 次后的血清保护率仅为2%,而添加佐剂AS03 实验组的血清保护率为84%。因此,含佐剂的全病毒灭活疫苗在免疫原性和稳定性方面更有优势,但全病毒灭活疫苗在接种过程中副反应的发生率也较高,因此不适用于6 岁以下的儿童[21],这也限制了全病毒灭活疫苗的适用人群。
疫苗的长期稳定性试验是判定疫苗有效期的可靠依据,加速热稳定性试验是预测疫苗在超出推荐储存条件后质量能否保持的一个重要特性[18],可为疫苗在异常贮存温度时的有效期提供依据[19],并可确定试验疫苗在特定条件下随时间变化的规律,为研究试验疫苗在包装、运输及贮存的特定环境下的稳定性提供可靠的实验依据。作为流感病毒的主要抗原之一的 HA,其含量至少达 12 μg / 0.5 mL 才能刺激机体产生保护性的中和抗体,HA 含量的稳定性对疫苗的质量至关重要[22]。
本研究对2 种规格共6 批次甲型H7N9 流感病毒全病毒灭活疫苗进行了稳定性实验。加速热稳定性试验中,(37 ± 2)℃存放35 d 后,2 种规格6 批疫苗HA 含量下降幅度为10% ~19%,HA 含量检测值均高于检测下限值;于(25 ± 2)℃存放4 个月后,规格为 15 μg /(0.5 mL·瓶)的 3 批疫苗 HA 含量分别为 32.6、31.8 和 32.3 μg / mL,均高于检测下限26.4 μg /mL,30 μg /(0.5 mL·瓶)的 3 批疫苗 HA 含量分别为 64.0、66.4 和 64.0 μg / mL,也远高于检测下限 52.8 μg /mL;于 2 ~ 8 ℃存放 24 个月,规格为15 μg /(0.5 mL·瓶)的 HA 含量保持在 32 μg / mL以上,其结果高于检测下限26.4 μg / mL,规格为30 μg /(0.5 mL·瓶)的 HA 含量维持在 63 μg / mL以上,也高于检测下限52.8 μg / mL,表明疫苗在2 ~8 ℃条件下至少可存放24 个月。综上所述,本研究中甲型H7N9 流感病毒全病毒灭活疫苗具有良好的稳定性。

