麻疹疫苗株Schwarz 反向遗传系统的建立
陈宗香,张勇侠,高雅丽,康庄,罗心梅,丛聪,李立,刘兰军
成都生物制品研究所有限责任公司,四川成都610023
2019 年,菲律宾、中国香港、美国多州等多地暴发麻疹疫情;美国疾病控制与预防中心网站显示,未接种疫苗儿童的比例已翻倍,超10 万婴幼儿未接种任何疫苗[1]。由于麻疹具有极强的感染性,因此,接种麻疹疫苗是控制麻疹传播最有效的方法。
麻疹病毒(measlesvirus,MV)属副黏病毒科(Paramyxoviridae)麻疹病毒属(Morbillivirus),基因组全长为15 894 个核苷酸[2]。世界上广泛使用麻疹减毒疫苗株的母本株是Edmonston 野毒株,如AIKC、Zagreb、Schwarz 及 Moraten 疫苗株[3]。Edmonston野毒株经传代适应,获得麻疹减毒株Edmonston A及B。这两种减毒株分别在鸡胚细胞上继续传代及低温传代适应获得更为减毒的Schwarz 及Moraten疫苗株。研究表明,麻腮风水痘四联疫苗中,英国GSK 公司麻疹疫苗株Schwarz(MVSW)及美国默沙东公司的麻疹疫苗株Moraten 序列的核苷酸和蛋白质序列完全一致[4]。目前,Schwarz / Moraten 疫苗株是世界范围内使用最广泛的麻疹疫苗株[5]。
本研究利用反向遗传系统,将MVSW株全长cDNA连接至载体pT7-MCS2,构建MV 全长质粒pT7MVSW,将其与3 个辅助质粒及表达T7RNA 聚合酶的质粒(pT7-T7RNAP 及pCDIBP-T7RNAP)共电转染Vero细胞,拯救获得rMVSW。旨在为进一步开发以rMVSW为载体的新疫苗的研究提供理论依据。
1 材料与方法
1.1 细胞、疫苗株及质粒 P141 代Vero 细胞、原代鸡胚细胞(chick embryo cells,CEC)、麻疹沪191 疫苗株(MVS191)、质粒 pT7-T7RNAP 及 pCDIBP-T7RNAP均由成都生物制品研究所有限责任公司制备和保存;载体pT7-IRES His-CDNA 购自日本TaKaRa 公司。
1.2 主要试剂 高纯度病毒RNA 提取试剂盒购自瑞士 Roche 公司;Phusion 高保真 DNA 聚合酶、T4 DNA连接酶及限制性内切酶购自美国NEB 公司;随机引物及SuperscriptⅢ反转录酶购自美国Invitrogen 公司;pGEM-T 载体连接试剂盒及胶回收试剂盒购自美国Promega 公司;质粒提取试剂盒购自美国Omega公司;琼脂糖及DNA marker 购自日本TaKaRa 公司;MEM 培养液及胎牛血清(FBS)培养液购自美国Gibco公司;电转缓冲液购自美国BTX 公司。
1.3 实验动物 SPF 级昆明小鼠30 只,雌性,体重15 ~20 g,3 ~4 周龄,由成都生物制品研究所有限责任公司动物实验中心提供,动物合格证号:SCXK(川)2016-126。
1.4 全长质粒及辅助质粒的构建
1.4.1 载体pT7-IRES His-C DNA 的改造 以pT7-IRES His-C DNA 载体为模板,pT7mk-IRES-NotⅠ[5′-AGCGGCCGCTGATGCGGTATTTTCTCCTTAC-3′(下划线部分为NotⅠ酶切位点)]及pT7-IRES-NheⅠ[5′-TAGCTAGCAAGCTTGGCGTAATCATG-3′(下 划线部分为NheⅠ酶切位点)]为引物,PCR 扩增获得载体骨架,胶回收PCR 片段。由苏州金唯智生物科技有限公司合成限制性内切酶多克隆位点NheⅠ-AscⅠ-SacⅡ-KasⅠ-BamHⅠ-SpeⅠ-KpnⅠ-NcoⅠ-NotⅠ核苷酸序列MCS2,MCS2 通过NheⅠ和NotⅠ酶切位点与载体PCR 扩增产物连接,改造后的载体命名为pT7-MCS2。
1.4.2 全长质粒克隆的构建 参照麻疹毒株MVSW的基因组序列(GenBank:FJ211590.1),将MVSW全长 cDNA 序列 15 384 bp 分为 F1 ~ F7 共 7 个片段(由苏州金唯智生物科技有限公司分段合成)。参考文献[4]在F1 片段序列的5′端插入T7 启动子及锤头核酸酶序列(hammerhead ribozyme,HamRz)。参考文献[5]在F7 片段序列的3′端插入T7 终止子及丁型肝炎病毒核酶序列(HdvRz),MVSW全长cDNA 分段构建示意图见图1。将基因片段F1 ~F7 分别克隆至载体pT7-MCS2 上,获得pT7-MCS2-F1 ~pT7-MCS2-F7 共7 个重组质粒。7 个重组质粒依据酶切位点按顺序拼接MVSW全长cDNA。
构建流程:将pT7-MCS2-F1 质粒中F1 片段通过酶切位点AscⅠ-SacⅡ克隆至pT7-MCS2-F2 质粒,获得质粒 pT7MVSW-F12;将 pT7-MCS2-F4 质粒中 F4 片段通过酶切位点BamHⅠ-SpeⅠ克隆至pT7-MCS2-F3 质粒,获得质粒 pT7MVSW-F34;将 pT7-MCS2-F5质粒中F5 片段通过酶切位点SpeⅠ-KpnⅠ克隆至pT7-MCS2-F6,获得质粒pT7MVSW-F56;将pT7-MCS2-F7 质粒中F7 片段通过酶切位点NcoⅠ-NotⅠ克隆至pT7-MCS2-F56 质粒,获得质粒pT7MVSW-F567;将该质粒中F567 片段通过酶切位点SpeⅠ-NotⅠ克隆至pT7MVSW-F34 质粒,获得质粒pT7MVSW-F34567;将该质粒中F34567 片段通过酶切位点KasⅠ-NotⅠ克隆至pT7MVSW-F12 质粒,构建质粒pT7MVSW,用BamⅠ、NdeⅠ及SpeⅠ进行酶切验证。
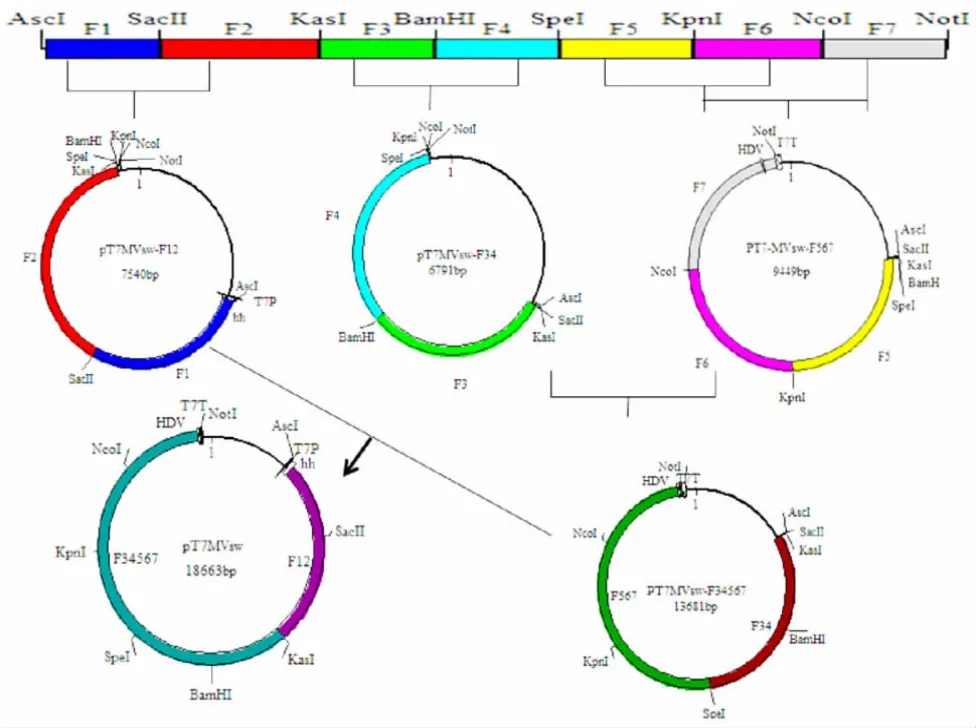
图1 MVSW 全长分段构建示意图Fig.1 Fractional construction of full-length cDNA of MVSW
1.4.3 辅助质粒的构建 MVSW核蛋白 N 基因(SWN)经 NcoⅠ、BamHⅠ、SpeⅠ3 个酶切位点分为2 段(1 ~ 67 及 68 ~ 1 578 bp),与 pT7-IRES His-C DNA 载体连接,构建辅助质粒pT7-SWN。MVSW磷蛋白 P 基因(SWP)经 NcoⅠ/ XbaⅠ双酶切,克隆至pT7-IRES His-C DNA 载体,构建辅助质粒pT7-SWP。MVSW大蛋白 L 基因(SWL)经 NcoⅠ、EcoRⅠ、NotⅠ3个酶切位点分为 2 段(1 ~ 300 及 301 ~ 6 251 bp),与pT7-IRES His-C DNA 载体连接,构建辅助质粒pT7-SWL。NcoⅠ/NotⅠ酶切鉴定辅助质粒pT7-SWN、pT7-SWP 及 pT7-SWL。
1.5 病毒拯救 将 5 × 105个 /mL 的 P141 代 Vero 细胞用电转缓冲液充分混匀悬浮,加入12 μg pT7-MVSW、8 μg pT7-SWN、4 μg pT7-SWP、1 μg pT7-SWL、2 μg pT7-T7RNAP 及 4 μg pCDIBP-T7RNAP 混匀。混合物转入直径为2 mm 的BioRad 电转杯,电转波型为指数波,电压140 V、电容950 μF 电击1 次。电转染后将细胞移入T25 瓶中,补加5 mL MEM 培养基(含10%FBS),37 ℃,5%CO2培养 24 h 后换液,继续培养至细胞病变效应(cytopathic effect,CPE)约80% ~90%,将感染细胞及上清混合物于-20 ~-30 ℃内反复冻融3 次,收获拯救病毒rMVSW。rMVSW接种单层P141 代 Vero 细胞,33 ℃培养 3 ~ 4 d 收获 P2 代病毒,分别在Vero 及CEC 细胞上传代培养(CEC 细胞代次从 P1 代起计),Vero 细胞培养 3 ~ 5 d 至CPE 达80%以上,CEC 细胞培养 5 ~ 7 d 至 CPE 达 80%以上。将细胞培养瓶4 ℃放置约24 h 后,-70 ℃保存。
1.6 SWN 和 SNPR 基因 RT-PCR 扩增 按 Roche高纯度病毒RNA 取试剂盒说明书提取Vero 及CEC细胞培养的P2 代病毒rMVSW的基因组RNA,利用随机引物将RNA 反转录为cDNA,以其为模板,用引物 MA2-S(5′-AGTAGGAGTGGAACTTGAAAACTCC-3′)和 MA2-R(5′-CAGTTTCAACATCAGAAGCCCTG-3′)扩增 rMVSW部分 SWN 和 SNP 基因,扩增产物经1%琼脂糖凝胶电泳鉴定后进行T 克隆,挑选2 个阳性克隆送苏州金唯智生物科技有限公司测序。
1.7 病毒滴度的检测 采用终点稀释法检测病毒滴度,Reed-Muench 法计算细胞半数感染剂量(CCID50)。rMVSW在 P142 ~ 150 代 Vero 细胞上传代培养,取 P1 ~ 10 代病毒,于-20 ~ -30 ℃冻融 1 次,收集病毒液,用MEM 培养基(含2% FBS)进行10倍系列稀释,共8 个稀释度,接种至96 孔板培养的Vero 细胞中,100 μL / 孔,每个稀释度接种 8 个孔,37 ℃,5% CO2培养 7 d 后判定。
1.8 病毒生长曲线的绘制 将Vero 细胞中传至P4代的rMVSW病毒液用MEM 培养基(含2% FBS)适当稀释,按MOI 为0.03 感染T225 瓶中Vero 细胞,采用吸附方式进行接种,33 ℃吸附0.5 h;补加MEM 培养基(含2% FBS)至终体积为40 mL,33 ℃培养。于感染后 24、48、72、96、120、144 及 168 h 分别取培养液上清0.5 mL。采用终点稀释法检测病毒滴度。以时间为横坐标,滴度为纵坐标,绘制病毒生长曲线。
1.9 免疫原性的检测
1.9.1 小鼠免疫 将昆明小鼠随机分为3 组,疫苗株 MVS19(1滴度 6.0 lgCCID50/ mL)组、rMVSW(滴度6.25 lgCCID50/ mL)组及 MEM 培养基(空白对照)组,每组10 只。小鼠经腹腔免疫,1 mL / 只,免疫2次,间隔21 d。末次免疫14 d 后心脏穿刺采血,分离血清,56 ℃灭活30 min,检测血清中和抗体效价。
1.9.2 血清中和效价的测定 采用微量CPE抑制法。将疫苗株MVS191及病毒rMVSW稀释至2×103CCID50/mL,待测血清进行 1 ∶10、1 ∶20、1 ∶40、1 ∶80、1 ∶160、1 ∶320 稀释,接种 96 孔板,50 μL / 孔,每个稀释度设8个复孔;待测血清分别与等剂量MVS191及rMVSW混合,37 ℃,5% CO2中和 1 h;每孔加入 100 μL Vero细胞(1 × 105个 / mL),37 ℃,5% CO2培养 7 d;观察CPE 情况。抑制50% CPE 的最高稀释度为抗体中和效价,以稀释倍数的倒数表示。
2 结 果
2.1 载体pT7-MCS2 的鉴定 经1%琼脂糖凝胶电泳分析,载体pT7-MCS2 的BamHⅠ及NcoⅠ单酶切产物均可见3 000 bp 的单一条带;SacⅡ/ SspⅠ双酶切产物可见600 及2 400 bp 的条带,大小均与预期相符,见图2。
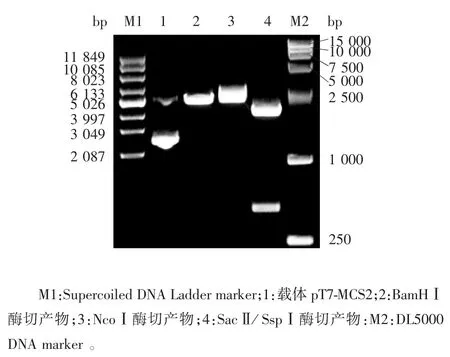
图2 载体PT7-MCS2 的酶切鉴定Fig.2 Restriction map of vector pT7-MCS2
2.2 全长质粒及辅助质粒的酶切鉴定 BamHⅠ将全长质粒pT7MVSW酶切为3 个片段,大小分别为2 769、4 040 及 11 853 bp;NdeⅠ将全长质粒酶切成4 个片段,大小为 936、1 898、2 681 及 13 147 bp;SpeⅠ将全长质粒酶切成2 个片段,大小为5 802 及13 028 bp。经1%琼脂糖凝胶电泳分析,各酶切条带大小均与预期一致。见图3。辅助质粒pT7-SWN、pT7-SWP 及pT7-SWL 的双酶切产物所得目的基因片段条带数目及大小均与预期一致,见图4。表明全长质粒及辅助质粒均构建正确。
2.3 病毒rMVsw 病变特征 显微镜观察显示,病毒rMVSW与疫苗株MVS191在Vero 和CEC 细胞上均出现以肿胀为主的病变,部分相邻细胞融合形成典型的合胞体型病变,且病变特征类似,见图5。
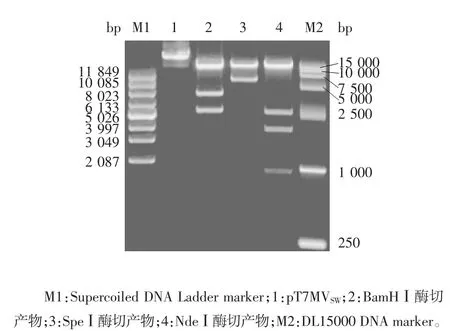
图3 全长质粒pT7MVSW 的酶切鉴定Fig.3 Restriction map of full-length plasmid pT7MVSW
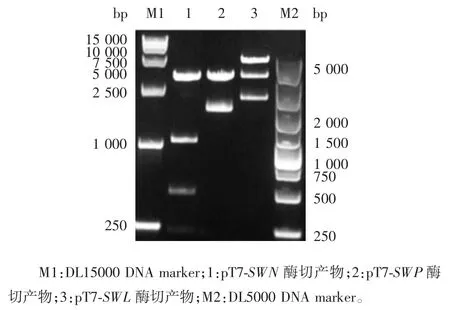
图 4 辅助质粒 pT7-SWN、pT7-SWP 及 pT7-SWL 的双酶切(NcoⅠ/ NotⅠ)鉴定Fig.4 Restriction map of helper plasmids pT7-SWN,pT7-SWP and pT7-SWL(NcoⅠ/ NotⅠ)

图5 rMVSW感染Vero 及CEC 细胞的显微镜观察(×100)Fig.5 Microscopy of Vero and CEC cells infected with rMVSW(× 100)
2.4 RT-PCR 产物的鉴定 经1%琼脂糖凝胶电泳分析,引物MA2-S 和MA2-R 扩增产物可见1 230 bp的条带,大小与预期一致,空白对照无条带,见图6。Vero 及CEC 中2 代病毒rMVSW扩增片段序列测序结果与MVSW的理论序列一致,引物对MA2-S 和MA2-R 扩增产物与 MVSW序列 1 120 ~ 2 350 bp 一致。
2.5 病毒滴度 P1代rMVSW的滴度低于4.5lgCCID50/mL,传代后病毒滴度升高,P2 ~10 代病毒滴度稳定在5.5 ~6.5 lgCCID50/ mL 之间,见图 7。
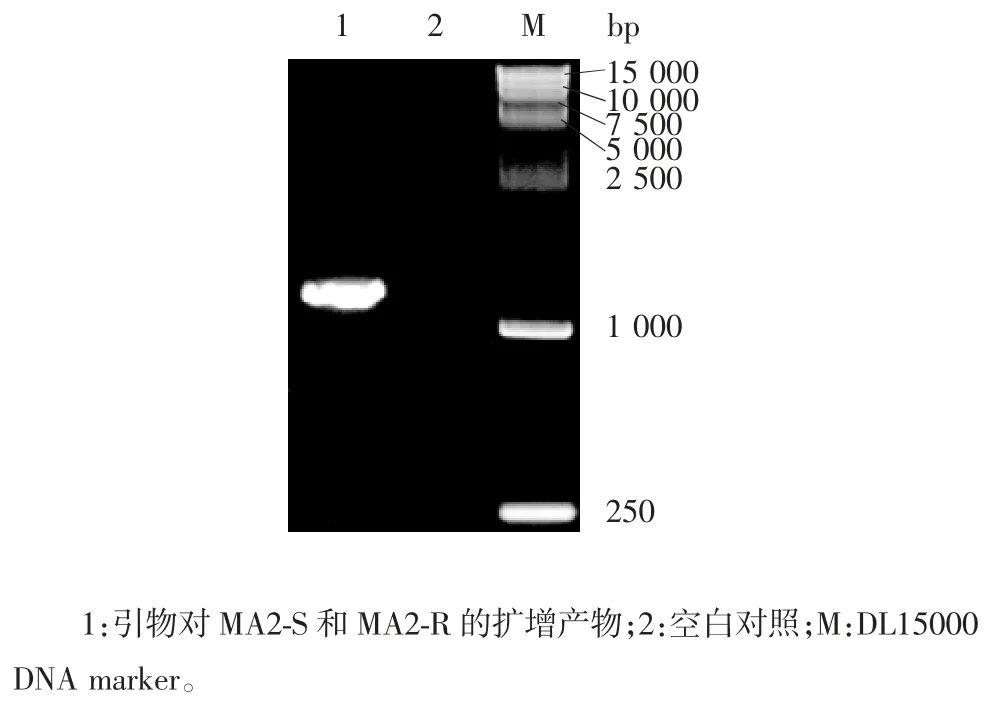
图6 重组病毒的RT-PCR 鉴定Fig.6 Identification of rMVSW by RT-PCR
图 7 P1 ~ P10 代病毒 rMVSW 滴度Fig.7 Titers of rMVSW virus of passages 1 ~10
2.6 病毒生长曲线 接种24 h 内,P4 代病毒rMVSW滴度较低,随后病毒呈增殖状态,滴度持续上升,144 h 达最高值 7.5 lgCCID50/ mL,之后病毒滴度逐渐降低,见图8。
图8 P4 代rMVSW 的生长曲线Fig.8 Growth curve rMVSW of four passages
2.7 抗体中和效价 结果显示,rMVSW组及疫苗株MVS191组免疫血清对病毒MVS191和rMVSW的中和抗体效价均大于320,MVS191组免疫血清可中和病毒rMVSW,见表1。表明病毒rMVSW与疫苗株MVS191的免疫原性相当。
表1 rMVSW 株及疫苗株MVS191 免疫血清中和抗体滴度Tab.1 Neutralizing antibody titers of rMVsw and vaccine strain MVS191
3 讨 论
人用疫苗必须保证产品的安全性及免疫原性,用于疫苗生产的细胞基质必须避免潜在的病原体污染,而原代细胞基质很难避免这种污染[6]。Vero 细胞作为可用于疫苗生产的细胞系,已被批准用于多种病毒疫苗的生产[7],如口服脊髓灰质炎减毒活疫苗、轮状病毒减毒活疫苗及将黄病毒YFV17D 膜蛋白替换为乙型脑炎病毒SA14-14-2 株prM / E 蛋白的嵌合疫苗 Imojev[8-10]。
MVSW反向遗传系统在Vero 细胞上电转拯救麻疹病毒rMVSW株,首先利用Vero 细胞的RNA 聚合酶Ⅱ结合人巨细胞病毒启动子,驱动pCDIBP-T7RNAP质粒转录,表达T7RNA 聚合酶;表达的T7 RNA 聚合酶进一步与pT7-TRNAP 载体上T7 启动子结合驱动T7RNA 聚合酶表达,利用两种表达T7RNA 聚合酶的质粒放大T7 RNA 聚合酶的表达,使细胞内的T7 RNA 聚合酶快速累积,利于全长质粒的转录及3个辅助质粒的表达,提高病毒拯救效率。
国产麻疹-流行性腮腺炎-风疹联合减毒活疫苗(measles,mumps,and rubella vaccine,MMR)中麻疹疫苗以减毒活疫苗株MVS191为毒种,国外MMR 疫苗中麻疹疫苗以减毒活疫苗株Schwarz / Moraten 为毒种。研究表明,国产MMR 组与GSK MMR 组接种12 月龄儿童麻疹抗体阳转率均大于95%[11]。本实验将拯救病毒rMVSW及疫苗株MVS191分别免疫小鼠,可诱导抗病毒MVS191和rMVSW的中和抗体,且诱导抗体对于MVS191及rMVSW均有交叉中和能力,表明拯救病毒rMVSW与MVS191株相比免疫原性相当。
本研究中,MVSW在Vero 细胞里完成病毒拯救及增殖,病变符合麻疹病毒的典型特征,成功建立了病毒rMVSW的反向遗传系统。该反向遗传系统中拯救、培养病毒用基质Vero 细胞符合疫苗生产法规,在病毒基因水平及Vero 细胞稳定传代上证实了拯救病毒rMVSW株具有良好的遗传稳定性,其免疫原性与国产毒株MVS191相当,具有作为疫苗生产用毒种的潜力。

