流感病毒神经氨酸酶及其疫苗的研究进展
邓涛 ,张家友 综述, 杨晓明 审校
1.武汉生物制品研究所有限责任公司,湖北武汉430207;2.国家联合疫苗工程技术研究中心,湖北武汉430207;3.中国生物技术股份有限公司,北京100029
流行性感冒(简称流感)是一种由流感病毒引起的急性呼吸道传染病。据WHO 统计,每年季节性流感可造成约65 万人死亡[1]。目前,有多种抗病毒药物用于治疗人类季节性流感,但耐药性日趋严重[2],接种疫苗成为预防流感最有效的方法[3]。流感病毒血凝素(hemagglutinin,HA)和神经氨酸酶(neuraminidase,NA)是流感裂解疫苗的主要抗原,由于HA 与流感病毒毒株匹配程度存在差异,使流感疫苗的有效性每年也会有所不同[4-5]。FLANNERY 等[6]对2016 — 2017 年季节性流感疫苗的有效性进行统计分析,结果显示,疫苗有效率为19% ~48%。除HA外,流感疫苗的效力可能还受流感病毒其他抗原影响,研究表明,若疫苗中HA 抗原与当年流感病毒HA有显著差异,NA 免疫诱导的特异性抗体为流感重症患者提供了重要的保护作用[7]。研究发现,许多NA特异性抗体可结合在同一NA 亚型中的保守抗原表位上,保护机体免受异种病毒的侵袭[8-9],表明基于。NA 设计的疫苗可能成为一种通用流感疫苗,NA 特异性抗体可有效抵御流感病毒感染[10],因此NA 抗体滴度与流感减毒活疫苗及灭活疫苗的有效性密切相关。但NA 特异性抗体作用效果的评价方法及准确量化多价流感疫苗中NA 含量的方法尚需进一步深入研究。本文就流感病毒NA 及基于NA 流感疫苗的研究进展作一综述。
1 NA 的结构及功能
流感病毒是有包膜的单股负链RNA 病毒,其分节段的RNA 编码至少10 种独立的蛋白质,包括2 种表面糖蛋白HA 和NA。A 型流感病毒根据NA 抗原性分为9 个亚型(N1 ~N9),B 型和C 型流感病毒不分亚型。A 型流感病毒NA 根据进化亲疏程度分为2 组,Group 1(包括 N1、N4、N5、N8)和 Group 2(包括N2、N3、N6、N7、N9),在蝙蝠身上分离出来的 N10 和N11 亚型流感病毒与A 及B 型流感病毒的NA 关系均较远,目前尚未发现其有NA 活性。见图1。NA是典型的Ⅱ型跨膜蛋白,由4 个完全相同的单体非共价结合形成的蘑菇状四聚体。NA 蛋白通常是由450 ~480 个氨基酸残基组成,可分为4 个主要区域,分别为位于氨基末端的亲水胞浆区、疏水跨膜区、高度多变的茎部及具有酶活性的头部[11]。胞浆区包括不同亚型中高度保守的6 个氨基酸(MNPNQK),该序列在A 型流感病毒中高度保守,但其功能尚未明确;跨膜区是蛋白合成、折叠及内质网运输过程中的信号肽[12];茎部结构在不同亚型甚至同一亚型中具有较大差异;头部的保守氨基酸数量最多[13]。
NA 是流感病毒传播所必需的蛋白之一,其通过水解宿主细胞膜上的病毒唾液酸受体,防止子代病毒在细胞表面聚集,促进病毒颗粒的释放,从而使整个病毒复制周期顺利完成[14-15]。有研究表明,NA 可能在促进病毒对呼吸道上皮细胞的识别中发挥作用,NA 通过降解呼吸道表面含唾液酸的黏蛋白,降低黏液层黏度,从而暴露出宿主细胞受体,使病毒更易结合至易感细胞表面[16]。还有研究报道了一种新机制,即NA 在病毒感染的初始阶段促进病毒进入靶细胞[17],从而提高病毒感染效率。
2 NA 基因的相对保守性
作为缺乏RNA 校正酶的分节段病毒,流感病毒具有较高的突变率。研究表明,NA 的年突变率低于HA,分别为0.45%~1.01%和1%~2%[18]。WESTGEEST等[19]对 1968 — 2011 年流行的 H3N2 全基因组进行统计分析,结果表明,HA0、HA1、HA2 氨基酸的年平均突变率分别为1.08%、1.49%、0.14%,而NA氨基酸的年平均突变率为0.91%。对NA 抗原漂移的单独研究表明,HA 和NA 的抗原变化是相互独立的[20]。因此,当HA 发生抗原漂移时,NA 免疫可能提供一定程度的保护,如1968 年的流感大流行,H2N2 流感病毒的抗体有助于抵御H3N2 病毒感染。当抗原发生变化时,NA 对同一亚型内的异源病毒具有广泛的保护作用,表明一些NA 是相对保守的[21];再如,2009 年流感大流行中,老年人群中的发病率相对较低,主要原因可能是老年人群体内已存在2009 年前流行的H1N1 流感病毒的NA 特异性抗体[22]。CHEN 等[10]还发现,流感病毒感染过程中诱导的NA 特异性抗体比HA 特异性抗体具有更广泛的反应性,且保护作用和中和效力也与HA 特异性抗体相当。
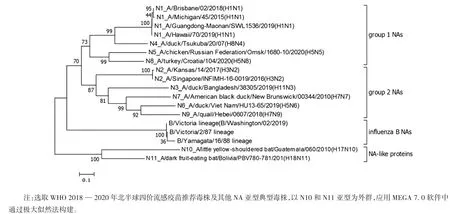
图1 流感病毒NA 基因进化树分析Fig.1 Phylogenetic tree of NA gene of influenza virus
3 NA 的免疫原性及免疫机制
NA 具有较强的免疫原性,在动物和人类机体中能够诱导产生NA 特异性抗体,该抗体在预防感染、抑制病毒扩散、减轻临床症状及增强疫苗效力方面发挥重要作用。研究表明,自然感染和免疫接种产生的NA 特异性抗体均具有独立的保护作用[23],人接种了减毒活疫苗及灭活流感疫苗后均观察到NA 特异性抗体滴度有所提高[8-9]。一项临床研究显示,健康成人受到H1N1pdm09(A/California/7/2009)挑战时,显示HA 和NA 特异性抗体在免疫中的作用存在明显差异[24]。病毒脱落程度与HA 抑制性(hemagglutinin-inhibition,HI)抗体滴度相关,但NA 抑制性(NA- inhibition,NI)抗体滴度与疾病严重程度及症状和病毒脱落持续时间相关。NA 免疫在动物试验中也显示了明显效果,括重组 NA[25]、NA 表达载体[26]和 NA 的病毒样颗粒(virus-like particle,VLP)[27],上述研究中大多数采用了同源、异源及异NA 亚型的流感毒株进行攻毒试验,结果显示,对同源毒株攻击具有最大保护作用,对同NA 亚型的异源毒株具有交叉保护作用,但对于异NA 亚型毒株基本无保护作用。从小鼠和家兔体内分离的NA 特异性抗体可保护动物免受同源和异源流感病毒感染[10,28]。
流感病毒NA 蛋白的免疫反应主要是体液免疫。NA 特异性抗体与感染细胞表面的NA 蛋白结合,通过抗体依赖性细胞介导的细胞毒作用(antibody dependent cell-mediated cytotoxicity,ADCC)和补体依赖性细胞毒作用(complement-dependent cytotoxicity,CDC)清除病毒[29]。NA 特异性抗体有助于预防疾病,可能是在感染初期NA 特异性抗体诱导的一种“允许免疫”(“permissive immunity”)作用[30],该作用可阻止病毒颗粒从感染细胞顶部释放,从而减少病毒的传播数量,具体机制可能包括以下几个方面:直接抑制酶活性;使单个病毒颗粒交联,减少可用于感染宿主细胞的病毒数量;将病毒颗粒与细胞相关的NA 聚集黏合,抑制新生病毒颗粒从宿主细胞脱离。无论是自然感染还是免疫接种,对NA抗原的免疫反应可限制病毒在宿主内的传播,降低发病率和死亡率,从而减少传播给其他易感个体的机会。
4 基于NA 的流感疫苗
基于NA 的流感疫苗类型包括重组亚单位疫苗、核酸疫苗、VLP 疫苗等。各种类型基于NA 设计的流感疫苗方案主要目的均是诱导机体产生NI 抗体,以获得更广泛的交叉保护作用。
4.1 重组亚单位疫苗 LIU 等[9]利用杆状病毒-昆虫表达系统表达的重组H5N1 NA 蛋白免疫小鼠,可产生 NA 特异性抗体,使用 H5N1、pH1N1(CA / 09)或H7N9 流感病毒进行攻毒试验,结果显示,能够抵抗同源病毒致死量攻击,20 μg 剂量组对异源H5N1流感病毒攻击的保护率为60%,但对异亚型H7N9 无论剂量大小均无保护作用;WOHLBOLD 等[25]利用杆状病毒表达系统制备了N1 ~N8 的重组NA 蛋白,接种小鼠后进行攻毒试验,结果显示,重组NA 蛋白能够对同源、异源非异NA 亚型流感病毒提供广泛保护,但对异NA 亚型病毒无交叉保护作用;BOSCH等[31]利用无细胞表达系统表达了可溶性四聚体NA蛋白,免疫雪貂后进行同源H1N1 病毒攻击,结果显示,显著减轻了感染的临床症状。
4.2 核酸疫苗 CHEN 等[32]构建了A/PR/8 /34(PR8,H1N1)和 A / Chicken Henan / 12 / 2004(H5N1)株流感病毒NA-DNA 疫苗,在小鼠模型中可提供同源病毒的保护作用;CHEN 等[33]制备了 N2-DNA 疫苗,通过表达HA 和NA 可增强对致死剂量流感病毒挑战的保护;目前,美国Protein Sciences 公司研发的FluNhance(重组NA 亚单位疫苗)已完成Ⅱ期临床试验[34]。
4.3 载体疫苗 KINGSTAD 等[35]构建了 H5N1 NA的浣熊痘病毒(raccoon poxvirus,RCN)载体疫苗,免疫小鼠后,能够抵抗致死量同源病毒攻击,对H3N2 流感病毒有 20%保护作用;LEI 等[26]构建了 H5N1 NA 的乳酸球菌NZ9000 载体疫苗,能够抵抗同源病毒攻击。
4.4 VLP 疫苗 EASTERBROOK 等[27]制备了 H1N1-pdm09 的NA VLP 疫苗,在小鼠的攻毒模型中,不仅可以抵抗H1N1pdm09 的致死剂量攻击,还可抵抗同NA 亚型的的H5N1 致死剂量攻击,同时能够有效降低病毒感染后肺部病毒载量。WU 等[36]利用Vero细胞制备H5N1 NA 的VLP 疫苗,在小鼠动物模型中可产生良好的免疫应答反应,能抵抗致死剂量H5N1及H1N1 流感病毒的攻击。
4.5 联合其他流感病毒蛋白的NA 疫苗 WU 等[36]构建了 H5N1 NA、M2e、HA 的 VLP 疫苗,联合免疫这3 种疫苗,动物能够产生比单独使用NA 疫苗更为广谱的保护作用。
5 NA 流感疫苗面临的挑战
基于NA 研发流感疫苗具有良好的应用前景,但目前尚未建立统一的定量检测NA 的标准和方法。缺乏一种实用的分析方法来测定多价流感疫苗NA 含量,是制约流感疫苗质量评价的瓶颈之一。NA酶活性是反映其天然结构的良好指标,与免疫原性密切相关。酶活性测定通常以4-MUNANA 作为底物,通过测定NA 催化底物分解后产物的荧光强度,用以评价NA 酶活性。但该方法不能区分NA 的亚型,不适合测量三价和四价季节性流感疫苗中的NA含量。另外,由于疫苗生产、储存和运输等过程复杂,蛋白酶活性可能已受到影响,因此酶活性的测定不适用于疫苗中NA 的准确定量。考虑到疫苗制剂中的NA 酶活性不稳定等问题,已开发了一种基于质谱的替代方法来定量流感疫苗中的NA[37]。这种同位素稀释质谱(isotope dilution mass spectrometry,IDMS)方法采用同位素标记的多肽来确定每种NA的摩尔量,该标准对每种流感类型和亚型均是特异性的。虽然该分析不能反映NA 的免疫原性,但其提供了一种测量季节性和大流行性疫苗中每种NA 型/亚型的绝对浓度的方法。GRAVEL 等[38]利用生物信息学分析A 型和B 型流感病毒NA 的氨基酸普遍为保守序列,获得两条保守表位多肽(HCA-2 和HCA-3),并制备相应的特异性通用抗体,该通用抗体可用于定量流感疫苗的NA 含量。但HCA-2 和HCA-3 通用抗体仅用于单价疫苗NA 的定量,并不能量化三价/ 四价流感疫苗的NA 含量。XU 等[39]利用类似方法制备了 CNA1、CNA2 及 CNAB 单克隆抗体,CNA1 仅能与N1 亚型反应,CNA2 仅能与N2 亚型反应,而CNAB 仅能与B 型流感病毒的NA 特异性反应,因此,这些抗体可用于定量三价流感疫苗的NA 含量。
除了NA 的定量分析,还需要一种预测免疫原性的试验(即效价试验),对NA 特异性抗体进行定量分析。NA 的免疫原性可通过测定结合或抑制NA的抗体滴度来评价。硫代巴比妥酸(thiobarbituric acid,TBA)试验是最先用于测量NA 抗体效价的方法,由于操作繁琐,还需使用危险化学品,目前已被其他方法取代。酶联凝集试验(enzyme linked lectin assay,ELLA)准确度和精密度高,是一种测定NA 特异性抗体效价的替代方法,且还可用于评估流感病毒NA 的抗原漂移[40-42]。目前,广泛应用的酶联免疫吸附试验(enzymelinkedimmunosorbentassay,ELISA)则是在ELLA 上进一步升级,解决了ELLA 不能满足高通量样本检测需求,可用于NA 特异性抗体的检测。
6 小 结
NA 作为季节性流感疫苗及大流行流感疫苗主要成分之一,能够诱导动物和人类产生独立保护作用。因NA 基因的相对保守性及NA 特异性抗体的广泛交叉保护作用,使得基于NA 流感疫苗适用作为通用流感疫苗研究。当NA 和HA 的含量达到病毒包膜上的天然比例,能够诱导一种平衡反应,使流感灭活/裂解疫苗具有更好免疫效果。流感疫苗中NA蛋白的量化及对NA 特异性抗体检定方法的逐步建立,对生产具有广泛保护性的高质量流感疫苗具有重要意义。

