Toll 样受体预活化的人脂肪间充质干细胞对人肺癌H460 细胞生长的抑制作用
邓颖珊,杜晶春,徐霞,谢闺娥,林雪霏,赖斯华
广州医科大学金域检验学院,广东广州510182
肿瘤的发生、生长和转移均离不开肿瘤微环境的作用。肿瘤微环境作为一个复杂的空间,其中包含基质细胞、多种细胞外基质成分和蛋白质,以及大量的信号分子、旁分泌和生长因子等。在肿瘤微环境中,危险相关的分子模式(damage associated molecular patterns,DAMPs)-Toll 样受体(Toll-like receptors,TLRs)复合物能够触发多种复杂细胞相互作用,并可通过动态改变细胞因子环境来控制相互作用的过程[1-2]。TLRs 作为多种模式受体(pattern recognition receptor,PRR),可通过识别广泛存在于微生物病原体中的病原体相关分子模式(pathogen-associated molecular pattern,PAMPs)和DAMPs,从而激活细胞内信号传导途径,触发炎症和抗病毒反应以及树突状细胞(dendritic cells,DC)成熟,继而消除入侵的病原体[3-4]。聚肌胞苷酸(polyinosinic-polycytidylic acid)简称为Poly(I ∶C),是人工合成的双链RNA 类似物,作为TLR3 配体,其可活化除TLR 通路外的RIG-I / MDA5 和 PKR 通路等,从而诱导多种炎症通路介导的信号途径。脂多糖(lipopolysaccharide,LPS)可通过结合存在于宿主细胞膜表面的TLR4 和髓样分化蛋白-2(myeloid differential protein-2,MD-2)形成复合物,引发 NF-κB 转录因子的激活,继而促进促炎因子如TNF-α、IL-6 等的分泌,从而参与多种疾病的发展。
间充质干细胞(mesenchymal stem cells,MSCs)由于其本身的归巢性、天然免疫豁免特性以及可通过自分泌或旁分泌途径分泌多种细胞因子等特性,近年来被应用于抗肿瘤策略研究。MSCs 是一种来源于发育早期的中胚层干细胞,具有多向分化和自我更新能力。其最早于骨髓中被发现,目前还可从脂肪、肌肉、滑膜、脐带、胎盘、羊水等组织中获得。MSCs 主要来源于骨髓,但由于骨髓来源的MSCs 的提取不仅可能对供体造成一定的损伤,而且骨髓中的MSCs 含量较低,因此,获取该来源的MSCs 会在一定程度上受到限制[5]。而脂肪来源的MSCs 具有来源充足,提取方法简便,产量高,增殖快和不涉及伦理问题等优点。
有研究表明,MSCs 对于肿瘤生长的作用具有两个截然不同的效果,即其既可表现出促进肿瘤生长也可表现出抑制肿瘤生长[6-7]。MSCs 对于肿瘤生长发挥的作用取决于其所处的微环境,因此,对MSCs所处的微环境进一步研究,才能安全地将其应用于临床。我们前期研究发现,在人大细胞肺癌细胞H460模型中,MSCs 表现出促进肿瘤生长的作用,但经IFNβ 处理后的MSCs 表现出抑制肿瘤生长的作用,并证明经IFN 刺激的MSCs 能表达肿瘤坏死相关凋亡诱导配体(TNF-related apoptosis-inducing ligand,TRAIL),进而发挥对肿瘤细胞的细胞毒作用,同时也发现,来自凋亡肿瘤细胞的条件培养基也能上调MSCs 中TRAIL 的表达,继而通过这种正反馈增强了由IFNs 引发的MSCs 的抗肿瘤作用[6]。结合相关文献报道[3-4,6],我们推测,凋亡的肿瘤细胞释放的DAMPs 在凋亡细胞促进MSCs 表达TRAIL 这一过程中可能发挥了作用,因此,本研究选取Poly(I ∶C)、LPS 模拟凋亡细胞释放的DAMPs,预活化人脂肪MSCs(human adipose-derived stem cells,hADMSCs),以人肺癌H460 细胞作为代表,研究预活化后的hADMSCs 对肿瘤细胞能否产生抑制其生长的作用。
1 材料与方法
1.1 脂肪组织及细胞 脂肪组织为广州丘山国际美容整形医院整形外科抽脂手术遗弃组织,用于实验均知情同意,符合医学伦理标准;人肺癌H460 细胞来自ATCC 细胞库的贴壁细胞,人肺癌细胞H460-EGFP由本学院前期构建,于含10%胎牛血清、1%青霉素-链霉素双抗溶液的RPMI1640 培养基中培养。
1.2 主要试剂及仪器 低糖DMEM(L-DMEM)培养基粉末、RMPI1640 培养基粉末、胎牛血清、青霉素-链霉素双抗溶液和0.25%胰酶-0.2% EDTA 均购自美国 Gibco 公司;Recombinant Human FGF-basic 购自美国 Pepro Tech 公司;Ⅰ型胶原酶、Poly(I ∶C)、LPS 和兔抗GAPDH 多克隆抗体购自美国Sigma 公司;兔抗TRAIL 单克隆抗体购自美国Cell Signaling Technology 公司;过氧化物酶偶联的羊抗兔二抗购自台湾Arigo Biola-boratories Corp.公司;Cell Counting Kit 8 购自日本东仁化学公司;间充质干细胞成骨诱导试剂盒和成脂诱导试剂盒购自广州赛莱拉科技股份有限公司;流式分析用抗体购自美国BD 公司和天津三箭生物技术有限公司;ELISA 试剂盒购自深圳欣博盛生物科技有限公司;增强的化学发光信号试剂盒购自美国Millipore 公司;细胞成像仪和酶标仪购自美国Bio-Tek 公司;流式分析仪购自美国Beckman 公司。
1.3 hADMSCs 的收集、培养和传代扩增 无菌条件下将脂肪抽吸后的液体74 × g 离心3 min,取上层悬浮的脂肪组织,用PBS 漂洗,再74 × g 离心 5 min,漂洗,取上层脂肪组织,重复操作2 次;加入2 倍体积的0.2%胶原酶,37 ℃摇床消化45 min ~1 h;消化后的糊状消化液用100 目不锈钢筛网过滤,收集滤液,260 × g 离心 5 min,弃上清,用 1 mL L-DMEM 重悬,再加入5 mL 红细胞裂解液,室温下静置10 min;260 × g 离心 5 min,弃上清,PBS 反复漂洗后,用 LDMEM(含体积分数为20%的胎牛血清,1%的青霉素-链霉素)重悬细胞,接种至25 cm2培养瓶中,置于37 ℃,体积分数为 5% CO2的培养箱中培养;48 h 后首次半量换液,待细胞培养至75% ~90%融合时,计数,用 0.25%胰酶 1 ∶3 消化传代,每 3 ~ 4 d 消化传代1 次,连续传3 代后,获得形态均一的MSCs。用25 μg / mL 的 Poly(I ∶C)或 0.1 mg / mL 的 LPS 对hADMSCs 诱导12 h,观察诱导后细胞形态的变化。
1.4 细胞生长曲线绘制 取第6 代培养的hADMSCs,消化后铺于 24 孔板内,10 000 个 / 孔,37 ℃,5% CO2培养箱培养,待细胞贴壁良好,贴壁后的第1、3、5、7、9 天,用CCK8 试剂盒对细胞进行计数:每孔加入10 μL CCK8 试剂,反应 30 min 后,用酶标仪检测490 nm 处吸光度,每次测4 个孔,取平均值。
1.5 细胞表面标志的鉴定 hADMSCs 长至90%后,将细胞分为3 组:对照组(未经刺激,仅更换培养基)、Poly(I ∶C)诱导组[加入 25 μg / mL Poly(I ∶C)刺激 12 h]和 LPS 诱导组(加入 0.1 mg / mL LPS 刺激12 h)。用0.25%胰酶消化细胞,166 × g 离心3 min,弃上清,PBS 漂洗2 次,均分至各个离心管中,加入相应抗体,4 ℃下避光45 min;离心弃上清,每管加入 500 μL PBS 重悬,166 × g 离心 3 min 去除未标记抗体,弃上清,每管加入200 μL PBS 重悬沉淀,上流式细胞仪检测细胞表面抗原CD34、CD44、CD45、CD73、CD90、CD105、HLA-ABC。
1.6 hADMSCs 的体外诱导分化
1.6.1 成骨诱导分化 将传代扩增后的第4 代hADMSCs 按 2 × 105个 /mL 的密度接种于 6 孔板中,每孔加入2.5 mL 培养基,置于37 ℃,5% CO2,95%湿度培养箱中常规培养。待细胞融合达60%后,吸弃孔内培养液,PBS 漂洗3 次,弃去PBS,将细胞分为4 组:对照组(加入L-DMEM)、普通诱导组(加入2.5 mL 成骨诱导分化完全培养基)、Poly(I ∶C)诱导组[加入 25 μg / mL Poly(I ∶C)和成骨诱导分化完全培养基]和 LPS 诱导组(加入 0.1 mg / mL LPS 和成骨诱导完全培养基),每3 d 更换1 次成骨诱导分化完全培养基和L-DMEM 培养基,至诱导培养3 周时,进行茜素红钙结节染色。
1.6.2 成脂诱导分化 细胞分组及处理同1.6.1 项,仅将成骨诱导完全培养基更换为成脂诱导完全培养基,至诱导培养第19 天进行油红O 染色。
1.7 Pol(yI ∶C)或LPS诱导后的hADMSCs分泌IFNβ含量的测定 经 5 和 25 μg / mL Poly(I ∶C)、0.1和0.5 mg / mL LPS 刺激 hADMSCs 12 h 后,收集培养基上清,以未经刺激的细胞作为对照,按照ELISA试剂盒说明检测上清液中的IFNβ 浓度。
1.8 Poly(I ∶C)预处理的 hADMSCsTRAIL 表达的检测 采用 Western blot 法。分别用 5、25、50 μg / mL Poly(I ∶C)预处理 hADMSCs 12 h,以未经 Poly(I ∶C)处理的细胞作为对照,用预冷的PBS 洗涤细胞后,细胞裂解缓冲液裂解,离心除去不溶物,BCA法测定上清液中的蛋白质浓度。经12% SDS-PAGE 分离每组中相同量的蛋白质,转移至PVDF 膜上,用0.1%Tween-20、含 5%脱脂奶粉的 TBS(TBS / T)溶液于室温下封闭 1 h;加入兔抗 TRAIL 抗体(1 ∶1 000 稀释)或兔抗 GAPDH 抗体(1 ∶7 500 稀释),4 ℃孵育过夜;再加入过氧化物酶偶联的羊抗兔二抗(1 ∶10 000 稀释),室温下孵育1 h;用增强的化学发光信号试剂盒检测。
1.9 Poly(I ∶C)诱导的 hADMSCs 与 H460 细胞共培养后靶细胞活性的检测
1.9.1 CCK8 法 将传代扩增后的第5 代hADMSCs消化计数后,按每孔10 000 个细胞的密度接种于96孔板中,共接种3 块板,待细胞长至80%时,分别用0、5、10、25、50 μg / mL 的 Poly(I ∶C)提前刺激 12 h,每个浓度设 3 个孔,再按照 2 ∶1、1 ∶1、1 ∶2 的比例分别将H460 细胞加入板中共培养48 h。用CCK8 试剂盒测定细胞数量∶吸弃旧培养液,每孔加入100 μL新培养液,再加入10 μL 试剂,反应30 min,用酶标仪测定450 nm 和630 nm 处的吸光度,计算增量。每次测3 个孔,取平均值。
1.9.2 显微镜观察 将传代扩增后的第5 代hADMSCs按 1 × 105个 / mL 的密度接种于 6 孔板中,待细胞长至80%,加入Poly(I ∶C)提前刺激hADMSCs 12 h,以未经Poly(I ∶C)刺激的细胞作为对照,按照2 ∶1、1 ∶1、1 ∶2 比例,将消化计数后的 H460-EGFP 加入6 孔板中共培养48 h,细胞成像仪观察共培养情况。利用Image-pro plus 统计H460-EGFP 在共培养体系中的数量(对照组计为1)。
1.10 统计学分析 采用Prism 8 统计学软件进行统计学分析,实验数据中计量资料以表示,组间比较采用方差分析,以P <0.05 为差异有统计学意义。
2 结 果
2.1 hADMSCs 的形态 原代细胞培养24 h 后,光学显微镜镜下可见呈纺锤形、梭形的贴壁细胞散在分布。继续培养一段时间,细胞形态逐渐均一,呈纤维样或鱼群样排列,见图1A。待细胞融合至80% ~90%时进行细胞传代,第3 代hADMSCs 细胞均一稳定,第15 代之前细胞形态无明显变化,均呈纤维样。经 Poly(I ∶C)和 LPS 诱导后,hADMSCs 形态未见明显变化,见图1B 和1C。

图 1 第 6 代 hADMSCs 的形态(× 40)Fig.1 Morphology of hADMSCs of passage 6(× 40)
2.2 细胞生长曲线 第6 代细胞接种后,1 d 后贴壁,3 d 内缓慢生长,3 ~7 d 进入对数生长期,第7 ~9 天细胞达生长平台期,见图2。
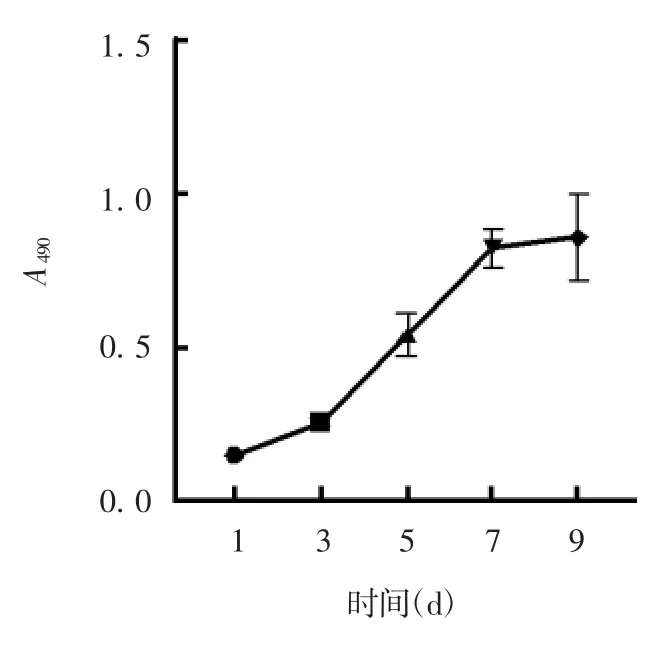
图2 第6 代hADMSCs 的生长曲线Fig.2 Growth curve of hADMSCs of passage 6
2.3 细胞表面标志鉴定 流式细胞仪分析结果显示,MSCs 特异性标志物 CD44、CD73、CD90、CD105、HLA-ABC 的阳性率分别为(99.48 ± 0.73)%、(98.29 ±0.64)%、(98.12 ± 1.24)%、(97.74 ± 1.87)%和(98.97 ± 1.39)%,造血干细胞特异性标志物CD34、CD45 的阴性率分别为(99.42 ± 0.43)%和(99.72 ±0.44)%,见图 3。Poly(I ∶C)诱导的 MSCs 特异性标志物 CD44、CD73、CD90、CD105、HLA-ABC 的阳性率分别为(99.84±0.07)%、(98.27±1.22)%、(96.90±1.94)%、(97.18 ± 1.45)%和(96.87 ± 2.12)%,造血干细胞特异性标志物CD34、CD45 的阴性率分别为(99.03 ± 0.82)%和(99.21 ± 0.76)%;LPS 诱导的 MSCs 特异性标志物 CD44、CD73、CD90、CD105、HLA-ABC 的阳性率分别为(99.90 ± 0.10)%、(98.49 ±1.20)%、(97.68 ± 1.37)%、(95.52 ± 1.11)%和(8.25 ± 0.93)%,造血干细胞特异性标志物CD34、CD45 的阴性率分别为(99.47 ± 0.55)%和(99.48 ±0.29)%。与对照组细胞表面标志相比,经Poly(I ∶C)和LPS 刺激的hADMSCs 表面典型标志也未受到Poly(I ∶C)和LPS 的影响。见图 4 和图 5。
2.4 hADMSCs 的分化能力 成骨诱导3 周后,茜素红染色后镜下可观察到深褐色钙沉积,见图6B;成脂诱导第19 天,油红O 染色后镜下可见脂滴形成,见图6F。经LPS 和Poly(I ∶C)刺激的hADMSCs 成骨诱导后形成的深褐色钙结节明显比未经刺激的hADMSCs 多,表明 LPS 和 Poly(I ∶C)对 hADMSCs 成骨分化能力起促进作用,且LPS 对hADMSCs 的成骨分化诱导促进作用强于Poly(I ∶C),见图6C 和6D。LPS 和Poly(I ∶C)刺激并不影响 hADMSCs 的体外成脂分化,形成的脂滴无明显差异,见图6G 和6H。

图3 流式细胞仪分析hADMSCs 表面标志Fig.3 Flow cytometry of surface markers of hADMSCs

图4 Poly(I ∶C)诱导的hADMSCs 的细胞表面标志鉴定Fig.4 Identification of surface markers of hADMSCs pre-activated with Poly(I ∶C)

图5 LPS 诱导的hADMSCs 的细胞表面标志鉴定Fig.5 Identification of surface markers of hADMSCs pre-activated with LPS

图6 hADMSCs 分化能力的显微镜观察Fig.6 Microscopy of differentiation ability of hADMSCs
2.5 Poly(I ∶C)或LPS诱导后的hADMSCs分泌IFNβ的含量 ELISA 检测结果显示,对照组、5 μg /mL Poly(I ∶C)诱导组、25 μg/mL Poly(I ∶C)诱导组、0.1 mg/mL LPS 诱导组和 0.5 mg / mL LPS 诱导组 hADMSCs 分泌的 IFNβ 浓度分别为(175.91 ± 15.84)、(442.65 ±36.42)、(515.40 ± 71.66)、(163.21 ± 31.68)和(294.46 ± 73.35)pg / mL。经 Poly(I ∶C)诱导的hADMSCs 分泌的IFNβ 浓度明显高于对照组(F =18.87,P 分别为 0.002 8 和 0.000 4)。LPS 浓度为0.1 mg /mL 时,IFNβ 表达量不高,浓度达 0.5 mg / mL时,才分泌一定量的IFNβ(F = 18.87,P = 0.047 8)。由于低浓度的LPS 诱导hADMSCs IFNβ 表达量不高,且高剂量的LPS 会对细胞表现出一定程度的损伤,因此,选择Poly(I ∶C)进行下一步试验。
2.6 Poly(I ∶C)预处理的 hADMSCs TRAIL 的表达Western blot 分析显示,Poly(I ∶C)预处理促进了hADMSCs 表达 TRAIL,见图 7。

图 7 Western blot 分析 TRAIL 在 Poly(I ∶C)预处理的hADMSCs 中的表达Fig.7 Western blotting of TRAIL expression in hADMSCs pre-activated with Poly(I ∶C)
2.7 Poly(I ∶C)诱导的 hADMSCs 与 H460 细胞共培养后靶细胞的活性 CCK8 法检测结果显示,hADMSCs在适宜浓度的Poly(I ∶C)诱导下,能够降低靶细胞的活性,经 5 和 25 μg / mL Poly(I ∶C)诱导的靶细胞活性相对最低,且当 hADMSCs ∶H460 比例为 1 ∶2 时,Poly(I ∶C)诱导的 hADMSCs 对 H460 细胞的抑制效果最佳(F = 5.924,P 分别为0.037 2 和0.049 8),见图8。镜下更直观地观察到经5 和25 μg / mL Poly(I ∶C)诱导的 hADMSCs 对 H460-EGFP 细胞表现出的细胞毒性,能够显著抑制H460-EGFP 的生长(F =12.5,P 均 < 0.000 1),见图 9 和图 10。

图8 Poly(I ∶C)诱导的hADMSCs 与H460 细胞以不同比例共培养Fig.8 Co-culture of hADMSCs pre-activated with Poly(I ∶C)with H460 cells at various ratios

图 9 Poly(I ∶C)诱导的 hADMSCs 与 H460-EGFP 按 1 ∶2比例共培养后的显微镜观察(× 40)Fig.9 Microscopy of hADMSCs pre-activated with Poly(I ∶C)co-cultured with H460-EGFP at a ratios of 1 ∶2(× 40)

图 10 Poly(I ∶C)诱导的 hADMSCs 与 H460-EGFP 按 1 ∶2比例共培养后占对照组百分比Fig.10 Proportion of target cells to those in control group afte co-culture of Poly(I ∶C)pre-treated hADMSCs and H460-EGFP at a ratio of 1 ∶2
3 讨 论
MSCs 的来源多种多样,可从骨髓、脂肪、嗅黏膜、滑膜、角膜基质等组织以及脐带血、胎盘、羊水等分离出MSCs[8-10]。目前临床使用最多的仍是骨髓来源的MSCs,但骨髓MSCs 取材不易,取材时不仅会对供者造成创伤,还易由于受供体年龄老化的影响,对MSCs 的数目以及后续的增殖分化造成一定的影响,这使得骨髓MSCs 在临床应用方面受到一定的限制。而hADMSCs 不存在上述限制,其来源广泛,易于取材,对供者的损伤少,还可通过收集抽脂手术中要遗弃的脂肪组织悬液来提取,易大量获取,又避免了伦理问题。本研究中制备的hADMSCs 表达CD44、CD73、CD90、CD105、HLA-ABC,且阳性率 ≥ 95%,不表达CD34、CD45,该结果与相关文献报道一致[11-14]。提取的hADMSCs 能够在体外稳定扩增,传代15 代之内未见明显变化,还具有体外多向诱导分化的能力。
已知MSC 能表达TLR,而TLR 作为固有免疫病原模式识别受体,可从不同的识别途径使多种免疫细胞活化,进而启动非特异性免疫应答和引起适应性免疫应答[15]。Poly(I ∶C)和 LPS 分别作为 TLR3、TLR4 的重要激动剂通过与TLR3、TLR4 结合发挥作用,能够启动机体的固有免疫。本研究用Poly(I ∶C)和LPS 对hADMSCs 刺激后进行成骨、成脂分化诱导,发现它们对MSCs 成骨分化具有一定的促进作用,但对于成脂分化却未见明显作用,这与部分文献的报道相符合[16]。而经 Poly(I ∶C)或 LPS 刺激后的 MSCs在流式表面标志鉴定中也无明显改变。
在病理条件下,损伤的组织或凋亡的细胞会释放包括细胞内分子,如高迁移率族蛋白1(high mobility group protein 1,HMGB1)和热休克蛋白(heat-shock proteins,HSP),自身 DNA 和 RNA 等 DAMPs,而这些内源性的DAMPs 很可能激活TLRs,从而引起TLR通路的活化,进而引发抗肿瘤效应[1]。本实验选取TLR3、TLR4 的配体 Poly(I ∶C)、LPS 模拟凋亡细胞释放的DAMPs 中的自身RNA、HSP 等信号分子,验证DAMPs 是否介导了凋亡细胞上调MSCs 中TRAIL的表达这一过程。本实验证明,经适宜浓度的Poly(I ∶C)、LPS 预活化的 MSCs 促进了 IFN 的表达,而IFN 能够作用于hADMSCs,并促使其表达TRAIL。但由于LPS 仅在高剂量时表现出促进作用,而高剂量的LPS 会对机体产生损伤[17],因此,仅用 Poly(I ∶C)进行后续Western blot 和共培养试验。Western blot 分析表明,经Poly(I ∶C)预活化后的MSCs 显著表达TRAIL,而TRAIL 能快速、大量诱导肿瘤细胞凋亡,降低肿瘤细胞增殖。表明凋亡细胞中释放的DAMPS很可能作为内源性配体与TLR 相结合,并激活相关信号通路,从而促进MSCs 表达TRAIL 分子,继而由TRAIL 诱导肿瘤细胞凋亡。因此,Poly(I ∶C)作为一个IFNs 诱导剂,可激活MSCs 的TLR 分子通路,促进其表达IFNs,继而通过旁分泌形式进一步诱导MSCs 表达TRAIL,来特异性激活MSCs 的抗肿瘤作用[6]。通过局部的DAMPs 或外部TLR 配体激活MSCs 的TLR 通路可增强肿瘤细胞死亡,且TLR 通路的活化而导致的炎症细胞因子(IL-6,IL-8)和趋化因子(CCL2,CXCL10)基因表达上调可能介导了MSCs 发挥其免疫细胞趋化性,使其对其附近的细胞发挥免疫调节作用,进而在体内差异性募集和调节免疫系统[18]。
综上所述,本研究成功分离、培养了hADMSCs,并证明在体外经低浓度的Poly(I ∶C)或高浓度的LPS预刺激后的hADMSCs 能够表达IFN,Poly(I ∶C)预活化的MSCs 能够表达TRAIL 进而发挥抑制肿瘤生长的作用,为进一步探索DAMPs 细胞外修饰的MSCs应用于抗肿瘤策略奠定了基础。

