生产过程中Sabin 株脊髓灰质炎灭活疫苗的灭活效果验证
赵恒,李娅娴,史磊,王云飞,丁开云,赵勇,范胜涛,易力
中国医学科学院北京协和医学院医学生物学研究所,云南昆明650118
脊髓灰质炎病毒属无包膜正链RNA 病毒,是引起脊髓灰质炎的病原体,有Ⅰ、Ⅱ及Ⅲ3 个血清型,该病毒主要感染3 岁以下婴幼儿。中国20 世纪60年代,每年有2 万 ~4.3 万名儿童感染脊髓灰质炎病毒[1]。1952 年,SALK 等利用野生型脊髓灰质炎病毒研制出世界上首剂脊髓灰质炎灭活疫苗(inactivated poliovirus vaccine,IPV)[2]。1961 年,SABIN 等成功制成全球第一剂口服脊髓灰质炎减毒活疫苗(oral poliovirus vaccine,OPV),并被美国及WHO 批准上市[3]。
随着全球范围内大量使用IPV 及OPV,脊髓灰质炎病毒得到有效控制,每年感染脊髓灰质炎病毒的病例急剧下降,世界上许多地区已进入无脊髓灰质炎时代。但与IPV 相比,使用OPV 会导致一些不良反应,其中最严重的问题是疫苗相关性脊髓灰质炎(vaccine-associated paralytic poliomyelitis,VAPP)及疫苗来源性脊髓灰质炎病毒(vaccine derived polio virus,VDPV)。在使用OPV 的国家中,VAPP 发生的比例较VDPV 要高许多,中国自2010 — 2015 年间报告了 157 例 VAPP,发生率为(1.0 ~ 2.4)/ 100万[4]。为保证全球进入无脊髓灰质炎时代,同时避免VAPP 及VDPV 的发生,全球统一使用IPV 是最有效的方法,因此,从2014 年开始,WHO 建议在使用OPV 的国家中至少使用1 剂IPV,即第1 剂使用IPV,后续使用双价OPV(bOPV)[5]。中国医学科学院医学生物学研究所在2015 年研制出Sabin 株IPV(sIPV),并被CFDA 批准上市,中国采纳WHO 的免疫建议,即第1 剂使用sIPV,后续使用bOPV 的免疫程序。
相对于OPV,IPV 及sIPV 在控制脊髓灰质炎暴发,减少VAPP 及VDPV 发生等方面具有明显的优势。但若不能控制好疫苗的灭活过程,保证疫苗中病毒被全部灭活,接种IPV 会给接种者带来灾难性后果。在美国IPV 开始使用早期,由Cutter 公司生产的两批疫苗在接种后导致260 例脊髓灰质炎病例发生,经调查表明,其原因是IPV 在灭活过程中病毒未被彻底灭活,导致接种者感染[6]。因此,在脊髓灰质炎灭活疫苗的生产过程中,无论IPV 还是sIPV,灭活过程均是保证疫苗安全性的关键步骤,但在生产中连续多批Sabin 株IPV 的灭活效果验证及评价尚未见报道。
本研究对中国医学科学院医学生物学研究所sIPV 连续5 个批次病毒纯化液灭活效果进行验证,同时检测灭活过程中D 抗原的损失情况,为sIPV 的灭活工艺提供参考,以确保sIPV 疫苗的稳定性及安全性。
1 材料与方法
1.1 细胞及病毒 Vero 细胞、人喉癌上皮细胞(Hep-2)及Sabin 株脊髓灰质炎Ⅰ、Ⅱ及Ⅲ型病毒均由中国医学科学院医学生物研究所提供和保存。
1.2 主要试剂及仪器 甲醛及亚硫酸氢钠购自美国Sigma 公司;兔抗Sabin 株脊髓灰质炎病毒IgG及Sabin 株脊髓灰质炎病毒IgG 由中国医学科学院医学生物学研究所提供;D 抗原标准品由中国食品药品检定研究院提供;HRP 标记的鼠抗兔IgG 购自美国Thermo 公司;酶标仪购自美国Bio-Tek公司。
1.3 病毒灭活 Sabin 株Ⅰ、Ⅱ及Ⅲ型脊髓灰质炎病毒分别用微载体培养罐培养Vero 细胞扩增,至细胞充分病变后收集培养物,将连续5 批病毒收获液纯化,加入终浓度为 92.5 μg / mL 的甲醛,于 37 ℃灭活12 d。每个型别的病毒分别于灭活前(0 d)及灭活1 ~ 6、9 和 12 d 取样,灭活样品加入 92.5 μg / mL亚硫酸氢钠终止灭活反应。每个型别病毒连续取样5 个批次。
1.4 病毒滴度的检测 依据WHO 建议,采用透析膜对灭活后样品进行透析处理,去除甲醛及亚硫酸氢钠。分别将0 ~6 d 样品进行10 倍系列稀释,加入96 孔板中,100 μL / 孔,每个稀释度重复 8 孔,加入 Hep-2 细胞悬液,100 μL / 孔,置 35.5 ℃,5% CO2培养箱中培养7 d。用倒置显微镜观察细胞病变情况,根据病变情况采用Reed-Munch 法计算样品的病毒滴度。并计算每个型别病毒的灭活速率(灭活当日与前1 日病毒滴度差)。以灭活时间为横坐标,病毒滴度为纵坐标,绘制病毒灭活动力学曲线,并进行相关性及线性回归分析。
1.5 D 抗原的检测 采用ELISA 法。将病毒样品先分别进行2 倍系列稀释,选取7 个适宜的稀释度加入包被有抗Sabin 株脊髓灰质炎病毒IgG(Ⅰ型:1 ∶4 000 稀释,Ⅱ型:1 ∶20 000 稀释,Ⅱ型:1 ∶6 000 稀释)的酶标板中,100 μL / 孔,每个稀释度重复 2 孔;加入系列稀释的 D 抗原标准品,100 μL / 孔,每个稀释度重复2 孔,2 ~8 ℃过夜;洗涤,加入兔抗Sabin株脊髓灰质炎病毒IgG(Ⅰ型:1 ∶80 稀释,Ⅱ型:1 ∶200 稀释,Ⅱ型:1 ∶100 稀释),室温孵育 2.5 h;洗涤,加入 HRP 标记的鼠抗兔 IgG(1 ∶6 500 稀释),37 ℃孵育1.5 h;洗涤,加入显色液,37 ℃避光显色10 min;加入0.01 mol / L 硫酸终止反应。酶标仪读取标准品及样品波长450 / 630 的吸光度值,采用四参数法计算样品中D 抗原含量,并按下式计算回收率。
D 抗原回收率(%)=(灭活后D 抗原含量 / 灭活0 d D抗原含量)× 100%
1.6 病毒灭活验证 分别将灭活9 及12 d 样品接种至Hep-2 细胞中,35.5 ℃进行3 次盲传培养,第1次传代培养21 d,第2 及3 次传代各培养14 d,每次传代培养过程中均观察细胞病变情况。3 次传代中均无细胞病变,判定病毒被彻底灭活;如有细胞病变,则判定病毒灭活验证失败。
1.7 统计学分析 采用SPSS 17.0 软件进行统计学分析。病毒灭活速率采用单因素方差分析,D 抗原回收率采用非参数检验分析,以P <0.05 为差异有统计学意义。
2 结 果
2.1 病毒滴度 结果显示,连续5 批Ⅰ、Ⅱ及Ⅲ型脊髓灰质炎病毒0 d 样品平均病毒滴度差异无统计学意义(F = 0.047,P >0.05)。随着灭活时间延长,样品的病毒滴度逐渐下降,灭活第3 天下降至0.00 lgCCID50/ mL。见表 1。
表1 Ⅰ、Ⅱ及Ⅲ型脊髓灰质炎病毒灭活不同时间的病毒滴度(lgCCID50 / mL, ± SD,n = 5)Tab.1 Poliovirus titers of types Ⅰ,Ⅱ and Ⅲ after inactivation for various days(lgCCID50 / mL, ± SD,n = 5)

表1 Ⅰ、Ⅱ及Ⅲ型脊髓灰质炎病毒灭活不同时间的病毒滴度(lgCCID50 / mL, ± SD,n = 5)Tab.1 Poliovirus titers of types Ⅰ,Ⅱ and Ⅲ after inactivation for various days(lgCCID50 / mL, ± SD,n = 5)
时间(d) Ⅰ型 Ⅱ型 Ⅲ型0 8.77 ± 0.34 8.82 ± 0.26 8.64 ± 0.17 1 5.20 ± 0.96 4.80 ± 0.70 5.12 ± 0.31 2 1.20 ± 1.15 1.15 ± 1.20 2.37 ± 0.46 3 0.00 0.00 0.00 4 0.00 0.00 0.00 5 0.00 0.00 0.00 6 0.00 0.00 0.00
2.2 病毒灭活速率 结果显示,3 种型别病毒灭活1 及2 d 的平均灭活速率较快,3 d 的平均灭活速率减慢,但每日灭活速率差异均无统计学意义(P 均>0.05)。见表2。
2.3 灭活动力学分析 结果显示,Ⅰ、Ⅱ及Ⅲ型病毒灭活0 ~3 d 灭活动力学曲线均呈直线下降,相关性分析表明,病毒灭活效果与时间密切相关,相关系数(r)分别为-0.995、-0.976 和-0.996,曲线回归方程分别为Y = -3.301 X + 8.339、Y = -3.011 X +8.209 和 Y = -2.807 X + 8.340,R2分别为 0.991、0.952 和 0.992。见图 1。
表2 灭活1 ~3 d 的Ⅰ、Ⅱ及Ⅲ型病毒的灭活速率(lgCCID50/d,± SD,n = 5)Tab.2 Inactivation rates of poliovirus of types Ⅰ,Ⅱ and Ⅲ after inactivation for 1 ~ 3 d(lgCCID50 / d, ± SD,n = 5)

表2 灭活1 ~3 d 的Ⅰ、Ⅱ及Ⅲ型病毒的灭活速率(lgCCID50/d,± SD,n = 5)Tab.2 Inactivation rates of poliovirus of types Ⅰ,Ⅱ and Ⅲ after inactivation for 1 ~ 3 d(lgCCID50 / d, ± SD,n = 5)
时间(d) Ⅰ型 Ⅱ型 Ⅲ型 F P 1 3.58 ± 0.80 4.03 ± 0.89 3.52 ± 0.25 0.777 0.48 2 4.00 ± 1.23 3.65 ± 0.61 2.75 ± 0.32 2.920 0.09 3 1.20 ± 1.15 1.15 ± 1.20 2.37 ± 0.46 2.422 0.13
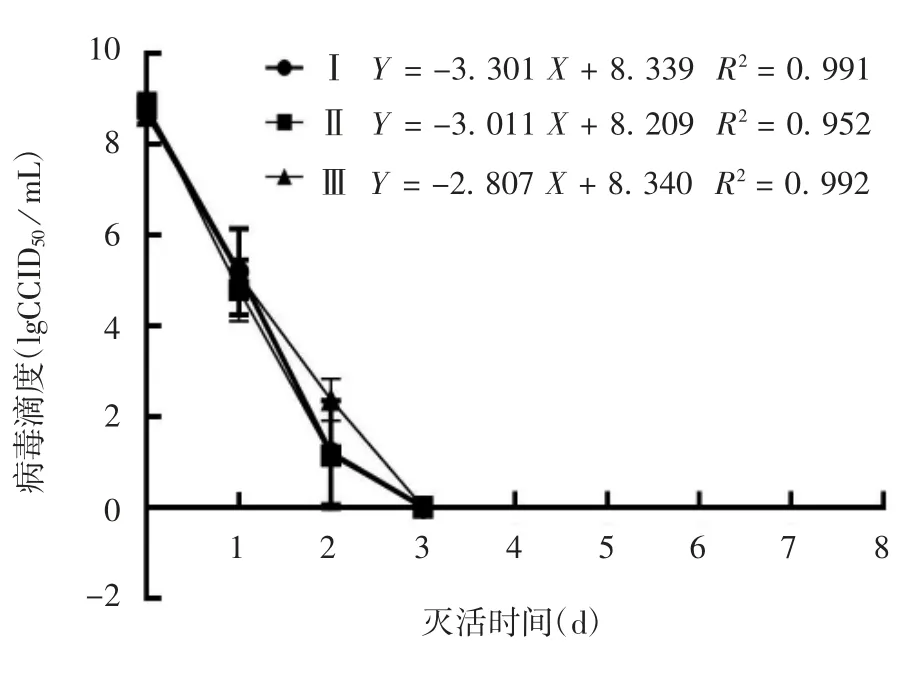
图1 Ⅰ、Ⅱ及Ⅲ型脊髓灰质炎病毒的灭活动力学曲线Fig.1 Inactivation dynamic curve of poliovirus of types Ⅰ,Ⅱand Ⅲ
2.4 D 抗原回收率 结果显示,Ⅰ、Ⅱ及Ⅲ型病毒灭活12 d 时的D 抗原平均回收率分别为80%、85%和83%。3 种型别病毒的D 抗原均因甲醛灭活而有一定的损失,损失程度差异无统计学意义(F = 0.662,P = 0.718)。见表3。
2.5 病毒灭活验证结果 Ⅰ、Ⅱ及Ⅲ型病毒9 及12 d样品灭活验证结果均为阴性,无细胞病变产生,表明病毒被彻底灭活。
表3 Ⅰ、Ⅱ及Ⅲ型病毒灭活样品的D 抗原回收率(%,±SD,n = 5)Tab.3 Recovery rates of D antigen in poliovirus of types Ⅰ,Ⅱand Ⅲ(%, ± SD,n = 5)

表3 Ⅰ、Ⅱ及Ⅲ型病毒灭活样品的D 抗原回收率(%,±SD,n = 5)Tab.3 Recovery rates of D antigen in poliovirus of types Ⅰ,Ⅱand Ⅲ(%, ± SD,n = 5)
灭活时间(d) Ⅰ型 Ⅱ型 Ⅲ型1 0.97 ± 0.02 0.90 ± 0.06 0.96 ± 0.02 2 0.95 ± 0.02 0.90 ± 0.06 0.94 ± 0.02 3 0.93 ± 0.03 0.90 ± 0.06 0.92 ± 0.02 4 0.89 ± 0.04 0.90 ± 0.06 0.91 ± 0.02 5 0.84 ± 0.02 0.89 ± 0.03 0.89 ± 0.02 6 0.83 ± 0.02 0.87 ± 0.03 0.88 ± 0.02 9 0.83 ± 0.01 0.87 ± 0.04 0.85 ± 0.01 12 0.80 ± 0.05 0.85 ± 0.06 0.83 ± 0.06
3 讨 论
本研究制备了Sabin 株Ⅰ、Ⅱ及Ⅲ型脊髓灰质炎病毒各连续5 批纯化液,验证并评价了Sabin 株脊髓灰炎灭活疫苗在生产条件下甲醛对3 种型别病毒的灭活效果。从病毒灭活情况来看,在灭活0 ~3 d内,3 种型别的病毒滴度均随着灭活时间的延长而逐渐下降,相关性分析表明,病毒灭活效果与灭活时间密切相关,且呈明显负相关,r 分别为-0.995、-0.976 和-0.996。灭活至第3 天,3 种型别病毒滴度均下降至0.00 lgCCID50/ mL,样品中已检测不出病毒,与NATHANSON 等[7]研究的野生型脊灰病毒在灭活后72 ~96 h 后可被彻底灭活结果一致。Ⅰ、Ⅱ及Ⅲ型病毒0 ~3 d 灭活曲线回归分析表明,R2分别为0.991、0.952 和0.992,整个反应趋于一级反应模式,与SALK 等[8]及美国脊髓灰质炎疫苗科学委员会认为甲醛对脊髓灰质炎病毒的灭活反应服从一级反应规律的结论一致。甲醛对病毒的灭活反应是一个复杂的过程,不能单纯定义为一级反应或其他级反应,对于疫苗的安全性来说,病毒能被彻底灭活才是保证疫苗安全性的关键问题,因此,灭活曲线所表现出来的规律也许对灭活工作的指导意义大于实际应用意义。在灭活速率上,3 种型别的病毒在灭活第1、2 天的速率均比第3 天快,但同日内的灭活速率差异无统计学意义(P >0.05),这可能是由于至第3 天时活病毒量很少,导致灭活速率较慢。灭活9 及12 d 样品的验证结果均显示阴性,表明第9天时,样品中经检测不出活病毒,活病毒已被彻底灭活,再延长灭活时间至12 d,疫苗的安全性更有保证。
甲醛对病毒的灭活主要涉及病毒抗原表位的变化及病毒RNA 与衣壳发生变性两方面。研究发现,脊髓灰质炎病毒经甲醛灭活后,抗原位点发生改变,其中Ⅰ型病毒的抗原位点1 发生改变,Ⅲ型病毒发生改变的抗原位点为1 和3,而Ⅱ型病毒的1 ~3 位点均发生改变,但较轻微[9-11]。本研究中,3 种型别病毒D 抗原回收率在灭活周期中逐渐下降,但差异无统计学意义(P >0.05),抗原在灭活过程中有一定的损失,可能是病毒在灭活中抗原位点发生改变,进行ELISA检测时无法检测到。3 种型别病毒D 抗原回收率均在80%以上,其中Ⅱ及Ⅲ型病毒的D 抗原回收率与THOMASSEN 等[12]的研究结果(均低于 80%)有差异,可能与后者是在实验室条件下取得的结果有关。
综上所述,在目前的灭活工艺条件下,Sabin 株3 种型别的病毒均能被稳定可靠地灭活,且能收获含量较高的D 抗原,符合生产需求。

