狂犬病病毒滴度直接免疫荧光检测法的建立及验证
刘宏伟,田玉玲,朱琨莹,张岩,杨帆,刘银星,石亮,闫昆明
1.长春百克生物科技股份公司,吉林长春130012;2.长春市儿童医院,吉林长春130000;3.吉林大学第一医院艾滋病与病毒研究所,吉林长春130021
狂犬病是由狂犬病病毒感染导致的以侵犯中枢神经系统为主的急性人兽共患传染病[1],多见于犬、狼、猫等动物,人类多由于被患病动物咬伤而感染,一旦发病,死亡率几乎100%。目前,接种疫苗是有效预防狂犬病的主要手段之一,人用狂犬病疫苗是将狂犬病病毒经灭活后制备而成[2-3]。糖蛋白刺突是位于狂犬病毒表面的保护性抗原,也是唯一能诱导宿主产生中和抗体的蛋白[4-5],因此病毒含量决定了保护性抗原的含量,与疫苗质量密切相关。
病毒滴度可反映疫苗中的病毒含量,是狂犬病疫苗生产过程中的关键质量控制参数。病毒滴度的传统检测方法为小鼠脑内滴定法,该方法对检测人员熟练程度要求较高,动物状态也会影响检测结果,导致结果不稳定,重复性差,且耗时较长(14 d)[6-7]。直接免疫荧光技术是利用荧光素标记的已知抗体,与细胞中狂犬病病毒特异性结合,经紫外光激发可产生荧光,以检测狂犬病病毒含量[8],该方法避免了小鼠脑内滴定法的诸多缺点。因此,本研究采用MRC-5 细胞建立狂犬病病毒滴度的直接免疫荧光检测法,以期应用于疫苗生产过程中的质量控制。
1 材料与方法
1.1 病毒及细胞 20 批狂犬病病毒Pitman-Moore株(PM 株)病毒液和MRC-5 细胞均由长春百克生物科技股份公司药物研究院提供。
1.2 主要试剂 MEM 培养基购自美国HyCLone 公司;新生牛血清购自兰州民海生物工程有限公司;胰酶购自美国Gibco 公司;FITC 标记的抗狂犬病病毒特异性抗体购自美国Millipore 公司。
1.3 实验动物 SPF 级 ICR 小鼠,雌性,2 ~ 3 周龄,体重11 ~13 g,购自长春亿斯实验动物技术有限责任公司,动物合格证号:201900030820。
1.4 方法的建立 将病毒液进行5 倍系列稀释(5-1~5-12),加入 96 孔板,200 μL / 孔,每个稀释度设 2 个复孔,再加入 1 × 106个 /mL 的 MRC-5 细胞,50 μL /孔,于 37 ℃,5% CO2培养箱培养 24 ~ 30 h;弃培养液,PBS 洗涤 1 次,加入 80%冷丙酮,100 μL / 孔,4 ℃固定30 min;弃丙酮,室温放置待丙酮挥发后,加入FITC 标记的抗狂犬病病毒特异性抗体(1 ∶200 稀释),50 μL / 孔,37 ℃孵育 2 h;PBS 洗涤 3 次,加入80%甘油,50 μL / 孔,倒置荧光显微镜下观察,取每孔荧光灶数 <30 的孔,记录相邻4 孔荧光灶数,取平均值,并按下式计算病毒滴度,取其对数。
病毒滴度(FFU/mL)=(最高稀释倍数孔荧光灶平均值×5+相邻孔稀释倍数较低的荧光灶平均值)/ 2 × 稀释倍数较低孔病毒稀释倍数× 5
1.5 方法的验证
1.5.1 重复性 取同1 批PM 株病毒液,由同1 名检测者于不同时间点检测3 次,每个时间点重复检测6 次,计算平均值()、标准差(SD)及变异系数(CV)。
1.5.2 中间精密度 取3 批PM 株病毒液,由2 名检测者(A 和B)于不同时间检测,每次重复3 次,计算、SD 和 CV。
1.5.3 线性范围 取1 份PM 株病毒液,进行5 倍系列稀释(50~5-7),分别测定病毒滴度。以病毒稀释度为横坐标,病毒滴度为纵坐标绘制标准曲线。
1.6 与其他方法的比较 取20 批PM 株病毒液,用含2%新生牛血清的PBS 进行10 倍系列稀释(10-3~10-8),经脑内接种小鼠,0.03 mL / 只,每个稀释度6只。逐日观察,3 d 内死亡者不计(动物死亡数量应不超过试验动物总数的20%),连续观察14 d,记录死亡情况,并按下式计算病毒滴度(LgLD50)。同时应用建立的直接免疫荧光法进行检测。以LgFFU 为横坐标,LgLD50为纵坐标,进行线性回归,分析两者间的相关性。
距离比 =(高于50%的死亡率 - 50%)/(高于50%的死亡率- 低于50%的死亡率);
病毒滴度 = Lg 高于50%死亡率的稀释度 + 距离比 ×Lg 稀释倍数 + Lg1 / 0.03
1.7 统计学分析 应用IBM SPSS 19.0 统计软件进行统计学分析,GraphPad Prism 6 软件作图,计量资料采用进行集中趋势统计描述,SD、CV 进行离散趋势统计描述。两种检测方法检测结果的比较分析应用R-Square 描述回归模型,采用方差分析检验回归模型的统计学意义,t 检验分析判断回归模型中自变量系数的统计学意义。所有统计学检验均为双侧检验,检验水准α = 0.05,以P <0.05 为差异有统计学意义。
2 结 果
2.1 方法的验证结果
2.1.1 重复性 各时间点6 次重复检测的CV 均<2%,见表1。表明该方法具有良好的重复性。
表1 重复性验证结果(LgFFU,,n = 6)Tab.1 Verification for reproducibility(LgFFU,,n = 6)

表1 重复性验证结果(LgFFU,,n = 6)Tab.1 Verification for reproducibility(LgFFU,,n = 6)
试验次数 病毒滴度 SD CV(%)1 6.62 0.03 0.45 2 6.63 0.12 1.81 3 6.65 0.08 1.20 x 6.63 0.07 1.16
2.1.2 中间精密度 2 名检测者于不同时间点3 次重复检测的CV 均 <2%,见表2。表明该检测方法具有良好的中间精密度。
2.1.3 线性范围 狂犬病病毒滴度直接免疫荧光检测法的标准曲线见图1。病毒稀释倍数在50~5-7范围内,与病毒滴度呈良好的线性关系,线性回归方程为Y=-0.739 2 X+8.031,R2=0.986 6。
表2 中间精密度的验证结果(LgFFU,,n=3)Tab.2 Verification for intermediate precision(LgFFU,,n=3)
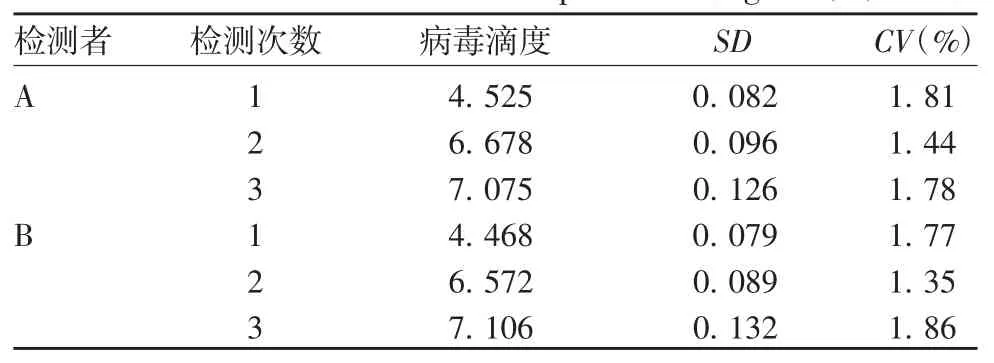
表2 中间精密度的验证结果(LgFFU,,n=3)Tab.2 Verification for intermediate precision(LgFFU,,n=3)
检测者 检测次数 病毒滴度 SD CV(%)A 1 4.525 0.082 1.81 2 6.678 0.096 1.44 3 7.075 0.126 1.78 B 1 4.468 0.079 1.77 2 6.572 0.089 1.35 3 7.106 0.132 1.86
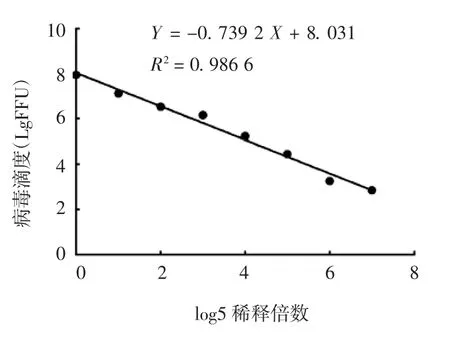
图1 狂犬病病毒滴度直接免疫荧光检测法的标准曲线Fig.1 Standard curve for determination of rabies virus titer by direct IFA
2.2 与其他方法的比较 20 批PM 株病毒液两种方法的检测结果趋势相同,回归方程为Y=-0.642+1.088 X,R-Square=0.905,表明两种方法具有良好的相关性,且自变量对回归模型有显著意义(t=13.071,P <0.001),回归关系具有统计学意义(F=170.863,P < 0.001)。见表 3 和图 2。
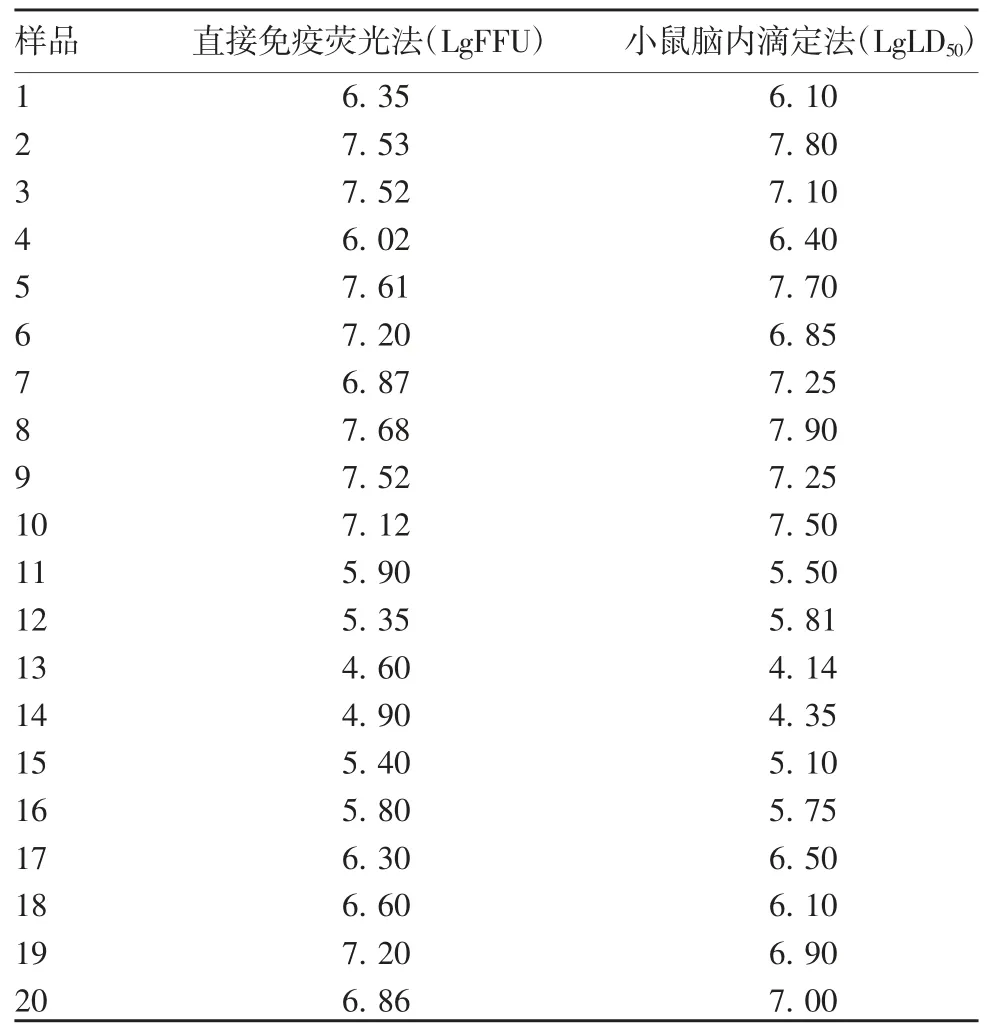
表3 两种方法的检测结果Tab.3 The determination results of two mothods
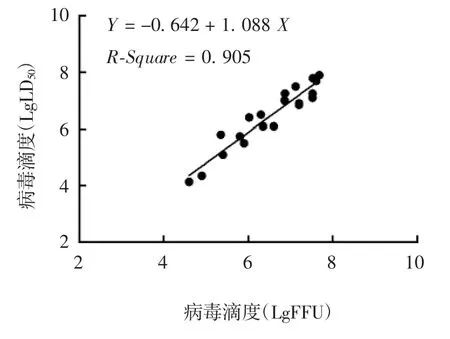
图2 两种方法检测结果的相关性Fig.2 Correlation of determination results by two methods
3 讨 论
狂犬病病毒自暴露伤口后,潜伏期一般为1 ~3个月,少数患者可长至1 年以上,发病时可出现狂躁、怕风、怕水、怕光等临床症状,目前尚无有效治疗手段,及时接种狂犬病疫苗和免疫球蛋白可有效预防狂犬病[9]。病毒滴度是评价疫苗质量的重要指标。《中国药典》三部(2020 版)[10]中规定,狂犬病病毒滴度检测可采用小鼠脑内滴定法或细胞培养法。小鼠脑内滴定法的原理是狂犬病病毒能够在小鼠脑内大量增殖并在一定时间内导致小鼠死亡,根据小鼠死亡情况,计算病毒滴度(LgLD50)。该方法检测结果的影响因素较多,因此,寻找快速、稳定、准确的检测方法显得尤为重要。本实验采用MRC-5 细胞建立了狂犬病病毒滴度的直接免疫荧光检测法,各时间点6 次重复检测结果的CV 均<2%,表明该方法具有良好的重复性;于不同时间点3 次重复检测结果的CV 均<2%,表明该检测方法具有良好的中间精密度;PM株病毒稀释倍数在50~5-7范围内,与病毒滴度呈良好的线性关系,线性回归方程为Y = -0.739 2 X +8.031,R2= 0.986 6。
本实验采用直接免疫荧光法和小鼠脑内滴定法同时检测20 批PM 株病毒液,两种方法检测结果趋势相同,回归方程为Y=-0.642 + 1.088 X,R-Square =0.905,表明两种方法具有良好的相关性。与小鼠脑内滴定法比较,直接免疫荧光法还具有检测周期短、重复性好、操作简便等优势,且可1 次检测大量样品,提高检测效率[11]。
目前,世界卫生组织(World Health Organization,WHO)和世界动物卫生组织(Office International Des Epizooties,OIE)推荐采用直接免疫荧光试验作为检测狂犬病病毒滴度的标准方法,国际上已将该方法广泛应用于狂犬病病毒滴度的检测[12],国内也开始逐步采用该方法检测病毒滴度[13]。另外,从动物试验的减少、细化和替换角度出发,开发和引入无动物替代试验十分必要[14]。在狂犬病疫苗生产过程中采用直接免疫荧光法检测病毒滴定进行质量监控,有利于提高疫苗的生产效率及降低生产成本[15]。

