SARS-CoV-2 重组载体疫苗的研究进展
李兴航 曹守春 ,综述 杨晓明 审校
1.武汉生物制品研究所有限责任公司,湖北武汉430207;2.国家联合疫苗工程技术研究中心,湖北武汉430207;3.中国食品药品检定研究院虫媒病毒疫苗室,北京102629;4.中国生物技术股份有限公司,北京100029
重症急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)引起的2019 冠状病毒病(Coronavirus Disease 2019,COVID-19)仍在全球流行中,也是目前最受关注的突发传染性疾病。截至2021 年5 月27 日,已有167 492 769例确诊病例,其中死亡3 482 907 例(数据来源:https:/ / covid19.who.int /)。鉴于其极强的传播性和目前的高流行率,接种疫苗是迅速在人群中建立群体免疫,防止疫情扩散,保护人群生命健康最有效和经济的方式。
世界上预防COVID-19 的疫苗主要类型包括灭活疫苗、重组蛋白疫苗、重组载体疫苗、核酸疫苗。其中,重组载体疫苗作为一类新型疫苗,在此次抗击COVID-19 中起到了重要的预防作用[1]。目前已在全球范围内紧急使用的重组载体疫苗有中国康希诺生物的克威莎、俄罗斯Gamaleya 公司的sputnik V、牛津大学和阿斯利康的AZD1222(印度生产的称为Covishield)以及强生公司的AD26.CoV2.S。根据WHO 官网信息,还有17 款载体疫苗正在进行临床试验以及40 余款疫苗处于临床前研究阶段。本文对SARS-CoV-2 重组载体疫苗研制的载体类型以及疫苗的研究现状作一综述。
1 重组载体的类型
反向疫苗学和基因组学研究的飞速进展,极大地推进了重组载体疫苗的研究。20 世纪80 年代,有学者将外源基因片段导入减毒或无毒的微生物基因组内,使其高效表达目的基因的同时又不影响微生物自身生存和繁殖[2]。其作用机理是基于病毒感染细胞的能力去模仿病原体感染机体过程,从而诱导机体产生固有免疫和适应性免疫应答。一般而言,使用载体的优点是:①高效的基因转导;②将基因高度特异性地运送至靶细胞;③诱导强大的免疫应答,既可以表达目的蛋白激活机体产生特异性免疫应答,又可以起到佐剂的作用,增强机体细胞免疫应答和降低抗原的降解率[3]。这些载体为人类研制针对新发传染病和传统疫苗研制方法无法奏效的疾病(如艾滋病、丙型肝炎)提供了新的解决办法。目前针对SARS-CoV-2 疫苗研发的主要的载体特性见表1。

表1 各类载体的优缺点Tab.1 Advantages and disadvantages of vectors for vaccine
1.1 腺病毒(adenovirus,Ad)载体 腺病毒是一类无包膜双链DNA 病毒,感染人体后多表现为自限性疾病,可分为 7 个亚群(A ~ G)和 100 多种血清型[4]。1981 年,THUMMEL 等[5]首次使用腺病毒表达SV40病毒的T 抗原,构建了一种基于Ad2 的载体。经过多年的发展,人们发现腺病毒载体具备宿主范围广、致病性低、可插入基因大、可诱导固有免疫等优势,这使得腺病毒成为疫苗研究和基因治疗的首选工具。腺病毒载体根据是否复制可分为复制型和非复制型两类,目前用于COVID-19 疫苗研究主要是非复制型腺病毒载体,其原理是通过删除腺病毒中的E1、E3 等基因使得病毒丧失自主复制的能力,经过改造的腺病毒具有容量更大、载体本身免疫原性更弱等优点[6]。
目前大多数新冠载体疫苗的研制均是基于腺病毒载体,正在进行临床试验的20 款病毒载体疫苗中,有11 款使用了腺病毒。如中国康希诺生物的克威莎是基于Ad5 腺病毒;俄罗斯Gamaleya 公司的Sputnik V 是基于Ad5 和Ad26 两种腺病毒。但使用人腺病毒作为疫苗载体存在的一个问题是部分人群已经有针对人腺病毒的预存免疫,如中国健康人群中对于Ad5 血清抗体阳性率约在50% ~82%,在部分非洲国家甚至可达100%,这可能会影响疫苗的效果[7-8]。相反,黑猩猩腺病毒(ChAd)在人群中血清流行率则相对较低[9]。为降低人群中对于人腺病毒的预存免疫的作用,有些研究者使用了黑猩猩腺病毒作为载体研制新冠疫苗,如牛津大学 / 阿斯利康的AZD1222 使用了 ChAdOx1,Gritstone Oncology 公司使用了ChAd68 腺病毒。
1.2 痘病毒载体 痘病毒是一类体积大、结构复杂的双链DNA 病毒,可通过细胞吞饮的方式进入细胞进行复制。1982 年,人类首次将外源DNA 导入牛痘病毒的TK 基因中,构建了在哺乳动物细胞中表达外源基因的重组痘病毒[10]。痘病毒作为疫苗载体的优势是容量大,可插入长度30 000 bp 的外源基因而不影响其感染性。目前,常用作载体的痘病毒有痘苗病毒、牛痘病毒、猪痘病毒、鸡痘病毒和羊痘病毒等,其中最为常用的载体是改良痘苗病毒安卡拉株(modified vaccinia virus Ankara,MVA)。MVA 是将痘苗病毒在鸡胚成纤维细胞传代而获得,能容纳和表达多个外源基因,并诱导机体产生体液和细胞免疫,且安全性较好[11-12]。
目前,由Munichi 大学开发的基于MVA 载体表达SARS-CoV-2 S 蛋白的重组载体疫苗(NTC0456-9383)和美国希望之城医学中心开发的COH04S1(NCT04639466)均正在进行Ⅰ期临床试验[13-14]。此外,还有多个基于MVA 载体的新冠疫苗正在进行临床前研究(信息来源:https:/ / www.who.int / publications / m / item / draft-landscape-of-covid-19-candidatevaccines)。
1.3 慢病毒载体(lentiviral vector,LV) LV 是逆转录病毒的一种,是在人类免疫缺陷病毒(human immunodeficiency virus,HIV)基础上改造而来的。LV 的遗传物质是RNA,其在受体细胞中通过逆转录酶和整合酶的辅助下,将病毒基因插入受体细胞基因组中,从而高效的将外源基因导入受体细胞进行表达[15]。LV 的优势在于:拥有广泛的宿主细胞;能感染分裂期和非分裂期的细胞;转染效率高;可在宿主细胞中稳定持续地表达。但也有一些安全性上的考虑:其将基因组整合至宿主细胞中可能导致肿瘤发生;此外,如何防止产生复制能力的HIV 也备受关注[16-17]。
我国深圳市基因免疫医学研究所研究的基于慢病毒的LV-SMENP-DC 疫苗目前正在进行Ⅰ/ Ⅱ期临床试验(NCT04276896)[18]。研究者利用 LV 修饰抗原提呈细胞(antigen-presenting cells,APC),并表达SARS-CoV-2 的微型蛋白,经修饰的LV-DC 将激活CTL 启动机体免疫应答。巴斯德研究所、AIOVA和Sorbonne 大学等机构也陆续开发出LV 疫苗,目前均处于临床前研究阶段。
1.4 新城疫病毒(newcastle disease virus,NDV)载体NDV 是一种不分节段、单负链的RNA 病毒,副黏病毒科禽腮腺炎病毒属。本身无法直接表达蛋白质,需要借助自身RNA 聚合酶转录互补链作为mRNA合成蛋白质。长期以来,NDV 的弱毒株LaSota 和B1株一直作为禽类疫苗的载体用于禽类传染病疫苗的研制,如禽流感、鸡传染性法氏囊病、鸡传染性喉气管炎和传染性支气管炎,其安全性和有效性在动物疫苗中获得了充分证明[19]。由于宿主范围的限制,其在人类和其他灵长类动物中高度减弱,可在宿主的呼吸系统中有效地复制,并诱导宿主对外源性抗原产生强烈的局部和全身免疫应答[20-21]。此外,NDV 弱毒株可以在鸡胚中培养并收获较高的病毒滴度,降低生产成本[21];但NDV 仅存在一种血清型,可能会限制其作为疫苗载体多次使用。
目前,已有多家机构使用NDV 作为载体进行COVID 候选疫苗的研究,如越南医学和疫苗研究所的COVIVAC 疫苗已经进入Ⅰ/ Ⅱ期临床试验,该疫苗使用NDV 表达SARS-CoV-2 S 蛋白膜锚定融合前稳定三聚体,并添加佐剂CpG1018 增强疫苗的免疫原性。此外,还有5 种候选NVD 载体疫苗处于临床前研究阶段(信息来源:https:/ / www.who.int / publications/m /item /draft-landscape-of-covid-19-candidatevaccines)。
1.5 流感病毒载体 在COVID-19 疫苗研究中,流感病毒也被作为一种复制型病毒载体表达SARS-CoV-2的S 蛋白。流感病毒是一种有包膜,遗传物质为分节段的RNA 病毒。将流感病毒作为载体的方式是通过敲除流感病毒的部分毒力基因(如NS1 基因)使病毒减毒,同时,将外源基因敲入病毒基因组中使其感染宿主细胞后随着宿主细胞进行表达[22-23]。因此,流感病毒载体均属于复制型载体。
由香港大学、厦门大学和北京万泰公司联合开发的流感病毒载体新冠疫苗DelNS1-2019-nCoVRBD-OPT1 目前正在进行Ⅱ期临床试验(ChiCTR-2000039715)[24]。该疫苗是删除了流感病毒的NS1基因,将SARS-CoV-2 的S 蛋白插入NS1 基因原有位置,使其随病毒在宿主细胞内复制而表达。除此之外,BioCAD 和IEM 公司、俄罗斯FBRI SRC VB VECTOR 中心和埃及国家研究中心等使用减毒的甲型流感病毒为载体,表达SARS-CoV-2 的S 蛋白而制备的载体疫苗均处于临床前研究阶段(信息来源:https:/ / www.who.int / publications / m / item / draftlandscape-of-covid-19-candidate-vaccines)。
1.6 水泡口炎病毒(vesicular stomatitisvirus,VSV) VSV是有囊膜,遗传物质为单负链的RNA 病毒,最早在上世纪90 年代末期作为载体进行研究,但直至2011 年才开始将重组VSV 在人体中进行评估,并应用于埃博拉疫苗的研究[25]。VSV 作为疫苗载体可搭载至少4 500 bp 长度的外源基因,除了具备能诱导机体产生强大的针对外源基因的体液和细胞免疫外,还能在一些细胞系(如Vero 细胞)中产生较高的病毒滴度(可达109PFU / mL),这将非常有利于重组病毒的大规模生产[26-27]。但相比于DNA 病毒作为载体,VSV 更不易被拯救出来[26]。另外,相比于腺病毒载体大多是复制缺陷型的,VSV 大多属于复制型载体,在一些非人类灵长类动物上有一定神经毒性,因此需要对其安全性问题进行考虑[28]。
目前,仅以色列生物学研究所使用VSV 为载体的 COVID-19 疫苗 rVSV-SARS-CoV-2-S 进入Ⅰ/ Ⅱ期临床试验(NCT04608305)[29],还有 3 款 VSV 载体疫苗正在临床前研究(信息来源:https:/ / www.who.int /publications / m / item / draft-landscape-of-covid-19-candidate-vaccines)。
1.7 其他候选载体 除上述载体外,还有如黄热病病毒(YF17D)、仙台病毒、腺相关病毒等载体可运用于COVID-19 疫苗的研制中(信息来源:https:/ / www.who.int / publications / m / item / draft-landscape-ofcovid-19-candidate-vaccines)。
2 获批上市的重组载体疫苗
目前,全球范围内共有4 款载体疫苗已获得不同国家的上市许可,其载体类型、接种剂次、接种途径和接种程序见表2。目前,在我国范围内授权使用的仅有康希诺生物的克威莎,其在2021 年3 月4 日在我国获得附条件上市批准。
2.1 康希诺生物——克威莎 克威莎是一款基于人Ad5 载体制成的疫苗,通过删去Ad5 的E1 和E3 基因,并导入SARS-CoV-2 的S 蛋白基因使病毒载体在感染细胞后表达。
该疫苗于2020 年3 月17 日于中国武汉启动Ⅰ期临床试验(NCT04313127),共招募了108 名18 ~60 岁健康成年人参与,分为高(1.5 × 1011个病毒颗粒)、中(1 × 1011个病毒颗粒)、低(5 × 1010个病毒颗粒)3 个剂量组,每个剂量组36 人。结果显示,在安全性方面,大部分出现轻微或中度不良反应,如发热、疲劳、头痛和肌肉痛,发生概率分别为46%、44%、39%和17%,无严重不良反应。在有效性方面,注射疫苗28 d 后中和抗体滴度达到峰值,3 个剂量组抗体阳转率分别达到97%、94%和100%;注射疫苗14 d 后,特异性T 细胞数量达到峰值,28 d 后轻微下降,其中高剂量组相比低剂量组差异有统计学意义(P <0.001),与中剂量组差异无统计学意义(P >0.05)[30]。克威莎的Ⅱ期临床试验(NCT04341389)共招募了 603 名健康受试者,并以 2 ∶1 ∶1 的比例随机分组,接种 1 × 1011个病毒颗粒、5 × 1010个病毒颗粒和安慰剂。结果显示,在免疫原性方面,接种疫苗28 d 后,2 个剂量组针对SARS-CoV-2 S 蛋白受体结合域(receptor-binding domain,RBD)的血清抗体阳转率分别为96%和97%,抗体平均几何滴度(geometric mean titer,GMT)分别增长19.5 和18.3倍;产生IFNγ 特异性T 细胞的人数为89.7%和75.6%。在安全性方面,注射疫苗后的28 d 内,1 ×1011个病毒颗粒剂量组有77%的人报告了不良反应,其中报告严重不良反应 24 例(9%);5 × 1010个病毒颗粒组有76%的人报告不良反应,其中严重不良反应1 例(1%)。大部分不良反应为疼痛、乏力、发热和头痛。最终确定Ⅲ期临床的注射剂量为5 ×1010个病毒颗粒。
康希诺生物官网的最新消息,克威莎Ⅲ期临床试验(NCT04526990)的中期分析数据结果显示,单剂接种疫苗28 d 后,疫苗对所有症状的总体保护效力为65.28%;单剂接种疫苗14 d 后,疫苗对所有症状总体保护效力为68.83%。单针接种疫苗28 d后,疫苗对重症的保护效力为90.07%;单针接种疫苗14 d 后,疫苗对重症的保护效力95.47%[31]。
克威莎是目前唯一单针免疫程序的新冠疫苗。单针免疫的优势在于快速实现免疫保护,缩短接种周期,可在极短的时间内实现群体免疫。另外,该疫苗可于2 ~8 ℃保存,疫苗可及性较好。
2.2 牛津大学/阿斯利康——AZD1222 AZD1222 是以一种复制缺陷型的猩猩来源的Ad ChAdOx1 为载体,在载体中导入SARS-CoV-2 全长S 蛋白序列,并加入组织纤溶酶激活剂前导序列,使其可表达密码子优化的S 蛋白编码序列,并可在2 ~8 ℃保存。
AZD1222 的Ⅰ/ Ⅱ期临床试验(NCT04324606)共招募了1 087 名受试者接种1 剂AZD1222 或1剂MenB ACWY 脑膜炎结合疫苗,其中10 人接受2剂AZD1222。结果显示,AZD1222 相比MenB ACWY脑膜炎结合疫苗具有更高的不良反应率,但依旧安全且耐受,未出现严重不良反应,大部分仅为自限性的轻、中度反应。其中,疲劳和头痛是最常见的不良反应,接种1 剂AZD1222 者分别有70%和68%人出现;此外,肌肉疼痛(60%)、不适(61%)和寒战(56%)较为常见[32];另外,接种疫苗前预防性注射扑热息痛可显著减少发生不良反应的概率[32]。在免疫原性方面,接种1 剂疫苗28 d 后,抗S 蛋白IgG 达到峰值,中位数为157 EU,如果在28 d 时加强免疫1剂,则第56 天IgG 中位数可达639 EU,表明初次免疫-加强免疫的免疫效果要显著强于单剂免疫;此外,IFNγ 特异性T 细胞在接种疫苗14 d 时到达峰值,为856 个 / 百万个单个核细胞[32]。EWER 等[33]继续对Ⅰ/ Ⅱ期临床试验中接受1 剂AZD1222 部分样品的T 细胞诱导的免疫应答和抗体水平进行研究,结果显示,疫苗诱导了以分泌TNF-α、IFNγ 为特征的Th1细胞免疫应答,同时诱导出细胞毒性的CD8+T 细胞;抗体产生主要类型为IgG1 和IgG3,说明诱导了Th1 型免疫应答。
AZD1222 在英国、巴西和南非Ⅲ期临床试验中期分析(ISRCTN89951424、NCT04324606、NCT0440-0838、NCT04444674)结果显示,疫苗总体有效率为70.4%,连续接种2 剂标准剂量的保护率为62%,首先接种1 剂低剂量(一半标准剂量),然后接种1 剂标准剂量的保护率可达90%[34]。另外一项在英国进行的Ⅱ/ Ⅲ期临床试验(NCT04400838)结果显示,疫苗在70 岁以上老年人群中安全耐受,所有年龄段具备类似的免疫原性[35]。

表2 目前上市的COVID-19 重组载体疫苗Tab.2 Approved recombinant vector vaccine against COVID-19
研究者还对疫苗是否对病毒变异株有保护效果进行了研究,一项在南非开展的双盲、随机试验(NCT04444674)结果显示,接种2 剂AZD1222 对于南非变异株B.1.351 的保护效果仅10.4%,对南非变异株未显示出较好的保护效果[36]。另一项在英国进行的临床试验(NCT04400838)结果显示,疫苗对于英国变异株B.1.1.7 和非变异株B.1.1.7 的保护效果分别为70.4%和81.5%,对于英国变异株具有较好的保护效果[37]。
2.3 俄罗斯Gamaleya 公司——Sputnik V Sputnik V是由重组腺病毒Ad26 和重组腺病毒Ad5 组成的异源COVID-19 疫苗,2 个重组载体均可表达SARSCoV-2 的S 蛋白,分别使用2 种重组载体疫苗进行初次免疫-加强免疫。Sputnik V 在俄罗斯的Ⅰ/ Ⅱ期临床试验入组76 名18 ~60 岁的受试者,分别对疫苗的安全性、耐受性、剂型选择(冻干或冷冻)和免疫原性进行了评估(NCT04436471 和NCT04437875)。结果显示,Sputnik V 的安全性和耐受性良好,大多为轻度不良反应,未出现严重不良反应。注射部位疼痛(58%)、体温偏高(50%)、头痛(42%)、乏力(28%)和肌肉关节疼痛(24%)是主要的不良反应。在免疫原性方面,注射疫苗21 d 后,冻干和冷冻的疫苗所产生的抗体阳转率均为100%;注射2 剂疫苗42 d后,GMT 分别达到49.25(冷冻)和45.95(冻干)。在细胞免疫方面,接种疫苗28 d 后,CD4+T 和CD8+T细胞数量显著上升;接种冷冻剂型后两类细胞数量的中位数分别增长了2.5%和1.3%,接种冻干剂型则增长了1.3%和1.1%。此外,研究者发现,在初次免疫后,机体会产生针对载体的免疫应答,而后通过使用异源载体进行初次免疫-加强免疫的策略能克服这一问题,增强了疫苗的免疫原性[38]。
Sputnik V 的Ⅲ期临床试验的中期分析(NCT-04530396)结果显示,疫苗的有效率为91.6%;接种21 d 后,对于中度和重度肺炎的有效率可达100%。免疫原性方面,接种疫苗的42 d,受试者针对S 蛋白的血清抗体阳转率为98.2%,GMT 为8 996;中和抗体的GMT 为44.5,中和抗体阳转率为95.83%;此外,在接种1 剂疫苗的28 d,单个核细胞分泌的IFNγ含量达32.77 pg / mL,明显高于接种前水平。在安全性方面,12 296 名受试者中有94%报告了1 级不良反应,5.66%和0.38%受试者分别报告了2 级和3 级不良反应,其中严重不良反应均被认定与疫苗无关。另外,此次对于60 岁以上人群也进行了研究,结果显示,60 岁以上人群与18 ~60 岁人群相比,效力无显著差异,同时对疫苗具有较好的耐受性,常见的不良反应为流感样疾病(15.2%)和局部反应(5.4%)[39]。
最近有研究者研究了Sputnik V 诱导的抗体对E484K 的突变株和B.1.351 变异株的中和活性,发现对2 种变异株的血清中和活性的中位数分别降低了2.8 和6.1 倍,病毒变异株对疫苗的效果具有一定影响[40]。
Sputnik V 除了良好的有效性和安全性,其低于10 美元 / 剂的成本也具有巨大的竞争力,目前已获得40 余个国家紧急使用许可。尽管该疫苗的液体剂型需要-18 ℃冷冻储存,但即将问世的冻干剂型可以在2 ~8 ℃储存和运输,增加了疫苗的可及性。
2.4 强生杨森制药——AD26.CoV2.S 美国强生公司旗下杨森制药的AD26.CoV2.S 是基于人腺病毒载体Ad26 研制,可表达SARS-CoV-2 的S 蛋白。其Ⅰ/ Ⅱa 期临床试验中(NCT04436276),分别研究了高剂量(1 × 1011个病毒颗粒)和低剂量(5 × 1010个病毒颗粒)疫苗对18 ~55 岁及大于65 岁人群的安全性和免疫原性。在18 ~55 岁人群中,低剂量和高剂量组报告的局部不良反应人数占比分别为64%和78%,报告的全身不良反应人数占比分别为65%和84%,报告的3 级不良反应人数占比分别为9%和20%;在大于65 岁人群中,低剂量和高剂量组报告的的局部不良反应人数占比分别为41%和42%,报告的全身不良反应人数占比分别为46%和55%,报告的3 级不良反应人数占比分别为1%和2%。表明老年人群对疫苗具有更好的耐受性。试验中未出现4 级不良反应,大部分不良反应在接种后1 ~2 d 内消退,无受试者因不良反应退出试验。免疫原性方面,接种单剂疫苗后,针对野生型病毒的中和抗体 GMT 值在 29 d 达 224 ~ 354,在 57 d 达 288 ~488,抗体阳转率100%;另外,接种2 剂疫苗后抗体效价可提高2.6 ~2.9 倍,中和抗体GMT 值达827 ~1 266。细胞免疫方面,18 ~55 岁人群诱导的特异性CD4+T 和CD8+T 细胞应答人数分别占76% ~83%和51%~64%,大于65 岁人群为60%~76%和24% ~36%。其中被检测到的受试者Th1 / Th2 细胞比例大于 1,更偏向于 Th1 应答[41]。
在目前公布的Ⅲ期临床结果中(NCT04505722),以14 和28 d 后发病为观察重点的疫苗有效率分别达到66.9%和66.1%。其中以14 d 后发病为观察终点,大于60 岁老年人群比18 ~60 岁人群的有效率更高(76.3% vs 63.7%),而以28 d 后发病为观察终点,2 组人群有效率相似(66.2% vs 66.1%),性别和民族间的效力无显著差异。此外,疫苗在11 周内未发现疗效降低,与Ⅰ/ Ⅱ期临床结果相似。在疫苗安全性方面,疫苗组中报告最多的局部不良反应是注射部位疼痛(48.6%),报告全身不良反应有头痛(38.9%)、疲劳(38.2%)、肌肉疼痛(33.2%)和恶心(14.2%);报告3 级不良反应疫苗组和安慰剂组人数均为该组受试人数的0.4%;此外,有7 个严重不良反应被认为与疫苗相关,如格林-巴利综合征、心包炎、面部麻痹等[42]。
Ⅲ期临床中疫苗针对变异株的有效性也进行了研究,认为疫苗对于E484K 的变异株和南非B1.351.1 变异株的效力不减[42]。VANDER 等[43]在仓鼠模型中研究了疫苗对于D614G 变异株的保护效果,接种1 剂疫苗可诱导动物产生大量中和抗体,可保护80%以上的仓鼠完全预防肺部感染和肺炎,接种2 剂疫苗可提高中和抗体滴度并能至少降低肺部6 个log10 的病毒载量。
3 COVID-19 重组载体候选疫苗
截至2021 年5 月,除上述4 款疫苗外,还有17款疫苗正在进行临床试验以及41 款疫苗正在进行临床前研究,见表 3 和表 4。信息来源:https:/ / www.who.int / publications / m / item / draft-landscape-ofcovid-19-candidate-vaccines。
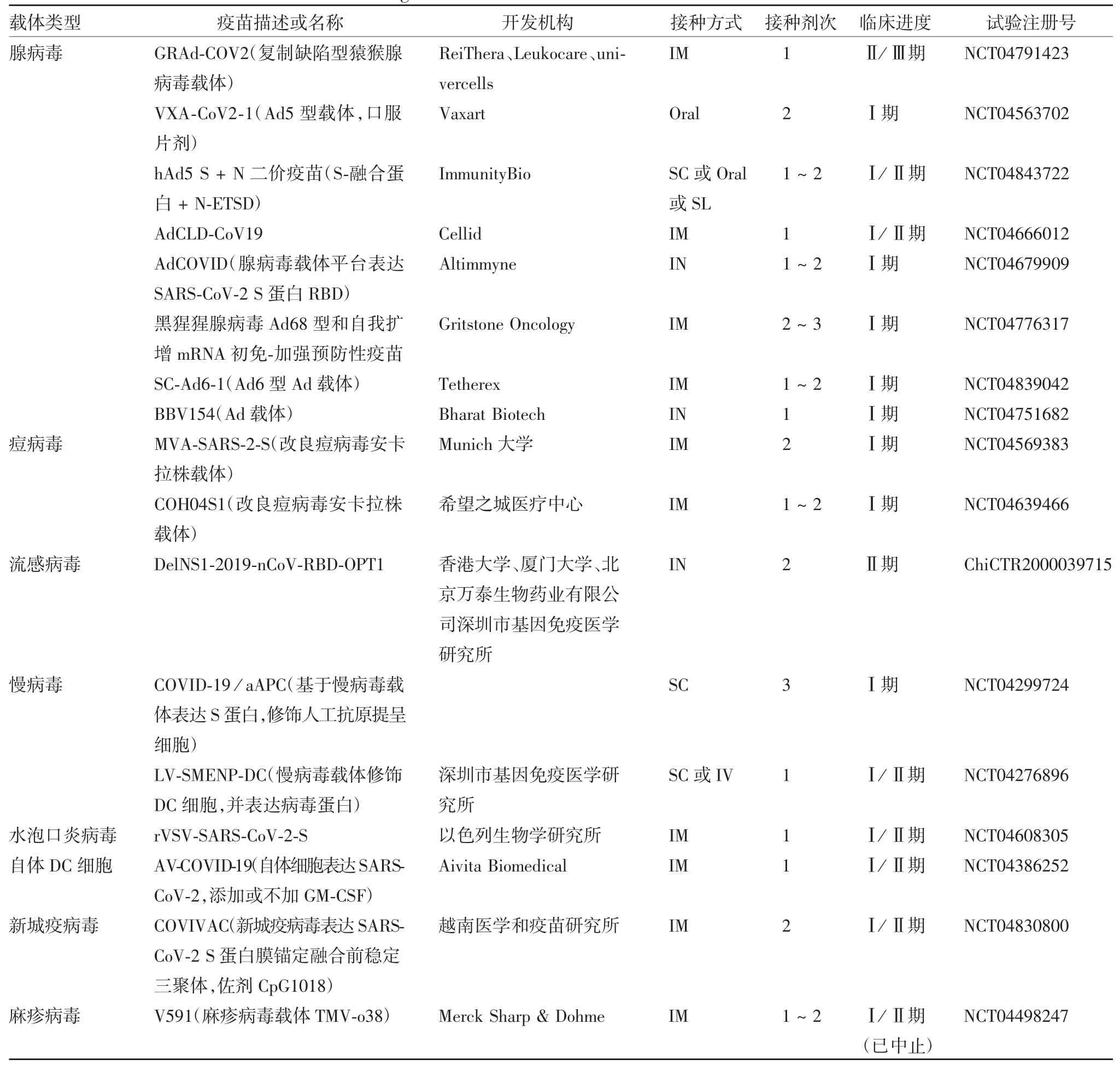
表3 正在临床试验的COVID-19 重组载体候选疫苗Tab.3 Recombinant vector vaccine candidate against COVID-19 in clinical trials

表4 临床前研究的COVID-19 候选疫苗Tab.4 COVID-19 vaccine candidate in preclinical studies
4 挑战与展望
以各类载体为基础研制的COVID-19 疫苗,为SARS-CoV-2 抗原在体内的递送提供了高效的工具,具有巨大的应用前景,但有些问题尚需进一步研究。
4.1 安全性问题 疫苗的安全性是疫苗的重要考量因素,据报道,欧洲地区已有200 多例因接种阿斯利康(AZD1222)或强生公司(Ad26.CoV2.S)生产的腺病毒载体疫苗出现严重凝血功能障碍[44]。有一种推测认为,这些病例是疫苗引起的异常免疫应答导致的[44]。每剂疫苗有约500 亿个病毒颗粒,其中一部分会分裂并释放其DNA。由于DNA 带负电,与肝素一样可以结合体内带正电荷的PF4 并形成复合物。这些复合物会激发机体免疫应答,产生对复合体的抗体导致凝血功能障碍。SCULLY 等[45]报道了23例接种阿斯利康疫苗后6 ~24 d 出现血栓形成和血小板减少患者的研究结果,23 名患者中22 名患者抗PF4 抗体呈阳性,所有患者均出现D-D 二聚体水平增高和血小板减少等症状,其中造成7 名患者死亡。提示快速鉴别这类罕见的不良反应并迅速接受相关治疗是至关重要的。尽管一些流行病学专家认为相比于极为罕见的不良反应,接种疫苗所获得的好处要高于其风险,但对疫苗在机体内引起免疫应答的机制,以及引起凝血功能障碍的原因需进一步调查,并提前采取措施对罕见不良反应进行预防,以确保疫苗使用的安全性。
4.2 对突变株的保护效果 截至2021 年5 月,世界多个国家和地区发现了SARS-CoV-2 不同变异株,如英国突变株B.1.1.7、南非突变株B.1.351、巴西突变株P.1、美国加州突变株B.1.429 和B.1.427、英国/尼日利亚突变株B.1.525 和印度突变株B.1.617等[46]。这些新发病毒变异株不仅导致新一轮的疫情暴发,也对疫苗的保护效果提出了严重挑战。目前,仅Ad26.COV2.S 和AZD1222 两种重组载体疫苗的研究人员公开发表了针对部分病毒变异株的保护效果研究,结果显示变异株的确会对疫苗的保护效果造成一定影响。由于SARS-CoV-2 与流感病毒一样属于RNA 病毒,同样具备很高的变异率。如果SARS-CoV-2 未来与流感病毒一样持续的全球流行,那么对于SARS-CoV-2 疫苗的研究是否也应该与流感疫苗一样需要进行多价疫苗和通用疫苗的研究,尚需进一步探讨。
另外,尽管S 蛋白作为病毒结合细胞表面血管紧张素转换酶-2(angiotensin converting enzyme-2,ACE2)并介导病毒侵染细胞的重要蛋白,但可能还有针对SARS-CoV-2 除S 蛋白以外的蛋白能够作为疫苗候选靶点。AHMED 等[47]通过美国国家过敏症和传染病研究所(National Institute of Allergy and Infectious Diseases,NIAID)病毒病原体和分析资源数据库、免疫表位数据库,比较了SARS-CoV-1 和SARSCoV-2 的 B 细胞和 T 细胞表位,发现了 S 和 N 蛋白的一些靶点非常稳定,可以作为疫苗研究的候选靶位。目前,有2 款表达S 和N 蛋白的二价载体疫苗分别正在临床试验和临床前研究。随着生物信息学的飞速发展,未来将会有更多候选表位会被发掘并有助于多价和通用疫苗的研究。
4.3 疫苗保护的持续时间 随着全球COVID-19 疫情的持续,更多的学者和民众提出了接种疫苗后疫苗保护时间的问题,以及是否需要定期接种疫苗。目前,由于所有疫苗的Ⅲ期临床试验尚未结束,大多数疫苗仅仅观察了3 ~6 个月的保护效果,尚无法得出准确答案,这些问题将随着疫苗Ⅲ期临床试验的完成而揭晓。同时,这也与全球疫情的流行密切相关,此次疫情是否演变成流感一样常见的流行病也将决定疫苗接种的频率。
重组载体疫苗作为一种新型疫苗,其研究历史仅30 余年,COVID-19 疫情大大促进了载体疫苗的研发进程并首次实现了在人群中的大规模使用。随着反向疫苗学、疫苗组学、结构疫苗学等多学科的发展以及疫苗设计更趋于理性化,重组载体疫苗会具有巨大的研发潜能。开发出更多、更安全、表达抗原更稳定的疫苗载体,达到更好的免疫原性和更高的安全性,均有待于研究者进一步去探索。此外,开发一款通用SARS-CoV-2 重组载体疫苗来应对持续不断的疫情也是目前的研究热点。

