1.5T MRI及其ADC值与胰腺癌临床病理特征及预后的关系
史旭波,黄奕彬,彭焕佳,林楚岚
胰腺癌属消化系统常见恶性肿瘤,据报道,近年来世界范围内胰腺癌发病率与死亡率均呈逐年上升趋势,预计到2030年将跃居癌症死亡原因的第2位,而80%的患者在确诊时已发现存在局部转移[1]。目前手术仍是胰腺癌的主要治疗手段之一,而术前准确评估胰腺癌患者病理特征、正确规划手术治疗方式,对改善患者预后尤为重要。影像学是评估胰腺癌病理特征的重要手段之一,临床常用的影像学方法包括计算机断层扫描(computed tomography,CT)、磁共振成像(magnetic resonance imaging,MRI)、超声等,其中MRI因具有良好的软组织分辨率、可多方向和多序列成像、无辐射损害等优点,被认为与CT相当甚至更优,已被广泛用于胰腺癌的诊断及鉴别诊断[2-3]。但常规MRI扫描对胰腺癌病理鉴别灵敏度较低,在鉴别组织浸润程度等方面价值有限。而弥散加权成像(diffusion weighted imaging,DWI)作为MRI的功能性成像技术,可弥补常规MRI的不足,通过测量组织水分子的表观扩散系数(apparent diffusion coefficient,ADC)来定量描述肿瘤组织内自由水分子的扩散能力情况,反映组织细胞的功能活动状况,利于客观评价病变特征[4]。本研究回顾性收集揭阳市慈云医院收治且病理学确诊的胰腺癌患者的临床病理资料,分析DWI参数ADC值与胰腺癌患者临床病理特征及预后的关系,以期为临床胰腺癌诊治提供参考。
1 资料与方法
1.1 研究对象
回顾性分析2017年1月至2019年10月揭阳市慈云医院收治的98例胰腺癌患者的临床病理资料。98例患者中,男66例,女32例;年龄≥60岁59例,<60岁39例;肿瘤位置:胰头65例,胰体尾33例;肿瘤最大直径:≥4 cm者77例,<4 cm者21例;TNM分期:Ⅰ~ⅡA期58例,ⅡB~Ⅲ期40例;肿瘤分化程度:中-低分化58例,高分化40例;淋巴结转移者43例;神经侵犯者40例;血管侵犯者38例。本研究经揭阳市慈云医院伦理委员会审核同意。
1.2 纳入及排除标准
1.2.1 纳入标准 ①胰腺癌诊断以病理学检查为依据,患者确诊为胰腺导管腺癌;②既往无严重心、肾、脑、肺及代谢疾病等基础疾病;③术前均行MRI常规扫描与DWI检查;④术前未接受放疗、化疗、生物免疫治疗或其他抗肿瘤辅助治疗;⑤年龄>18岁;⑥患者均行胰腺癌根治性手术;⑦临床资料及随访资料齐全。
1.2.2 排除标准 ①既往有其他恶性肿瘤病史、精神病史;②严重出凝血功能异常和(或)自身免疫性疾病、感染性疾病;③因运动伪影或其他因素导致MRI图像质量不清晰;④有MRI检查禁忌症,如幽闭恐惧症、安装有心脏起搏器、体内有金属植入物等;⑤其他病理类型的胰腺癌患者,如胰腺囊性肿瘤、胰腺神经内分泌肿瘤、胰腺鳞癌等;⑥术前发生远处转移;⑦围手术期死亡及非肿瘤性死亡患者;⑧随访期间失访患者;⑨接受新辅助放化疗者。
1.3 方法
1.3.1 检查方法 采用双梯度1.5T Achieva磁共振超导型MRI进行检查。检查前禁食4~6 h,并于扫描前向患者介绍注意事项,训练其呼吸及最大屏气时间,嘱其检查过程中保持平稳呼吸并减少肢体活动。患者仰卧位,足先进,应用8通道腹部相控阵线圈,以呼吸门控辅助,尽量固定相控线圈,减少因呼吸等原因所致运动伪影。于常规扫描轴位T1加权图像(T1 weighted images,T1WI)、脂肪抑制T2加权图像(T2 weighted image,T2WI)后,通过前臂静脉团注对比剂钆喷酸葡胺(北京北陆药业股份有限公司,国药准字H10960045), 剂量0.1 mmol/kg,注射速度3.0 mL/s。对比剂注射后分别于第20 s、50 s、180 s获取动脉期、静脉期、延迟期轴位图像,采用快速容积三维成像(liver acquisition with volume acceleration,LAVA)序列,反转时间(inversion time,TI)5.0 ms,重复时间(repeated time,TR)2.7 ms,回波时间(echo time,TE)1.3 ms,矩阵270×224,扫描视野(field of view,FOV)380 mm×300 mm,层厚5 mm,层间距2.5 mm,激励次数(number of excitations,NEX)0.72。于静脉期与延迟期之间获取冠状位增强图像,TI 5.0 ms,TR 3.8 ms,TE 1.6 ms,矩阵256×200,FOV 400 mm×400 mm,层厚3.2 mm,层间距2.4 mm,NEX 0.72。DWI采用单次激发自旋回波-回波平面成像(spin echo-echo planar imaging,SE-EPI)序列, TR 5200 ms,TE 79 ms,矩阵128×128,FOV 200 mm×200 mm,层厚 4 mm,层间隔1 mm,b值采用0、 500 s/mm2。后将扫描数据传至GE ADW4.6 工作站行图像后处理。选择病灶显示最大中心层面,于每个肿块内勾勒圆形感兴趣区3次,并测量ADC值。由2名经验丰富的影像科副主任医师以双盲法阅片。
1.3.2 手术方式及预后随访 98例胰腺癌患者均行根治性手术,其中胰十二指肠切除66例,胰腺中段切除3例,胰体尾切除29例。术后采用电话回访、门诊或住院复查等方式进行随访,按月计算患者术后生存时间,起点为手术时间,终点为患者死亡时间或随访至12个月。
1.4 统计学方法

2 结果
2.1 影像学表现
常规MRI扫描显示,98例患者病灶均呈稍长或长T1、稍长T2信号。而98例患者DWI图像呈等、稍高及明显高信号,其中34例呈稍高信号,与周围组织的分界较为模糊;13例呈等信号,与远端胰腺组织信号并无显著差异,境界模糊;51例呈明显高信号,境界清楚(见图1~图3)。

图1 65岁,男,胰头部中分化腺癌,侵犯十二指肠壁及胰腺外软组织,见脉管瘤栓及神经侵犯,免疫组化结果:CD34(血管+),CEA(+),CK7(+),CK20(-),P53(少数+),Ki-67(约20%+)。胰腺切缘阳性,胰管上皮见重度异型增生;胃切缘及小肠切缘阴性
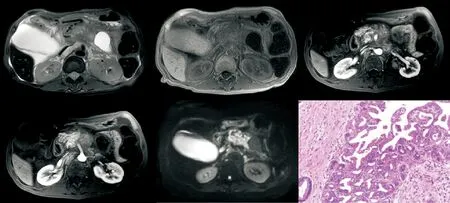
图2 男性,64岁,上腹痛伴全身皮肤瘙痒半月余,伴巩膜黄染。病理诊断:(胰头肿物),穿刺组织内大量红细胞、破碎柱上皮等、部分上皮乳头状增生,核具有异形性,结合临床,考虑腺癌
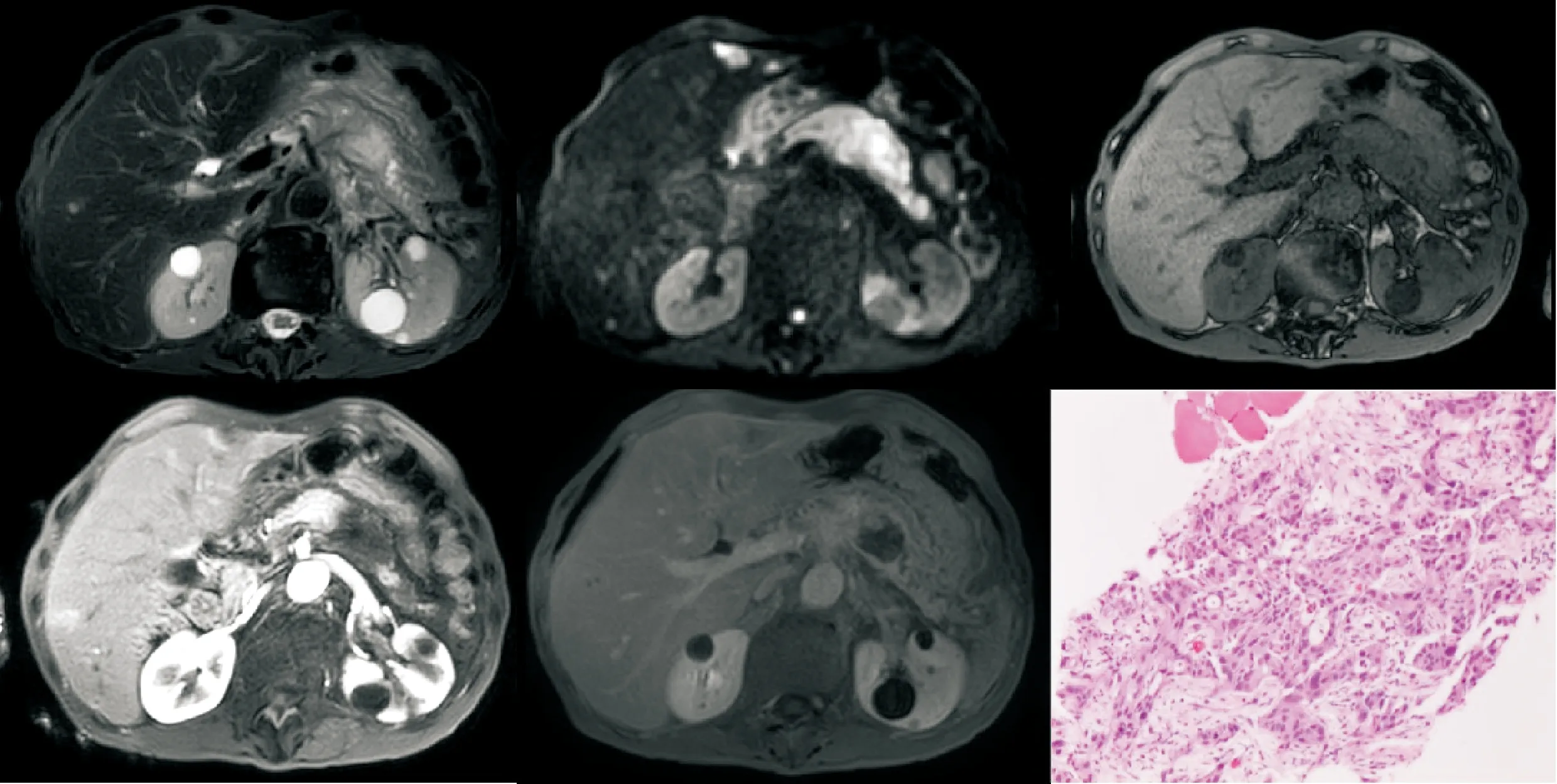
图3 (胰腺尾部占位)穿刺胰腺组织内浸润性腺癌,纤维性间质增生、硬化,免疫组化结果:CK7(+),CK19(+),MUC-4(+),CDX-2(-),P53(约60%强+),Ki-67(热点灶约60%+),结合临床,病变考虑胰腺导管腺癌(中-低分化)
2.2 ADC值与胰腺癌临床病理特征的关系
ⅡB~Ⅲ期者ADC值显著低于Ⅰ~ⅡA期者(P<0.05);中-低分化者ADC值显著低于高分化者(P<0.05);有淋巴结转移者ADC值显著低于无淋巴结转移者(P<0.05);有血管侵犯者ADC值显著低于无血管侵犯者(P<0.05),见表1。
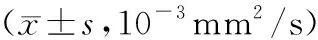
表1 ADC值与胰腺癌临床病理特征的关系
2.3 胰腺癌患者预后分析
所有患者术后均得到有效随访,随访时间为3~12个月,中位随访时间为6个月,无失访病例。98例患者中,死亡34例,占34.69%;存活64例,占65.31%。死亡组TNM分期为ⅡB~Ⅲ期、中-低分化、淋巴结转移、血管侵犯的比例显著高于存活组(P<0.05),且ADC值≤1.09×10-3mm2/s的比例显著高于存活组(P<0.05);两组性别、年龄、肿瘤位置、肿瘤最大直径、神经侵犯比较差异无统计学意义(P>0.05),见表2。

表2 死亡组与存活组临床病理特征比较 [n(%)]
2.4 影响胰腺癌患者预后的多因素Logistic回归分析
将胰腺癌患者预后状况作为因变量,将TNM分期、肿瘤分化程度、淋巴结转移、血管侵犯、ADC值作为自变量,纳入Logistic回归分析模型,行量化赋值,见表3。多因素Logistic回归分析显示,除TNM分期、肿瘤分化程度、淋巴结转移、血管侵犯外,ADC值也是胰腺癌患者预后不良的独立危险因素(P<0.05),见表4。

表3 量化赋值表
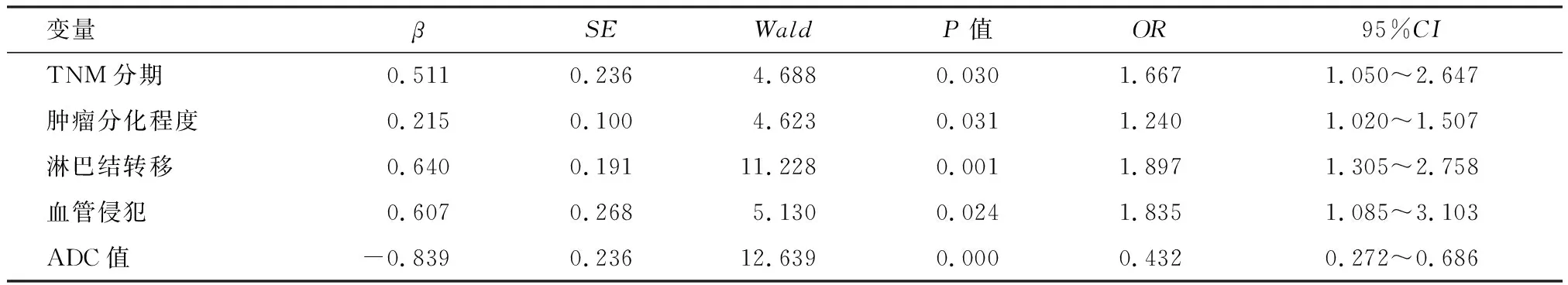
表4 影响胰腺癌患者预后的多因素Logistic回归分析
3 讨论
胰腺癌属一种常见的腹腔恶性肿瘤,起病较为隐匿,好发于胰头部,45~65岁多发,恶性程度高,早期通常无明显症状,出现症状时往往已进入晚期,预后差,Ⅰ期5年生存率约为8%,而Ⅳ期5年生存率仅为3%[5-6]。目前根治性手术是治疗该病的首选方式,但具体手术方式的制定与肿瘤部位、大小等密切关联,同时考虑肿瘤分期、淋巴结转移、病理学分级、血管和神经侵犯等是影响患者术后预后的重要因素,故早期判断胰腺癌临床病理特征并制定合理的手术方案,对患者预后尤为重要[7-9]。而MRI具有无创伤、无辐射、软组织分辨率高等特点,是目前临床公认的评估胰腺癌的重要影像学手段。DWI作为MRI的一种功能性成像技术,可自分子水平上检测肿瘤组织病理生理改变情况,其定量指标ADC值已被证实在胰腺癌早期诊断及鉴别诊断方面具有重要价值。Dalah等[10]报道认为,ADC值大小与组织内细胞排列分布状况、胞内大分子物质含量、细胞膜完整程度等密切相关,通常肿瘤组织内细胞增殖活跃,细胞密度增加,水分子扩散受限较正常组织更为明显,故其ADC值较低。因此,通过ADC值可定量反映胰腺癌扩散受限程度,从而判断ADC值与临床病理特征之间的关系[11-12]。但目前鲜有报道分析DWI参数ADC值与胰腺癌患者临床病理特征及预后的关系,故本研究对此进行初步探讨。
本研究结果显示,ADC值与胰腺癌患者性别、年龄、肿瘤位置、肿瘤最大直径均无明显关系,但与TNM分期、肿瘤分化程度明显相关,TNM分期越晚、分化程度越低的患者,ADC值越低。方乐平等[13]报道TNM分期是判断癌细胞或组织部位和淋巴结近、远处转移的常用指标,其分期越晚,提示癌细胞恶性程度越高,预后越差;中、高分化型癌细胞多呈成熟形态,生长缓慢,恶性程度较低,转移风险偏小,而低分化肿瘤细胞具有增殖潜质,转移发生风险较高,影响患者术后预后。笔者推测,胰腺癌患者TNM分期越晚,预示肿瘤转移、浸润程度越严重,组织内水分子扩散更易受限,导致ADC值越低;而胰腺癌组织分化程度越低,提示细胞越不成熟、核异型性明显,肿瘤细胞增多且体积偏大,细胞核、胞浆比大,细胞排列紧密,致使微血管密度升高,细胞外间隙明显减小,促使组织细胞内水分子扩散运动受限,导致ADC值较低[14-16]。
本研究结果显示,ADC值与胰腺癌患者淋巴结转移有关,与Ma等[17]报道相似,推测存在淋巴结转移者肿瘤细胞生长较为迅速,细胞分裂快,组织间隙窄,细胞密度较高,水分子扩散欠佳,故ADC值明显下降。但有报道表明,淋巴结转移与其发生部位、病理类型、分化程度等因素密切相关,单一测量肿瘤病灶ADC值并不能完全反映淋巴结转移状态[18]。因此,关于ADC值与胰腺癌患者淋巴结转移的关系,今后仍需深入探讨。此外,本研究发现,ADC值与胰腺癌患者血管侵犯有关,推测可能与血管侵犯所致肿瘤血流灌注变化有关。
本研究结果显示,98例患者术后均随访3~12个月,发现存活64例,占65.31%,与陈凯等[19]报道的结论(胰腺癌根治术患者术后1年生存率为65.1%)相似。陈燕等[20]也报道胰腺癌患者术后1年生存率仅为63.9%,证实了本结论。而目前关于胰腺癌手术患者的预后因素,临床相关报道较多,其中TNM分期、淋巴结转移、血管侵犯被认为是影响胰腺癌患者生存预后的独立因素[21]。本研究结果显示,TNM分期、淋巴结转移、血管侵犯是胰腺癌患者预后不良的独立危险因素,与既往报道[22]基本一致。TNM分期越晚,术后预后越差,可能由于晚期患者肿瘤已出现广泛浸润转移,致使肠系膜血管和腹腔大血管被侵犯,导致预后较差;有淋巴结转移的胰腺癌患者肿瘤体积往往较大,肿瘤已侵犯至胰腺外,中晚期患者多,肿瘤分化程度较差,故预后较差;而血管侵犯也意味着肿瘤侵犯周围脏器及血管,提示可能预后不良。
此外,本研究结果显示,ADC值也是胰腺癌患者预后不良的独立危险因素,提示ADC值越低,患者预后可能越差。王子晗等[23]报道胰腺癌放疗前后ADC值变化对胰腺癌放疗后疗效评价具有重要应用意义。陆海凤等[24]报道ADC是胰腺癌化疗早期疗效的有效评价指标,早期ADC值变化与患者生存率密切相关。国外也有大量报道表明,ADC值与癌症患者预后密切相关,是判断患者预后的独立因素[25]。推测原因,胰腺癌多数是因胰腺导管上皮细胞病变所致,病变的肿瘤细胞多属有序致密排列,细胞间质中往往有大量增生纤维出现,致使细胞外空间变小,细胞间压力剧增,导致水分子扩散受限,故胰腺癌区ADC值减低;而ADC值越低,反映肿瘤侵袭性越强,恶性程度越高,提示预后越差。
综上所述,MRI DWI参数ADC值可较好反映胰腺癌患者病理特征,与TNM分期、肿瘤分化程度、淋巴结转移、血管侵犯密切相关,同时也是患者术后预后不良的独立危险因素,可为胰腺癌患者诊疗方案的制定及预后评估提供参考,临床应引起足够重视。

