透明帽辅助内镜下切除术治疗直径≤10 mm胃黏膜下肿瘤的安全性分析
罗宇晨,林壁涛,张玥,乔伟光,张强,智发朝,李跃,刘思德
消化道黏膜下肿瘤(submucosal tumors,SMT)是起源于消化道黏膜层以下各层(主要包括黏膜肌层、黏膜下层及固有肌层)的隆起性病变,大多数SMT表现为良性病变,恶性病变不足15%[1]。据研究发现常规胃镜下SMT检出率可达0.3%~2.0%[2]。另外,胃SMT组织病理学类型复杂,主要表现为胃肠间质瘤(gastrointestinal stromal tumor,GIST)、平滑肌瘤及异位胰腺[3]。近年来由于内镜技术的成熟及其切除SMT安全有效、并发症少、费用低等优势凸显,内镜下治疗成为了治疗SMT的主要治疗方式[4-5]。内镜下切除术(endoscopic resection,ER)已是那些依从性较差且无相关手术禁忌症的胃小SMT患者的首选术式。目前运用最广泛的手术有内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)和内镜全层切除术(endoscopic full-thickness resection, EFTR)。在实际临床工作中,对于直径>10 mm的胃SMT,ESD及基于ESD的EFTR均是安全有效的内镜治疗方式。但是ESD和EFTR在直径≤10 mm的胃SMT治疗方面似乎显得十分复杂且操作困难,且不一定能取得好疗效。透明帽辅助内镜下切除术(cap-assisted endoscopic resection,CER)和内镜下套扎术(endoscopic band ligation,EBL)具有简单、快捷及方便等优点,因此,我院内镜中心通常采用此两种术式治疗直径≤10 mm胃SMT。本团队通过采用CER切除28例胃SMT来初步验证,所有患者均完全切除,平均手术时长为23.9 min[6]。然而在接下来几年里,我们将CER大规模运用于临床的过程中发现了些许问题,特别是当多个患者在不同时期发生严重出血时,我们开始重新评估CER的安全性。因此,本文旨在评估及比较CER和EBL治疗直径≤10 mm的胃SMT的安全性。
1 资料和方法
1.1 一般资料
本研究回顾性收集了2010年6月至2017年6月在南方医科大学南方医院诊断为原发性胃SMT患者562例,其中227例符合本研究纳入标准。纳入标准:①明确诊断为胃SMT;②SMT最大直径≤10 mm;③患者无法定期监测胃SMT。排除标准有:①伴有严重疾病,如晚期恶性肿瘤、器官衰竭等;②胃SMT发生邻近播散者已行胃切除术或远处转移。本研究收集了包括性别、年龄、临床症状、肿瘤位置、肿瘤大小及病理结果等在内的标准人口学资料及临床资料,记录了包括手术时长、术中出血量、术中穿孔率、术后出血率、住院时间及并发症发生率等的手术细节。其中并发症定义为术中及住院期间术后出血、内镜下无法处理的穿孔及严重感染。术中出血量由抽吸液总量与输液量之差计算得出。本研究经南方医科大学南方医院机构审查委员会批准(NO.NFEC-2017-149),并且遵行《赫尔辛基宣言》。
1.2 治疗方法
1.2.1 术前准备 患者入院后完善三大常规、凝血功能、生化功能及胃肠道肿瘤标志物等检查,排除手术禁忌症。术前患者已行普通胃镜及超声胃镜检查,检查结果包括肿瘤大小、肿瘤位置、肿瘤起源、表面情况。服用抗小板药物及抗凝药的患者于术前停药1周。
1.2.2 手术操作 所有进行ER的术者均为具有3年以上内镜治疗经验的内镜医师。在我们首次报道中[6],CER之前称为透明帽吸引肿物切除术(cap-aspiration lumpectomy, CASL)。其操作步骤如下:透明帽安装在内镜前端,进镜后在内镜下定位胃SMT,确定肿物具体位置后轻轻吸取小片肿物上覆盖的胃黏膜组织。将圈套器通过透明帽轻轻收紧固定于透明帽所吸引的圆形组织周围,随后加大吸引将肿物连同上覆黏膜全部吸引入透明帽中,将圈套器进一步送向已被吸引入透明帽中的组织根部并进一步收紧圈套器,可反复进行上述步骤直至圈套器被固定在合适位置并完全收紧。随后将肿瘤及上覆黏膜通过电灼烧完整切除。将切除的肿瘤吸引出并送检病理科。在没有透明盖的情况下再次行内镜检查,以便仔细评估创面是否出现穿孔、动脉出血或肿瘤残留等情况。最后用钛夹封闭创面或穿孔部位(图1a-d)。EBL操作步骤为使用尖端带有透明盖的标准内镜,将透明帽盖于病灶上方,施加最大持续吸引,在肿物基底部周围松开套扎器(图1e-h),肿物结扎后会发生局部缺血,随后脱落。建议所有患者术后定期内镜下随访,以便发现肿瘤残留及复发情况。

图1 CER(A-D)和EBL(E-H)具体步骤 A:将透明帽安装于内镜尖端,高频电圈套器固定于透明帽环形凹槽中,定位SMT;B:充分吸引,将肿瘤吸入透明帽后收紧圈套器,切除肿瘤;C:全层切除术后出现穿孔;D:然后用钛夹闭合穿孔。E:多带套扎器固定于内镜尖端,靶向SMT;F:充分吸引,将肿瘤吸入透明帽内后,在基部周围松开套扎器;G:松开套扎器后确认SMT已完全结扎;H:6个月后胃镜发现结扎处肿瘤脱落,原发部位未见肿瘤残留
1.2.3 术后处理 所有患者术后均予禁食,每12 h静脉注射一次PPI,常规行补液等支持治疗。由禁食逐步过渡流质饮食、半流质饮食,最后恢复正常饮食。若术中发生穿孔,加用抗生素3 d。如术中出现大面积渗血或活动性出血,可通过活检钳紧急止血,术后立即加放置胃管灌洗。术后观察所有患者有无出血、穿孔、感染等并发症,根据患者实际情况采用相应措施干预。
1.3 统计学方法
2 结果
2.1 两组患者基线特征比较
本研究共纳入227例患者,男性83例(37.6%),女性144例(63.4%);年龄18~74岁,平均(51.9±9.7)岁。近70%的患者发现SMT前已出现腹部不适、腹胀、恶心呕吐等消化道症状。其中CER组100例,EBL组127例,两组的基线特征无显著性统计学差异,见表1。
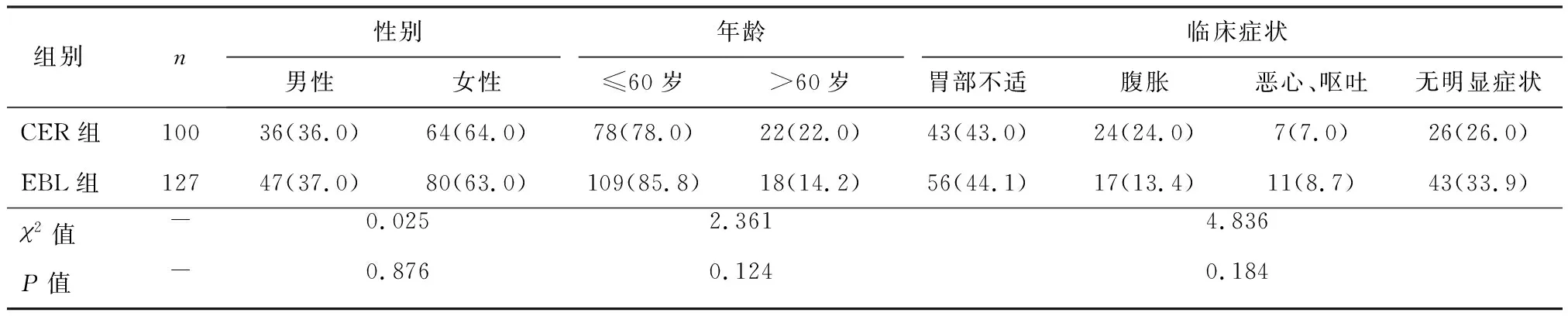
表1 两组的一般资料情况[n(%)]
2.2 内镜下病变特征
227例胃SMT患者行内镜下切除肿瘤前均行超声内镜检查,SMT病变平均大小为(7.53±1.95)mm;其中216例(95.1%)起源于固有肌层,9例(4.0%)起源于黏膜下层,只有2例(0.9%)起源于黏膜层。关于SMT位置,193例(85.0%)位于胃底,22例(9.7%)位于胃体,4例(1.8%)位于胃窦。
此外,在胃镜检查过程中发现超过95%的SMT病变表面正常,仅有3例(1.3%)存在肿瘤中心凹陷,未发现肿瘤中心溃疡现象。两组内镜下特征比较如表2所示。

表2 两组内镜下病变特征比较
2.3 两组手术指标比较
如表3所示,与EBL组比较,CER组手术时间更短(P<0.001),但术中出血量更多(P<0.001)。而两组在住院时间及住院费用比较无统计学差异(P均>0.05)。此外,CER组并发症总发生率(P=0.001)更高。如表4所示,CER组中观察到8例患者出现术中出血(最大失血量可达1 000 mL)及6例患者出现术后严重并发症(2例术后感染与4例术后出血),而EBL组未发现术中并发症,术后穿孔3例。所有并发症(14例)均及时发现并处理,患者均在症状缓解后顺利出院。在8例术中出血患者中,2例使用钛夹夹闭止血(图2,1例术中出血的CER组患者行钛夹止血过程),5例使用OTSC治疗,1例行动脉栓塞术止血。9例术后并发症患者中,4例(2例术后出血与2例术后感染)经内镜止血、输血、抗休克或抗感染治疗后好转,2例术后出血患者因浆膜层血管出血伴腹腔内积血行急诊手术,剩余3例术后穿孔患者予观察及保守治疗后症状缓解。
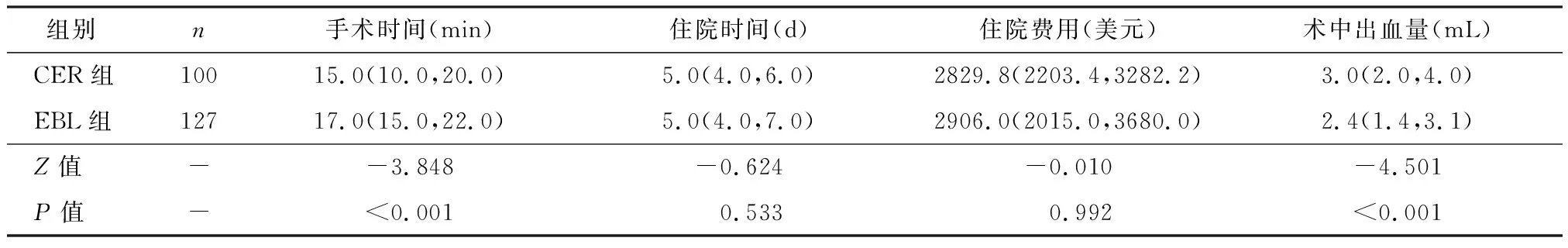
表3 两组术中出血量、手术时间、住院时间及费用比较[M(Q1,Q3)]

表4 两组并发症发生率比较[n(%)]

图2 1例患者行透明帽辅助内镜切除术(CER)出现动脉出血 A:位于胃底的较小黏膜下肿瘤经EUS提示肿瘤起源于固有肌层;B、C:术后发生动脉性出血和活动性出血;D:使用5个止血钳止血;E:切除后包裹良好的肿瘤直径约10 mm;F:病理结果示胃间质瘤。
2.4 两组组织病理结果比较
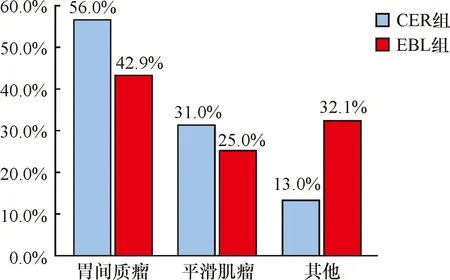
图3 两组标本术后病理分类直方图 其他包括神经内分泌肿瘤、异位胰腺、异位脾、神经鞘瘤、黏液下囊肿和炎性增生等
3 讨论
目前指南对于胃小SMT的切除适应症及治疗方式仍存在很大争议。2017年美国胃肠道内镜学会制定的上消化道黏膜下病变内镜诊疗指南[7]指出:肿瘤最大直径<2 cm且起源于固有肌层的SMT,不伴有临床并发症及短期增大趋势,建议定期监测随访。然而患者对于自身SMT定期监测的依从性较差,根据指南所推荐的定期接受EUS监测的患者不足50%[8]。2018年中国消化道SMT内镜诊治专家共识[1]建议:对于那些SMT术前检查或活检病理怀疑有恶性潜能、无法规律随访监测、短期内肿瘤增大或者内镜治疗意愿强烈的患者,可予选择内镜下切除。2020年中国CSCO首次发布的《胃肠间质瘤诊疗指南2020》与美国NCCN发布的《NCCN胃肠间质瘤诊疗实践指南》均推荐:对于那些病变<2 cm并且EUS表现出不良征象(包括边界不规则、溃疡、强回声及异质性)的胃肠间质瘤,应考虑切除[9]。
另一方面,近年来多种内镜下切除技术运用于胃SMT的治疗,但这些治疗方式各有优缺点。目前指南无推荐标准内镜治疗来处理直径≤10 mm的胃小SMT。Sun S等[10-11]人首次证实了EBL及EUS随访方案用来治疗小GIST是安全有效的策略。然而,EBL主要缺点在于无法获取标本进行组织病理学评估,阻碍了此种治疗方式的广泛运用。现ESD已被明确证实是治疗SMT的有效治疗方法[1-2,12]。本团队在前期临床工作中评估了ESD治疗胃小GISI的短期及长期预后情况,结果显示ESD能够有效切除胃小GISI[13-14]。同时,我们还研发一种名为内镜下黏膜保留侧向剥离术(endoscopic mucoma-sparing lateral dissection, EMSLD)的改良ESD手术,EMSLD对于胃小SMT切除更为安全,穿孔率低[15-16]。此外据文献报道ESD肿瘤总体治疗性切除率为66.7%,可能会导致肿瘤复发,且并发症发生率达7.7%[17]。EFTR具有较高完整切除率,是治疗胃SMT理想的微创治疗方式。但是ESD、EFTR治疗直径≤10 mm的SMT显得相对困难且操作复杂,有时还可能引起高危潜在风险,如穿孔或者出血等。
近年来我们采用CER治疗大量患者的过程中发现许多问题。本研究也显示CER会导致严重并发症。CER组中有12例(12%)患者出现术中或术后出血,2例(2%)患者出现严重感染,并发症总体发生率高于EBL组(14% vs 2.4%,P=0.001),潜在出血风险高,特别是发生在胃底的肿瘤。其主要原因可能是胃底有着丰富血管网,完整切除时容易发生出血。据报道,OTSC辅助EFTR(图4A’-E’)不同于传统切除术式,是安全有效的选择性黏膜下病变切除技术[18-19]。因此,采用OTSC闭合CER术后创面是预防并发症的有效方法。专用全层切除装(full-thickness resection device,FTRD)是由一个OTSC和一个预先安装在透明帽上的息肉切除圈套器组成[20]。据文献报道显示FTRD治疗上消化道SMTs的肿瘤治疗性切除率较高(77%,43/56),轻度或者中度不良反应发生率为21%(12/56),术后复发率为3%(1/34)[21]。EBL组中有3例患者发生迟发型穿孔。根据我们的临床经验,可能是圈套器安装不当导致大量组织套扎紧密,其缺血过程迅速发生,在瘢痕形成前肿瘤出现脱落。
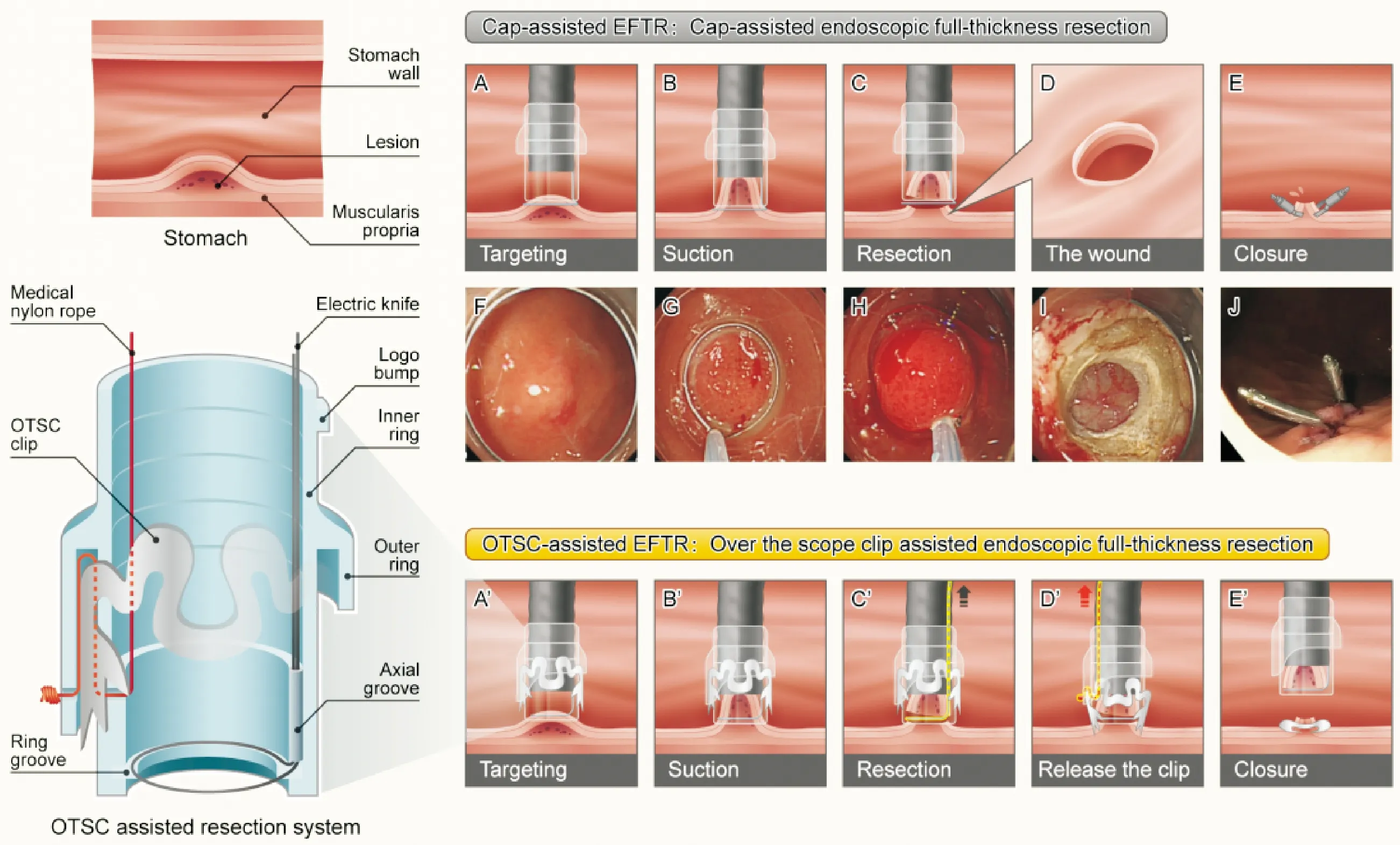
图4 透明帽辅助EFTR(A-J)和OTSC辅助EFTR(A′-E′)操作步骤 (A,F)透明帽安装于内镜尖端,高频电圈套器固定于透明帽环形凹槽中,定位SMT;(B,G)充分吸引;(C,H)将肿瘤吸入透明帽后收紧圈套器,切除肿瘤;(D,I)全层切除术后出现穿孔;(E,J)然后用钛夹闭合穿孔。(A′)透明帽安装于内镜尖端,高频电圈套器固定于透明帽环形凹槽中,定位SMT;(B′)充分吸引;(C′)肿瘤吸入透明帽后收紧息肉切除圈套器,切除肿瘤;(D′)松开OTSC;(E′)OTSC夹闭创面
本研究首次直接比较了两种不同治疗方法并对其提出了不同的看法。然而,本研究也存在局限性。首先,本研究为回顾性研究,存在选择偏倚是其一种固有缺陷。其次,本单中心研究样本量较小,可能限制了研究结果的普遍性。最后,本文未观察患者术后随访及复发情况,之后我们将根据患者随访情况观察比较肿瘤残留及复发情况。
综上所述,CER用于治疗直径≤10 mm的胃SMT的并发症发生率较高,并非一种安全的方法。结论需要进一步研究来验证。新型全层电切装备可能在未来提供更好的解决方案和选择。

