胰腺神经内分泌肿瘤转移风险的回顾性研究
孙焕焕,伍芳丽,师文,王云,赵倩,和水祥
胰腺神经内分泌肿瘤(pancreatic neuroendocrine neoplasms,pNENs)是一组起源于胰腺肽能神经元和神经内分泌细胞的具有显著异质性的肿瘤,占胃肠胰神经内分泌肿瘤的49.8%[1],在所有原发胰腺肿瘤中较为少见,常呈散发性,约占3%[2]。由于其细胞类型和分化程度各异,pNENs 患者临床症状常不典型且表现多种多样,体征不明显,容易被忽视及延误,往往发现是已出现局部扩散和/或远处转,然而当发生转移则提示严重的预后不佳。因此,早期发现病变并明确其性质对治疗和预后都具有重要的临床意义。本研究收集西安交通大学第一附属医院经病理确诊的pNENs患者,回顾性分析其流行病学、临床表现、影像学特点、病理特征及治疗方式等,以期提高临床医师对于pNENs的诊治意识,并对pNENs出现转移的风险进行初步评估和探索。
1 资料与方法
1.1 研究对象
纳入2013年11月至2019年11月在西安交通大学第一附属医院住院并诊断为pNENs的患者,纳入标准:①患者年龄18~80岁;②手术和/或超声内镜穿刺标本病理明确诊断为pNENs;③至少有一项影像学检查。排除标准:临床诊断pNENs但未行手术或穿刺,无明确病理诊断结果。此项研究为回顾性分析研究,我院医学伦理委员会批准免除患者知情同意书。
1.2 检查方法
所有患者均收集性别、年龄等流行病学史,临床症状,血清肿瘤标志物[CA199 (Carbohydrate antigen199)、CA125(Carbohydrate antigen125)、癌胚抗原(carcino-embryonic antigen CEA)、神经元特异性烯醇化酶(neuron specific enolase,NSE)],影像学资料[B超、CT、MRI及超声内镜(endoscopicultrasonography,EUS)],病理学特征(HE染色和免疫组织化学)及治疗方式。pNENs的诊断采用2019年新版WHO消化系统肿瘤分类标准[3],根据核分裂象数和(或)Ki-67指数两项指标进行分级:核分裂象数<2个/2 mm2、Ki-6指数<3%为G1级;核分裂象数2~20个/2 mm2、Ki-67指数3%~20%为G2级;核分裂象数>20个/2 mm2、Ki-67指数>20%为G3级。根据影像学及病理结果确定是否出现淋巴结及/或远处转移,按照是否存在转移分组,分析上述收集的临床数据,将相关因素进一步进行统计分析,获得对pNENs出现转移具有预测意义的指标及其临界值。
1.3 统计学分析
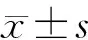
2 结果
2.1 pNENs一般资料
纳入2013年11月至2019年11月西安交通大学第一附属医院住院并经手术或/和超声内镜穿刺病理确诊的pNENs患者64例,其中男性28例(43.75%),女性36例(56.25%),年龄17~78岁,平均年龄(53.2±14.8)岁。病变发生部位,胰腺头部27例(42.19%),胰腺颈部5例(7.81%),胰腺体部14例(21.88%),胰腺尾部16例(25%),胰腺弥漫性病变2例(3.12%)。经典血清肿瘤标志物中,NSE阳性率为56.76%(21/37),CA199阳性率为4.35%(2/46),CA125阳性率4.76%(2/42),CEA阳性率为8.89%(4/45)。
2.2 pNENs临床表现
功能性pNENs(functional-pNENs,F-pNENs)43例(67.19%),无功能性pNENs(non-functional-pNENs,NF-pNENs)21例(32.81%)。F-pNENs包括胰岛素瘤37例(86.05%),主要表现为反复的低血糖、出汗、心悸、乏力、晕厥等;胃泌素瘤6例(13.95%),主要表现为腹痛、反酸、烧心、黑便,难治性腹泻等,内镜表现为反复难愈的消化性溃疡、反流性食管炎等。NF-pNENs中15例(71.43%)表现为腹部不适、腹痛、腹胀、消化不良等,6例(28.57%)为健康查体发现,无任何临床症状。
2.3 pNENs影像学表现
35例患者行彩色多普勒检查,其中18例术前诊断为pNENs,阳性率为51.43%,16例主要表现为实性低回声结节,2例表现为表现为不均匀混合声结节。
50例患者行CT增强扫描,其中46例术前诊断为pNENs,阳性率为92.00%,大多表现为类圆形病灶,动脉期明显不均匀强化,门脉期及延迟期强化程度减弱但仍高于正常胰腺组织。30例肿瘤边界清楚,16例肿瘤边界不清,与正常胰腺或邻近结构分界不清或表现为胰周脂肪层密度增高。13例肿瘤内部可见钙化,多为斑点状、团块状、新月形钙化。
29例患者行MRI增强扫描,其中24例术前诊断为pNENs,阳性率为82.76%。 T1WI中6例低信号,15例稍低信号,3例等信号;在 T2WI 中7 例高信号,13例稍高信号,4例信号不均匀,表现为高或等混杂信号;动态增强扫描中16例病灶整个动态扫描周围表现为均匀轻中度强化,5例病灶动脉期中度或明显均匀强化,门静脉和延迟期强化程度有所下降但仍高于周围正常胰腺实质信号,3例病灶中央明显囊变坏死,囊变坏死区无强化,周围呈持续性环状强化。
11例患者行EUS检查,其中8例(72.73%)术前诊断为pNENs,均表现为低回声影,见图1。4例患者行超声内镜下细针穿刺活检术(endoscopic ultrasonography guided fine-needle aspiration,EUS-FNA),其中3例(75%)患者病理结果为阳性。

图1 pNENs影像学与病理图片 A:CT示胰头部可见一类圆形病灶,动脉期明显强化(红箭头);B:CT示胰头部病灶延迟期强化程度减弱但仍高于正常胰腺组织(红箭头);C:超声胃镜下胰头部可见一低回声类圆形病灶,边界清楚,内部回声均匀,截面大小约1.0 cm×0.8 cm(黄箭头);D:HE染色示肿瘤细胞呈巢团状排列,核分裂像<2/10 HPF,提示G1(HE ×10)
2.4 pNENs治疗方案
64例患者中,33例患者接受腹腔镜下胰腺肿物切除术或部分胰腺切除术,1例接受腹腔镜下胰腺肿物切除术并经皮肝转移瘤射频消融术,21例患者接受开腹胰腺肿物切除术,2例接受开腹胰腺肿物并肝转移瘤切除术,1例接受开腹胰腺肿物并右肾切除术,6例因发现是已属于晚期,经穿刺确诊,未进行手术治疗,采取靶向治疗及化疗。
2.5 pNENs病理特征
所有患者均经病理诊断为pNENs,光镜下组织内可见圆形、卵圆形或柱状肿瘤细胞呈条索样、小梁状、腺腔样排列,胞质中等或丰富,部分呈细颗粒状改变。按照病理分级,G1级27例(42.19%)、G2级29例(45.31%)、G3 级8例(12.50%)。嗜铬粒素A(chromogranin A,CgA)、突触素(synaptophysin,Syn)、CD56、NSE和Insulin免疫组化阳性率分别为100%(47/47)、93.62%(44/47)、85.71%(30/35)、95.74%(45/47)及77.08%(37/48)。
2.6 pNENs转移组与无转移组临床特征比较
根据影像学及病理检查发现淋巴结或/和远处转移的患者共13例,主要转移至肝脏、肺脏、肾脏及骨;无转移病灶的患者51例。根据有无出现淋巴结或/和远处转移进行分组,两组在性别、年龄、肿瘤大小、病变部位、病理分级(G1、G2、G3)、免疫组织化学指标Insulin等变量进行分析,仅发现Insulin和病理分级具有统计学意义,其余均无统计学差异(表1)。根据结果提示,病变中免疫组化Insulin染色阳性,可能提示转移风险较小;病理分级越高,转移风险较大。

表1 pNENs远处转移的单因素分析
2.7 Ki67评估pNENs远处转移意义分析
Ki67不符合正态分布,使用秩和检验分析提示Ki67差异有统计学意义(P=0.041),可认为发生转移的患者Ki67数值比无转移组患者高。进一步分析Ki67对发生转移的预测效能,ROC曲线下面积为0.692(P=0.044),说明Ki67对pNENs发生转移的诊断有意义(图1)。曲线坐标约登指数最大值为0.331,即最佳临界值为2.5%,其敏感度0.846,特异性0.485。
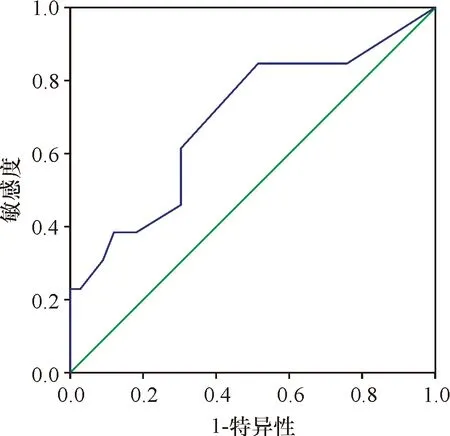
图2 Ki67诊断pNENs发生转移的ROC曲线
3 讨论
胃肠胰神经内分泌肿瘤(gastroenteropancreatic neuroendocrine neo-plasms,GEP-NENs)大多数出现在消化道与胰腺等,占所有NENs的65%~75%[4],罕见的可在胸腺和肺被发现。pNENs作为一种少见的肿瘤,该病年发病率逐年上升,2017年Fan[5]基于国内的多中心数据回顾性分析GEP-NEN最常见的主要部位是胰腺(31.5%)和直肠(29.6%),其中pNENs发病年龄主要集中在50~60岁,这跟本文统计pNENs发病平均年龄相似。
根据肿瘤能否分泌特异性激素,pNENs可分为F-pNENs和NF-pNENs两类[6]。NF-pNENs常无明显临床症状,起病隐匿,往往由体检偶然发现,容易被漏诊及延误治疗。F-pNENs由于其分泌激素早期即可出现相应临床症状,但由于其临床异质性较大,经常被误诊。F-pNENs主要有胰岛素瘤、胃泌素瘤、胰高血糖素瘤等,其中胰岛素瘤比较高发,本文统计的胰岛素瘤占F-pNENs 86.05%。胰岛素瘤因分泌胰岛素常表现出低血糖血症,低血糖产生的非特异性精神症状如视物模糊、抽搐、发作性意识丧失等易与脑血管病、癫痫等疾病相混淆[7],因此虽早期出现临床症状,但经常被误诊多年,研究报道,胰岛素瘤误诊率为26.67%~44.3%[8-9]。胃泌素瘤临床症状可表现为反复腹痛、反酸、烧心等,但这类患者常长期使用质子泵抑制剂(proton pump inhibi-tors,PPI),临床症状越来越不典型,也极容易被延误。
影像学检查是诊断 pNENs 的重要手段,其中以CT检查较为常见,在本研究中,CT对pNENs检出率为92%,MRI检出率为82.76%,腹部B超最低,检出率仅有51.43%。有文献报道,CT对pNENs筛查特异性为83%~100%[10],CT可明确显示出原发病灶形态及大小,同时又能提示转移病灶的部位及范围,但对于较小的转移灶CT仍具有局限性。而MRI对于病灶较小的pNENs(<1 cm)和肝转移灶有更好的敏感性和特异性[11]。因此,联合CT及MRI更利于病变的筛查。随着消化内镜技术的发展,特别是EUS技术及相关器械的不断发展,其在胰腺占位性病灶的诊断及鉴别中越来越显示出优势。一项对于456例患者的研究表明EUS对pNENs的检出率为94 59%[12],本研究结果显示EUS对于pNENs术前的检出率为72.73%,这可能由于我们研究中EUS数据较少,且内镜操作医生经验不足相关。EUS-FNA可以在术前明确胰腺占位良恶性质,特别是对于已经发生转移无根治手术机会的病灶,可以帮助临床医生为患者制定合适的治疗方案,但EUS-FNA阳性率不高仍是目前困扰临床医生的难题,有时候需要多次穿刺才能取到阳性结果,这与病灶较小、穿刺物质量不佳、内镜操作医生经验不足相关。
pNENs免疫组化检查必须包括CgA和Syn,其他可选的包括NSE、CD56、NSE及特定激素等[6]。CgA是一种由439个氨基酸组成的分子量为48kD的分泌蛋白,广泛存在于神经内分泌细胞的嗜铬性颗粒内[6],但免疫染色随肿瘤细胞分泌颗粒的密度变化而变化。文献报道,CgA作为诊断指标的敏感度为 66%,特异度为 95%,总准确率为 71%[13],本研究中CgA阳性率为100%。Syn是一种完整的膜钙蛋白结合糖蛋白,存在于细胞质中,绝大多数的NEN细胞可弥漫性表达[14],本研究中Syn阳性率高达93.62%。NSE是属烯醇化酶的同功酶,存在于神经和神经内分泌组织中,但也可表达在非神经内分泌细胞内甚至正常人体组织中[15],本研究中NSE的阳性率为95.74%。CD56是一种糖蛋白,存在于自然杀伤细胞、神经内分泌腺体等,因此两者均灵敏性较高但特异性较差,通常作为诊断pNENs辅助免疫组化指标[16]。Insulin作为胰岛素瘤的特定免疫组化指标,对于考虑F-pNENs且有临床症状的患者通常建议行Insulin染色进行鉴别。
目前,主流观念认为对于F-pNEN以及直径超过2 cm的NF-pNENs,根除性切除仍是首选的治疗方案[17],以期改善激素分泌引起的临床综合征或减少肿瘤负荷。然而至于偶然发现的直径≤2 cm的NF-pNENs,是否均需手术切除目前仍存在争议[6],临床需全面评估利弊。然而,2019年一篇针对1型gNENs荟萃分析研究提示,G1级患者中6.7%出现淋巴结转移,G2级患者中10%出现淋巴结转移,同时发现直径>10 mm的病变具有较高转移的风险[18]。对于pNENs是否存在同样的生物学特征,目前相关研究较少,而对于NF-pNENs(G1/G2),如果仅存在肝转移,无腹腔外转移及弥漫性腹膜转移,减瘤术可能有助于延长患者的生存期[19]。无法手术切除的局部晚期及转移性pNENs,本研究多选择放化疗、生物治疗、靶向治疗等综合性治疗。
由于鲜有5年生存分析的相关研究,目前尚无能明确预测出现转移的指标。有文献报道,影像学阴性者,51.4%淋巴结转移[20],而68Ga-PET检查对淋巴结远处转移的阳性预测值仅为51%[21],且目前只有少数国内大型医院可开展该检查。本研究发现Insulin阳性和Ki67对评估转移均具有一定帮助。尽管目前尚无免疫组化Insulin指标对判断转移风险的相关文献,但有研究发现,NF-pNENs较F-pNENs具有更强的侵袭性行为,预后较差[22],但仍需要大样本临床研究进一步证实。一篇荟萃分析通过回顾10年的相关文献,系统分析所有通过超声内镜穿刺或手术获得标本的Ki67与转移的关系,其中22篇文献支持Ki67是pNENs的可靠预后标志物,仅有3项研究认为两者无关[23]。有研究发现,淋巴结转移比值和Ki67是恶性pNENs治疗性切除后复发的预测因子[24]。然而也有研究提出,Ki67同时也会受到周边组织的影响,对于评估G分级具有误判的可能[25]。本研究对于Ki67的分析发现,其临界值处于2.5%,而根据目前的指南推荐Ki67<3%为G1分级,也就是说即使是G1级患者也有出现远处转移的风险。因此,目前的分级系统难以对是否出现远处转移做出判断,从而可能造成一部分发生远处转移的G1分级pNENs漏诊。
综上所述,pNENs临床症状多种多样,影像学是目前主要的诊断手段,免疫组化CgA、Syn是重要的确诊指标,根治性切除是局限期pNENs是首选治疗方法,Insulin阳性和Ki67对评估转移均具有一定帮助。然而由于可能缺少一部分无法切除的肿瘤作为评估的对象,是本研究的不足之处。因此,往后有待进一步扩大样本量明确pNENs转移的相关危险因素,急需建立更有效的评估体系,用于指导临床pNENs转移病灶的判定以及改善预后。

