3.0T MRI直肠癌DISTANCE评估的术前指导价值
赵良清,俸跃波,周强,蒋炜杰
据报道,近年来国内直肠癌患病率呈逐年增长态势,以中低位直肠癌为主,早期缺乏典型临床表现,多数患者就诊时已达中晚期,死亡率亦呈增长趋势[1-2]。目前直肠癌治疗方式主要以手术为主,而中低位直肠癌手术原则主要依据全直肠系膜切除术(total mesorectal excision,TME),其已被临床证实可降低直肠癌局部复发率[3-4]。但实施TME前需掌握TNM分期、环周切缘(circumferential resection margin,CRM)状态、壁外血管侵犯(extramural vascular invasion,EMVI)状态等信息,根据国内外直肠癌诊疗指南,对T3、T4期及淋巴结转移者建议先行新辅助放化疗后再实施手术治疗,CRM阳性、脉管侵犯者建议扩大手术范围,以改善患者预后[5-6]。可见,强化直肠癌术前分期评估对制定治疗方案意义重大。近年来磁共振成像(magnetic resonance imaging,MRI)已被认为是评估直肠癌术前分期的首选检查方法,而以MRI检查为基础,术前“DISTANCE”评估体系应运而生,主要内容有肿瘤下缘距肛周皮肤距离(distance from the inferior part of the tumor to the transitional skin,DIS)、T分期、N分期、肛门复合体、CRM及EMVI评估,已成为了直肠癌MRI评估报告形式之一,可系统呈现肿瘤全貌,全面概括直肠癌侵犯情况,为临床治疗方案的制定提供依据,但目前鲜有报道分析3.0T MRI诊断直肠癌T分期、N分期及CRM状态、EMVI状态与病理结果的一致性[7-8]。本研究通过回顾性分析我院95例直肠癌患者术前3.0T MRI信息与术后病理切片资料,以术后病理结果为金标准,分析3.0T MRI“DISTANCE”评估内容与病理结果的一致性,旨在为临床提供参考。
1 资料与方法
1.1 一般资料
选取2019年8月至2020年10月我院手术病理证实的直肠癌患者95例,其中,男70例,女25例;年龄18~80岁,平均年龄(63.20±10.30)岁;经腹直肠癌切除术70例,经腹会阴联合直肠癌根治术23例,直肠癌切除+近端造口+远端封闭手术2例。纳入标准:①患者手术病理证实为中低位直肠癌;②术前未接受新辅助放化疗,或已接受新辅助放化疗但术前最后1次放化疗后行3.0T MRI检查,无相关禁忌症;③术前3.0T MRI检查采用“DISTANCE”评估报告进行;④检查后14 d内接受直肠癌根治性切除术,直肠病理标本完整。排除标准:①既往伴其他恶性肿瘤病史、精神病史;②合并心、肝、肺及造血系统等严重原发性疾病;③因肿瘤并发急性肠梗阻、急性肠穿孔等情况而行急诊手术者;④合并柯兴综合征、胰岛素瘤、甲状腺功能亢进症等其他内分泌或代谢性疾病;⑤合并自身免疫性疾病、炎症性肠病等免疫性或炎症性疾病。本研究经医院伦理委员会批准通过。
1.2 方法
1.2.1 MRI检查
1.2.1.1 检查方法 做好检查前准备工作(检查前24 h保持流质饮食,检查前2 h清洁灌肠,向患者介绍注意事项,嘱其检查过程中保持平稳呼吸并减少肢体活动),采用MR Ingenia 3.0T超导磁共振扫描仪(荷兰飞利浦公司,8通道表面线圈,梯度超强、场切率分别为40 mT/m、150 T/m/s),MRI检查时间30~40 min。①全盆腔矢状位T2加权图像(T2 weighted images,T2WI):应用快速恢复快速自旋回波(fast recovery fast spin echo,FRFSE)-T2WI序列,重复时间(repeated time,TR)3 512 ms,回波时间(echo time,TE)80 ms,矩阵320×260,视野(field of view,FOV)250 mm×250 mm,层厚5 mm,层间距1 mm,回波链长度(echo train length,ETL)13,激励次数(number of excitations,NEX)1.2;②盆腔横断位T2WI扫描:方向与肠管或肿瘤长轴垂直,采用FRFSE-T2WI序列,TR 3389 ms,TE 80 ms,矩阵 272×291,FOV 300 mm×360 mm,层厚5 mm,层间距1 mm,NEX 1.5;③全盆腔横断面T1加权图像(T1 weighted images,T1WI)扫描:采用快速自旋回波(fast spin echo,FSE)序列-T1WI序列,TR 549 ms,TE 8.0 ms,矩阵330×322,FOV 300 mm×360 mm,层厚5 mm,层间距1 mm,NEX 1;④盆腔轴位扩散加权成像(diffusion weighted imaging,DWI)扫描:应用平面回波成像(echo planar imaging,EPI)序列,TR 2 370 ms,TE 74 ms,FOV 280 mm×280 mm,层厚4 mm,层间距0.4 mm,ETL 128,NEX 4,扩散敏感系数b值分别为1000 s/mm2;⑤直肠轴位高分辨T2WI扫描:应用FRFSE-T2WI序列,TR 4 504 ms,TE 100 ms,矩阵348×348,FOV 260 mm×260 mm,层厚4 mm,层间距0.4 mm,ETL 13,NEX 1,分辨率0.87 mm×0.78 mm,评估肿瘤T分期、N分期及CRM状态;⑥中下段直肠冠状位扫描:TR 4 712 ms,TE 89 ms,矩阵312×312,FOV 250 mm×250 mm,层厚3 mm,层间距0.4 mm,ETL 13,NEX 1。
1.2.1.2 MRI图像分析 MRI影像学资料由同一名影像科医师阅片,将T分期、N分期、CRM状态、EMVI状态、DIS等记入“DISTANCE”评估报告中,各项内容判断标准[9-10]如下。①DIS:于高分辨矢状面T2WI图像内借助核磁工作站中测量工具,起点选择肿瘤强化最下缘,终点选择肛缘,按照直肠曲度分段测量,计算并记录总长度,即为DIS;②T分期:肿瘤浸润黏膜或黏膜下层且有均匀完整的肌层信号视为T1期,肿瘤侵达固有肌层但未突破且有连续完整但不均的肌层信号视为T2期,肿瘤突破固有肌层及浆膜但未达环周切缘、肌层与周围脂肪交界面基本消失视为T3期,肿瘤侵入周围组织结构或其他器官且出现直肠系膜筋膜连续性中断情况并穿透直肠系膜筋膜和腹膜反折视为T4期。考虑MRI难以分辨T1期与T2期,又因局限于固有肌层的肿瘤治疗方式相似,故将两者合并为T1-2期;③N分期:无区域淋巴结转移视为N0期,出现1~3个区域淋巴结转移视为N1期,出现4枚以上区域淋巴结转移视为N2期;④CRM状态:肿瘤组织距邻近直肠系膜筋膜的最短距离<1 mm视为CRM阳性,反之视为CRM阴性;⑤EMVI状态:0分:肿瘤为非结节状,浸润至肌层,周围无肠壁外血管;1分:肿瘤结节状,肠壁外血管、肌层可见浸润,不处于肿瘤周边;2分:肿瘤周围有大小正常肠壁外血管,且未见肿瘤信号;3分:肿瘤周围血管内有中等信号,血管轮廓、直径稍有变化;4分:有明显信号,血管呈结节性扩张,轮廓不规则。其中0~2分为阴性,3~4分为阳性。
1.2.2 病理判定标准 直肠癌病理T、N分期根据第七版美国癌症联合委员会(American Joint Committee on Cancer,AJCC)标准[11]判断。肿瘤组织到直肠系膜筋膜的距离<1 mm视为CRM阳性,反之视为CRM阴性;镜下提示直肠固有肌层之外血管内有肿瘤细胞视为EMVI阳性,反之视为EMVI阴性[8]。所有带有肛门皮肤的新鲜标本均于离体30 min内直接测量并记录DIS。
1.3 统计学方法

2 结果
2.1 DIS测量结果分析
所有患者均顺利完成MRI与病理诊断。术前MRI测量DIS为(3.82±1.20)cm,术后病理结果显示DIS为(3.86±1.24)cm,差异无统计学意义(t=0.230,P=0.822)。
2.2 MRI T分期结果与病理T分期结果的一致性分析
MRI诊断直肠癌T1-2期、T3期、T4期的准确率分别为87.37%、85.26%、93.68%,与病理诊断一致性检验的Kappa值为0.659(P<0.01),见表1。
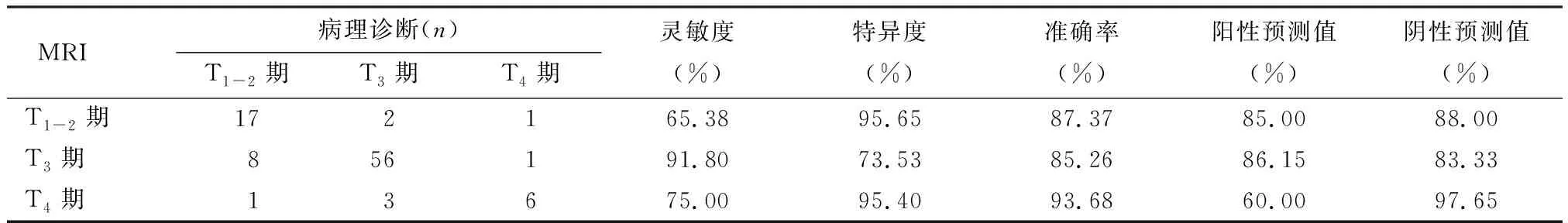
表1 MRI T分期结果与病理T分期结果的一致性分析
2.3 MRI N分期结果与病理N分期结果的一致性分析
MRI诊断直肠癌N0期、N1期、N2期的准确率分别为76.84%、74.74%、76.84%,与病理诊断一致性检验的Kappa值为0.457(P<0.01),见表2。
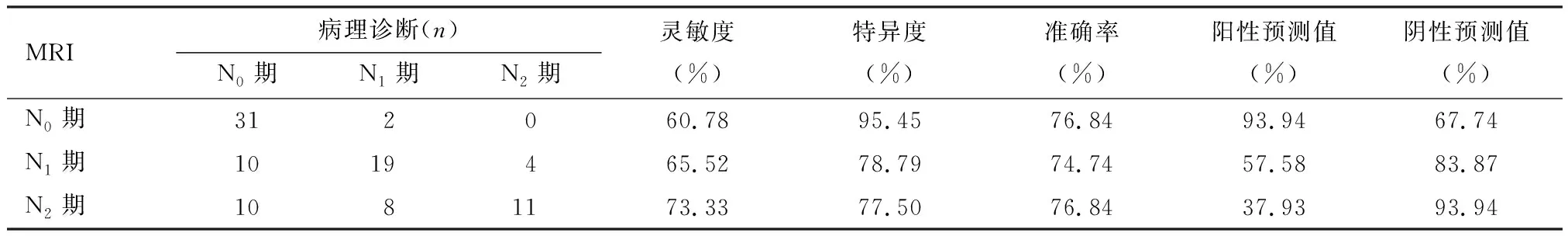
表2 MRI N分期结果与病理结果的一致性分析
2.4 MRI评估CRM状态、EMVI状态与病理结果的一致性分析
MRI评估直肠癌CRM状态准确率为89.47%,与病理结果比较,一致性检验的Kappa值为0.672(P<0.01),见表3。对病理诊断的69例≥T3期直肠癌患者进行EMVI评估,发现MRI评估直肠癌EMVI状态的准确率为75.79%,与病理结果比较,一致性检验的Kappa值为0.368(P<0.01),见表3及图1~2。
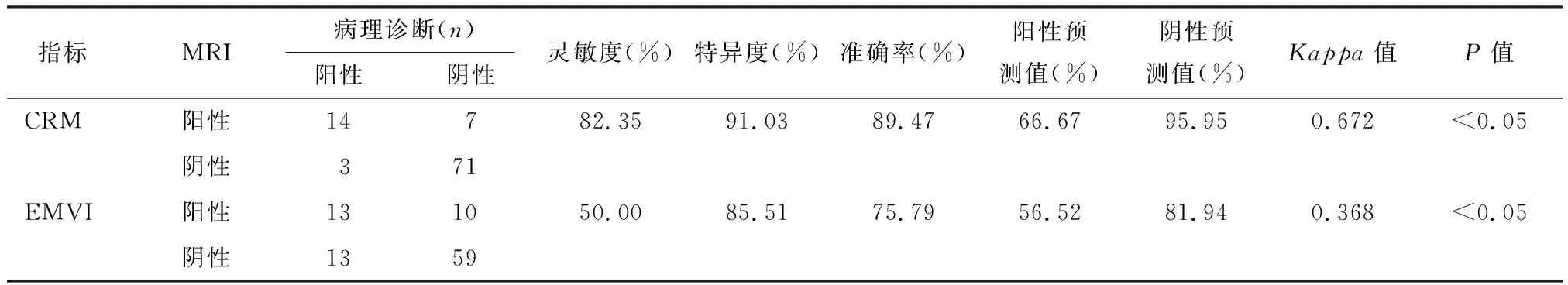
表3 MRI评估CRM状态、EMVI状态与病理结果的一致性分析
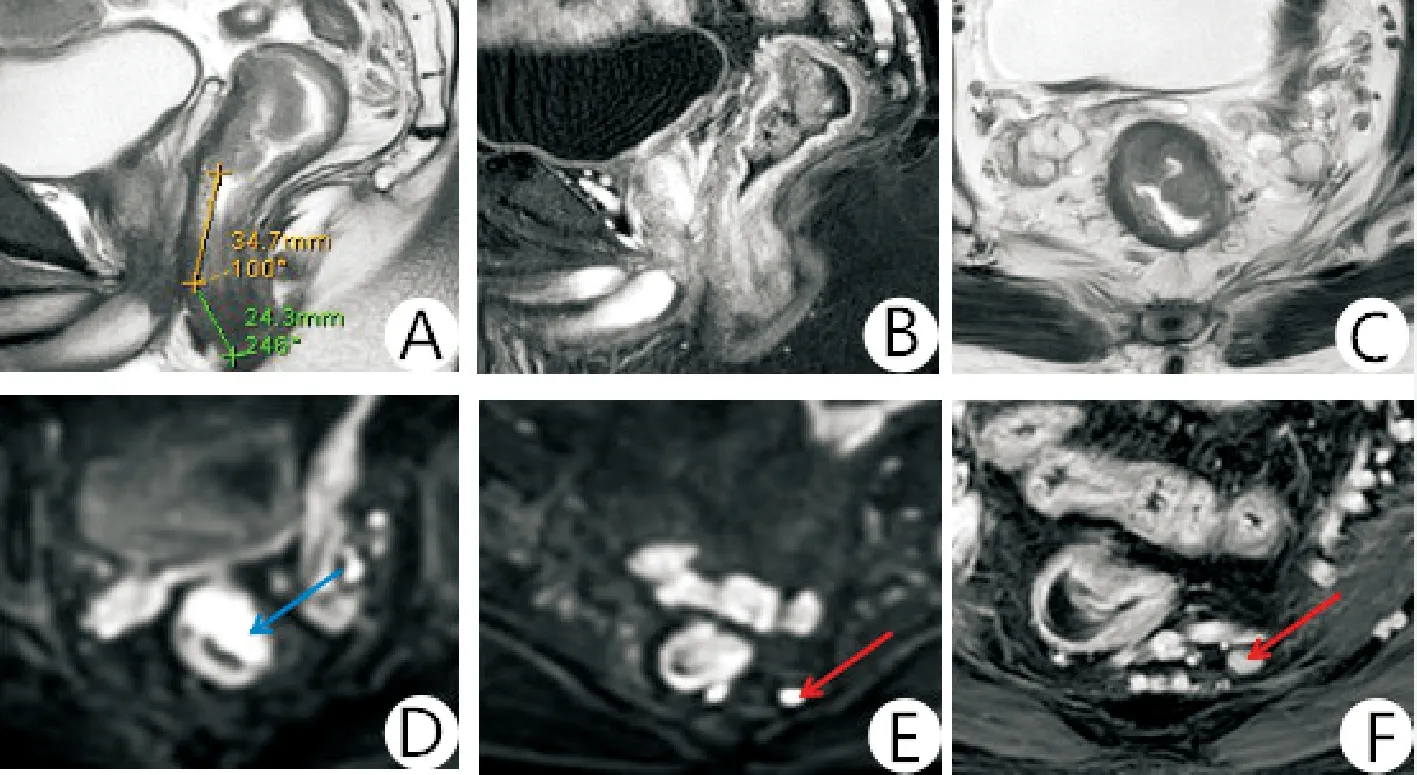
图1 直肠癌MRI影像特征(患者男,57岁,排便习惯改变伴便血2+月,术后病理显示为腺癌) A:T2WI矢状位图像示直肠中下段偏心性病变DIS为5.8 cm;B:增强矢状位T1WI显示病变向肠腔内突出,不均匀强化;C:T2WI横轴位示病变侵犯肌层,T2期;CRM阴性;D:DWI示病变弥散受限;E:DWI示直肠周围间隙2枚肿大淋巴结,N1期;F:T1WI横轴位增强示淋巴结强化剂周围增多血管影,血管强化均匀,EMVI阴性
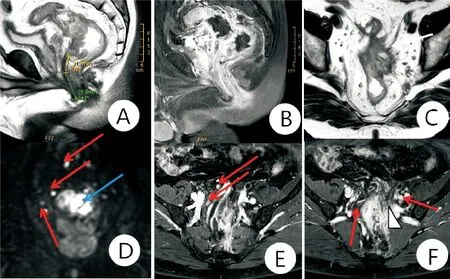
图2 直肠癌MRI影像特征(患者男,67岁,排便习惯改变2+月,便血11 d,术后病理显示为腺癌) A:T2WI矢状位图像示直肠中下段偏心性病变DIS为5.6 cm;B:增强矢状位T1WI显示病变向肠腔内外突出,不均匀强化;C:T2WI横轴位示病变侵犯腹膜反折、腹膜反折不均匀增厚(白箭头),T4a期;CRM阳性;D:DWI示病变弥散受限(蓝箭头)及周围多发增大淋巴结(红箭头);E、F:T1WI横轴位增强示直肠周围及系膜多发肿大强化淋巴结(红箭头),N2期;周围血管影增多、增粗及紊乱,局部强化不均匀,EMVI阳性(白三角符号)
3 讨论
目前直肠癌治疗方式主要以外科手术为主,并根据肿瘤分期情况辅助化学及放射治疗,由于不同分期的直肠癌治疗方法及效果存在明显区别,故术前全面了解直肠癌分期情况对治疗方案的制定意义重大。目前MRI已成为评估直肠癌术前分期的重要检查手段,而直肠癌MRI评估报告,即“DISTANCE”,可通过DIS、T分期、N分期及CRM状态、EMVI状态方面对直肠癌进行术前全面评估,可为临床治疗方案的选择和制定提供参考。
大量报道表明,MRI软组织辨识度较好,可清晰反映直肠壁及临近器官结构特征,较好地呈现癌肿浸润肠壁的深度,并显示癌肿对周围脂肪间隙和器官的侵袭状况,为T分期评估提供较为严谨的影像学证据[12-15]。而分析固有肌层受累状况是区分T1期与T2期的关键,但实际操作中由于受直肠蠕动所致虚影、MRI分辨率受限等因素影响,导致MRI难以辨别肌层受累状况并区别黏膜下层与肌层,致使区分T1期与T2期的准确率较低,而考虑二者肿瘤手术方案类似,故本研究将二者合并进行分析。而T3期肿瘤是直肠癌辅助治疗的重要依据,故准确区别T2期与T3期是T分期的关键。刘建军等[16]报道3.0T MRI对直肠癌术前T分期诊断总准确率为86.76%,与病理结果的一致性较好。而本研究结果显示,MRI诊断直肠癌T1-2期、T3期、T4期的准确率分别为87.37%、85.26%、93.68%,提示3.0T MRI诊断直肠癌术前T分期的准确性较好,与上述报道相似。但唐娜等[17]报道3.0T MRI诊断直肠癌T1-2期、T3期、T4期的准确率分别为90.5%、89.5%、98.9%,与本研究结论存在偏差,可能与肿瘤浸润浆膜与炎性反应增生的索条样毛刺样变化可在MRI图像上呈现出类似征象有关。
淋巴结转移属直肠癌最为主要的转移方式,也是其复发与转移的独立影响因素,而MRI检查软组织分辨能力较好,可较好地反映局部淋巴结转移状况[18]。以往报道认为,考虑肿瘤细胞转移的淋巴结外层包膜可遭受浸润,在高分辨MRI T2WI中可表现为淋巴结边缘不光滑,而转移淋巴结内部结构紊乱也会引起T2WI信号不均匀,故在高分辨MRI T2WI中可以淋巴结边缘及信号特征作为评判淋巴结良恶性的标准;而DWI信号强弱改变可较好反映细胞代谢、细胞膜完整性等情况,为诊断淋巴结转移提供参考[19]。本研究利用高分辨率MRI-T1WI、T2WI下显示的淋巴结边缘、大小、内部信号联合DWI征象来评估有无淋巴结转移,发现MRI诊断直肠癌N0期、N1期、N2期的准确率分别为76.84%、74.74%、76.84%,与郏立志等[20]研究结果(MRI常规成像序列结合DWI成像序列诊断直肠癌N0期、N1期、N2a期、N2b期的准确率分别为84.71%、83.53%、92.94%、94.12%)存在一定偏倚,推测可能与肠道蠕动和血管波动所致伪影、混淆MRI下炎症反应增生的淋巴结和癌转移的淋巴结、良性淋巴结与发生转移的淋巴结ADC值存在一定重叠、MRI对微小淋巴结(尤其是最大径低于2 mm的淋巴结)的检出率偏低等有关。
CRM是引起术后复发的独立危险因素,也是目前判断TME手术效果的重要依据,故强化直肠癌术前CRM状态评估尤为重要[21]。目前MRI因可清晰呈现软组织结构(如盆腔内直肠系膜筋膜等)而被广泛用于评估直肠癌术前CRM状态,但其评估CRM阳性的标准值尚无定论,如任圣会等[22]报道将直肠肿瘤与直肠系膜筋膜之间的最短距离≤2 mm视为CRM阳性,发现MRI评估直肠癌CRM阳性的特异度为92.02%,与病理学检查CRM阳性符合率为90.67%,提示MRI评估直肠癌CRM阳性与病理学检查结果的一致性较高;Ye等[23]报道将肿瘤组织到直肠系膜筋膜的距离<1 mm视为CRM阳性,发现MRI评估CRM状态的准确率为86.4%,与病理结果存在高度一致性。本研究中,将肿瘤组织距邻近直肠系膜筋膜的最短距离<1 mm视为CRM阳性,发现MRI评估直肠癌CRM状态的准确率为89.47%,与病理结果比较,一致性检验的Kappa值为0.672,提示MRI评估直肠癌CRM状态与病理结果的一致性较好,与上述研究结果接近。
EMVI是预测直肠癌局部复发及远处复发的可靠指标,也是判断直肠癌手术预后的重要指标,而3.0T MRI已被临床证实可清晰显示直肠癌周围受侵犯血管形态学改变[24]。本研究显示,MRI评估直肠癌EMVI状态的准确率为75.79%,而与病理诊断一致性检验的Kappa值仅为0.368,推测可能与MRI难以识别直径低于2 mm的微小血管的肿瘤侵犯情况等有关。术前准确测量DIS是评估保肛手术可行性及制定何种术式的重要依据,而3.0T MRI可清晰显示肿瘤边缘、肛门括约肌、肛提肌等解剖结构,获取直肠图像矢状面并借助核磁工作站顺着生理曲度行直肠分段测量,从而精确测量DIS。有报道表明,MRI测量DIS结果和病理标本测量结果类似,与本研究结论相似,提示3.0T MRI在DIS预测中意义重大[25]。
综上所述,自MRI的“DISTANCE”评估报告着手,发现3.0T MRI在直肠癌术前影像学分期评估中意义重大。但考虑在本研究采集的病理资料中肿瘤与肛门括约肌-肛提肌的关系并未完善,故并未进行“DISTANCE体系”中的肛门复合体评估,再加上纳入样本量偏少,故今后仍需深入研究。

