重症急性胰腺炎继发脓毒症与肠道细菌易位及炎症特征观察
辛天宇,刘树元,赵金宝
急性胰腺炎(acute pancreatitis, AP)是指多种病因导致胰腺组织内胰酶激活引起的水肿、出血甚至坏死的炎症反应,即急腹症。重症AP(SAP)起病急,病死率高。胰腺坏死、感染继发脓毒症,进一步发展为脓毒症性休克和多器官衰竭综合症(MODS),严重危害患者生命[8-9]。其发病机制尚不明确,可能与肠道菌群易位、炎症、免疫抑制等有关[5]。本研究对SAP继发脓毒症患者及同期胰腺炎未继发脓毒症患者进行对照研究,探讨SAP继发脓毒症患者与肠道细菌易位的关系。先报告如下:
1 资料与方法
1.1 一般资料
2017年1月至2019年10月,中国人民解放军总医院第六医学中心住院治疗的重症急性胰腺炎继发脓毒症患者70例为研究组,其中男36例,女34例,年龄(42.56±5.66)岁,发病至住院时间为(14.45±2.22)h,APACHEⅡ评分为(15.86±2.31)分;选取同期胰腺炎未继发脓毒症患者70例作为对照组,其中男35例,女35例,平均年龄(43.16±5.96)岁,发病至住院时间为(15.15±2.54)h,APACHEⅡ评分为(15.64±2.26)分。两组基础资料比较差异无统计学意义(P>0.05)。本研究获得中国人民解放军总医院第六医学中心伦理委员会批准。
1.2 纳入标准
①患者符合《重症急性胰腺炎诊治指南》中重症急性胰腺炎的诊断标准[6];②年龄18~65岁;③研究组患者符合脓毒症相关诊断标准[7]。
1.3 排除标准
①严重心、肝、肾功能障碍患者;②恶性肿瘤患者;③免疫功能紊乱患者;④近期有外科手术史患者;⑤妊娠期、哺乳期妇女。
1.4 方法
1.4.1 细菌培养 两组患者治疗前均在B超指引下采用7号套管针穿刺法获取感染等胰腺/周围渗液,完成感染标本提取。将样本接种于无菌培养瓶中,并立即送检。于血平板培养基上划线接种。于37 ℃下恒温培养24~72 h后,并采用VTEK2 Conmpact(法国生产)细菌鉴定系统进行细菌鉴定。
1.4.2 炎性指标检测 两组患者均入院后空腹抽取外肘静脉血3 mL,3 000 r/min离心5 min,后送检,检测CRP、PCT水平,分别使用TBA-40FR(日本生产)、罗氏公司Cobas全自动生化分析仪;IL-2、IL-1β选用深圳晶美生物公司提供试剂盒,采用ELISA法检测;IL-6使用Fm-200/10型(西安凯普机电公司生产)计数器,采用放射免疫法进行检测。
1.5 统计学方法

2 结果
2.1 细菌培养结果分析
研究组共分离出细菌122株,其中革兰阴性菌101株(82.78%),革兰阳性菌21株(17.22%);对照组共分离出细菌105株,其中革兰阴性菌85株(80.95%),革兰阳性菌20株(19.05%),两组革兰阴性菌主要包括大肠埃希菌、铜绿假单胞杆菌、产气杆菌、肺炎克雷伯菌。两组革兰阳性菌主要包括金黄色葡萄球菌、表面葡萄球菌、肠球菌,见表1。
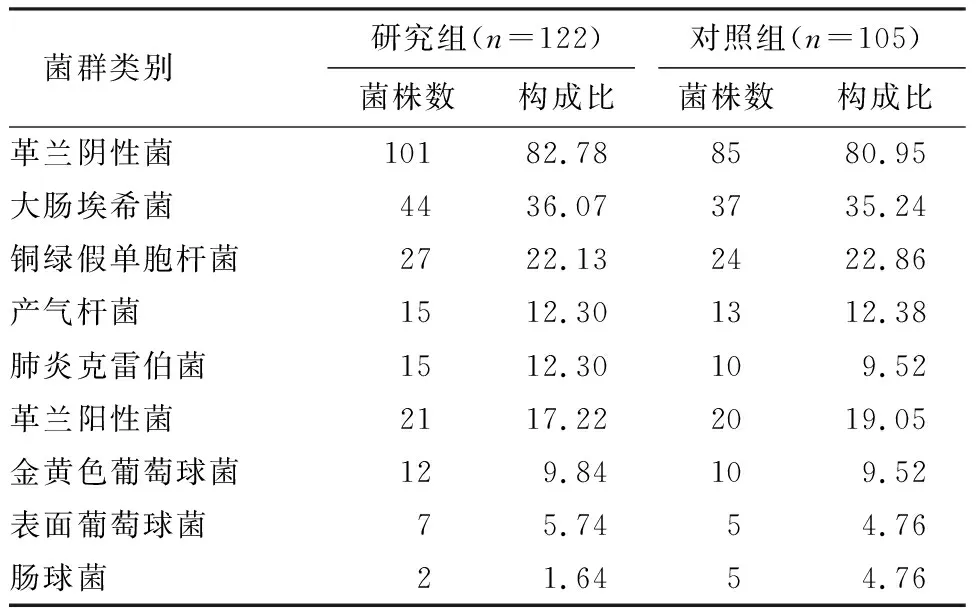
表1 两组细菌培养结果分析 (n)
2.2 两组患者血清PCT、CRP、IL-2、IL-6、IL-1β水平比较
研究组血清PCT、CRP、IL-2、IL-6、IL-1β水平均显著高于对照组,差异均具有统计学意义(P<0.01),见表2。
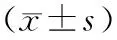
表2 两组患者血清PCT、CRP、IL-2、IL-6、IL-1β水平比较
3 讨论
SAP起病急,病死率高,临床病理变化复杂,早期的全身炎性反应到一步发展为脓毒症性休克和多器官衰竭综合症(MODS),是SAP死亡的主要原因[8-9]。而肠道细菌易位是导致胰腺重复感染、坏死、继发脓毒症的原因之一。本研究对两组患者PCT、CRP、IL-2、IL-6、IL-1β指标进行分析,探讨肠道细菌易位在重症急性胰腺炎继发脓毒症的发生发展中发挥着重要的作用10-11]。
本研究中, 研究组共分离出细菌122株,其中革兰阴性菌101株(82.78%),革兰阳性菌21株(17.22%);对照组共分离出细菌105株,其中革兰阴性菌85株(80.95%),革兰阳性菌20株(19.05%),提示患者细菌大部分来源于肠道,且革兰阴性菌为主,说明SAP患者在激发脓毒症前已存在肠源性细菌感染,感染持续发展则导致脓毒症。本研究两组患者胰腺周围渗液细菌培养均查处肠源性细菌,表明两组患者可能存在肠屏障功能障碍,而肠道细菌易位发生时肠内细菌越过肠屏障进入肠外,因此,肠源性细菌与肠道易位可能存在一定关系[12]。在有关临床研究及动物实验研究中已证实,导致肠源性感染的主要原因之一是在SAP状态下,大肠杆菌为主的致病菌数量急剧增加,而有益菌如乳杆菌、双歧杆菌则受到抑制,数量明显减少[13-14]。
革兰阴性菌作为主要细菌及细菌毒性产物进入血循环系统,循环血供受损,肠道因血供问题缺氧,导致肠壁紧密连接,肠道绒毛上细胞结构受损,导致肠道细菌群紊乱。细菌及细菌毒性产物进入血循环系统,其通过结合相关受体蛋白激活炎性细胞因子转录和蛋白表达[15],本研究提示SAP患者体内PCT、CRP、IL-2、IL-6、IL-1β水平显著高于重症胰腺炎未激发脓毒症患者,PCT、CRP、IL-2、IL-6、IL-1β是炎性反应的关键指标,它们之前的协同作用导致机体炎症损伤[5,16-17]。炎症因子高度表达会加重患者肠黏膜损伤,促进肠道细菌易位形成,加重体内炎症反应,胰腺周围组织受到损伤引发脓毒症[18-19]。
综上所述,肠源性细菌易位,炎症因子的过度释放等因素所导致的肠屏障功能受损,继发脓毒症[20]。

