结直肠癌患者外周血CTC改变与预后的关系*
郭志娟, 吉茹, 王振飞, 孟丹阳, 王金花
(内蒙古医科大学附属人民医院 病理科, 内蒙古 呼和浩特市 010010)
随着手术、放疗、化疗及靶向治疗的应用,结直肠癌(colorectal cancer,CRC)患者的5年、10年生存率达到了65%和58%,但仍然导致肿瘤死亡的第三大癌症[1-2]。复发、转移依然是CRC患者死亡的首要原因,因此CRC治疗的关键是找到能早期发现疾病及监测疾病病情进展的方法。循环肿瘤细胞(circulating tumor cells,CTC)是在肿瘤形成和进展过程中从原发灶或转移灶脱落进入血液循环的肿瘤细胞,能够真实反映肿瘤的情况,对研究肿瘤转移机制、判断临床治疗效果、监测肿瘤复发有重要作用[3]。有研究证实,肿瘤细胞在肿瘤形成早期甚至在原发病灶形成之前就播散到循环系统中,并先于原发肿瘤进化成转移病灶,而且这种肿瘤细胞的播散及进化可能贯穿于肿瘤进展的整个过程[3]。本研究以86例接受手术治疗的CRC患者为研究对象,采用CyttelTM扩增型CTC阴性富集技术分别于术前1天、术后第7及30天时进行CTC检查,使用χ2检验和Spearman相关性分析CTC与其他肿瘤标志物的相关性,采用KaPlan-Meier曲线及Cox比例风险模型分析患者的总体生存情况,探讨外周血CTC在CRC患者中的变化及其对预后的影响。
1 对象与方法
1.1 研究对象
本研究纳入2018年1月—2019年12月在腹部外科接受手术的CRC患者86例,其中男45例、女41例,年龄(54.45±12.69)岁。纳入标准: (1)符合2007年世界卫生组织关于CRC诊断标准[4];(2)所有原发病灶均为CRC;(3)均行肿瘤根治切除术治疗、且术后经病理学检查确诊。排除标准: (1)存在肝肾功能异常以及心、脑和血液系统等疾病患者;(2)存在其他系统恶性肿瘤患者;(3)临床资料不完整者。本研究经医院伦理委员会批准同意(KY201903),患者或家属均知情同意并签署知情同意书。
1.2 方法
1.2.1标本采集 于术前1 d及术后第7及30天时,采集受检患者外周血5.0 mL,采用柠檬酸葡萄糖(ACD)抗凝,室温保存,24 h内送检。
1.2.2细胞富集 取上述全血加入50 mL离心管,补充缓冲液至45 mL,离心、弃上清液,轻摇混匀沉淀细胞;再加CS2至45 mL,混匀后离心、弃上清液。吸取适量磁微粒混悬液至2 mL EP管,置于磁力架上,待溶液澄清后、吸弃溶液,反复洗涤3次,用CS1重悬磁微粒补至原体积。取已经预装3 mL CS3的50 mL离心管,将上述液体轻轻叠加至CS3表层,配平后离心。吸取中间层全部液体,转移至15 mL离心管,补充CS1,离心、弃上清,反复2次。加入CF1固定液100 μL,轻柔吹打混匀,涂片。
1.2.3荧光原位杂交技术(fluorescence in situ hybridization,FISH)操作 涂片完全干燥后,取CF2室温固定8~10 min,小心洗去CF2后放置于已预热的染色缸中静置10 min。依次在染色缸Ⅲ、Ⅳ、Ⅴ中静置2~5 min,室温晾干。之后避光条件下操作,加入探针10 μL、盖片、封片。杂交仪76 ℃变性5 min、37 ℃杂交1.5 h。洗片、洗涤后将抗体加至标本区,湿盒内室温下避光、孵育1~1.5 h。洗片后DAPI复染、盖片。
1.2.4CTC诊断 荧光显微镜下由2位经过专业培训检验人员进行CTC鉴定及计数、并拍照。CTC定义为表面磁珠不超过2个,CEP8/7探针≥3个信号,核染阳性(DAPI+),白细胞共同抗原阴性(CD45-)的细胞; CTC数目≥2,提示患者体内存在恶性肿瘤细胞,体内怀疑存在恶性肿瘤病灶,存在潜在转移风险或已发生远处转移,视为CTC阳性;CTC数目<2提示本次未检测到CTC或者CTC水平趋于正常,病灶性质为良性倾向,视为CTC阴性。
1.2.5病理诊断 手术标本由有经验的医师取材,脱水、制片后,由2位副主任医师及以上诊断医师出具诊断报告,按美国癌症联合会(AJCC)和国际抗癌联盟(UICC)第8版TNM系统进行分期。
1.3 观察指标
使用χ2检验和Spearman法分析CTC检出率与患者一般临床特征、肿瘤分化程度、肿瘤病理组织学类型及肿瘤标志物的关系,比较患者3个时间点的外周血CTC计数,比较CTC阳性和CTC阴性患者预后及生存情况。
1.4 统计学分析

2 结果
2.1 CRC患者一般临床特征及基线CTC计数
86例CRC患者中CTC阳性例数为55例,检出率为63.95%,共检出745个CTC。如表1结果所示,CTC检出率与患者TNM分期和分化程度有关(P<0.05),与性别、年龄、肿瘤部位、肿瘤直径以及淋巴结转移等临床特征无关(P>0.05)。见表1。
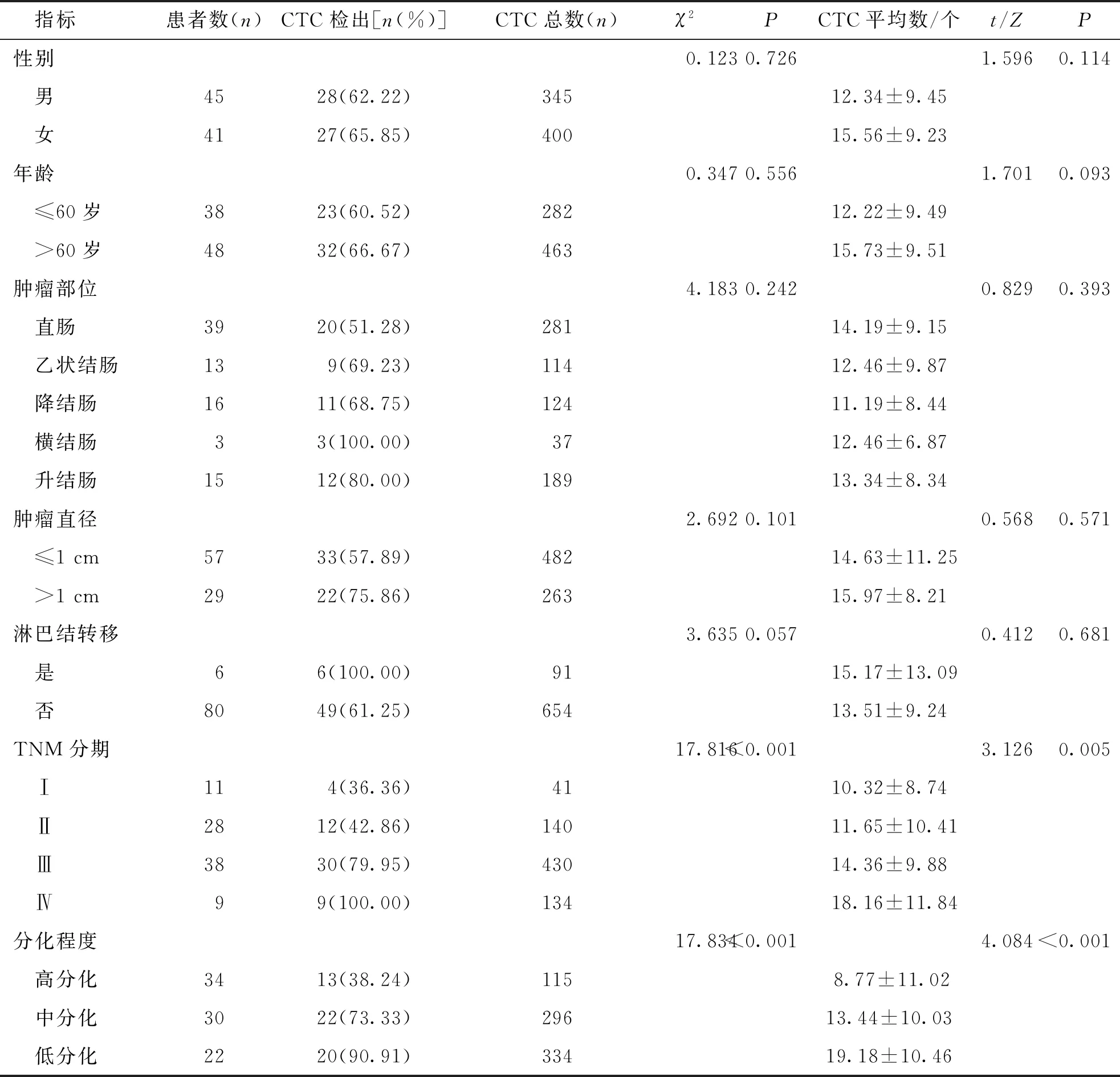
表1 86例CRC患者的一般临床特征及基线CTC计数
2.2 不同分化程度CRC患者的基线CTC计数
结果显示,与中、低分化组比较,高分化组患者基线CTC阴性患者的比例明显增加,差异有统计学意义(P<0.001);中、低分化组患者基线CTC阴性患者的比例比较,差异无统计学意义(P>0.05)。见表2。
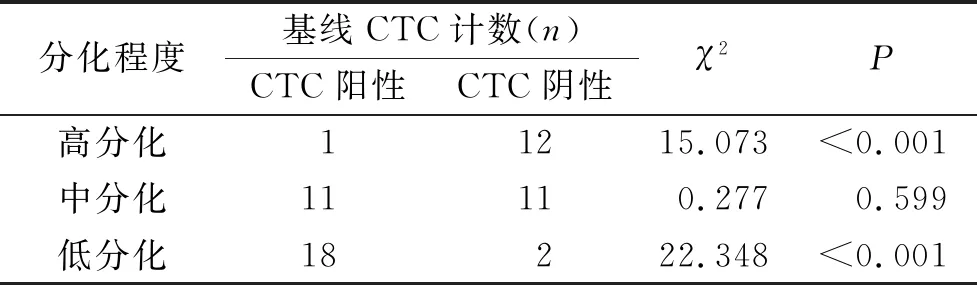
表2 不同分化程度CRC患者的基线CTC计数比较
2.3 不同病理组织学类型CRC患者基线CTC计数
结果显示,不同病理组织学类型的基线CTC计数阳性与阴性CRC患者比例比较,差异无统计学意义(P>0.05)。见表3。
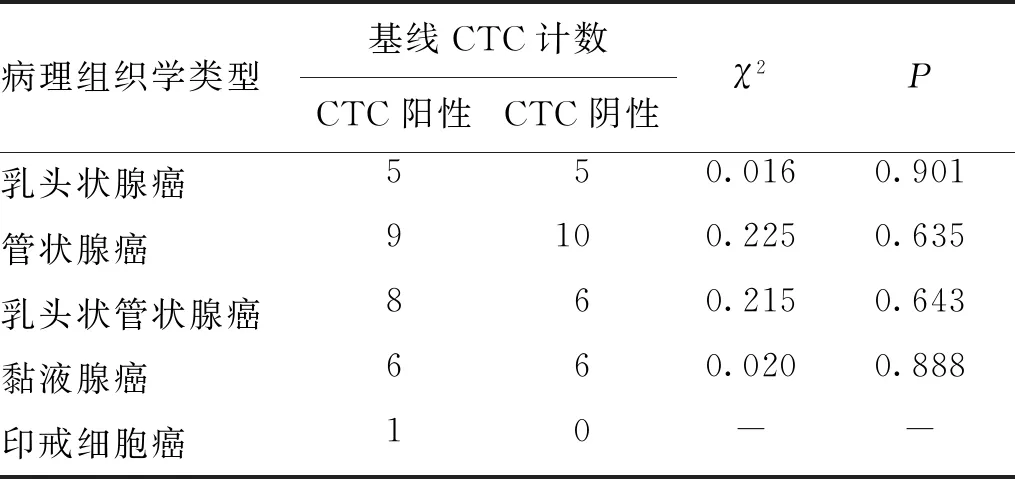
表3 不同病理组织学类型CRC患者的基线CTC计数比较
2.4 不同肿瘤标志物检测结果与CRC患者基线CTC计数的相关性
结果显示,肿瘤标志物中阳性率最高的为癌胚抗原,达51.16%(44/86),与CTC阳性率的63.95%最为接近,χ2检验和SPearman分析显示,CTC阳性率与癌胚抗原有相关性(P<0.05),与CA199和CA125无明显相关性(P>0.05)。见表4。
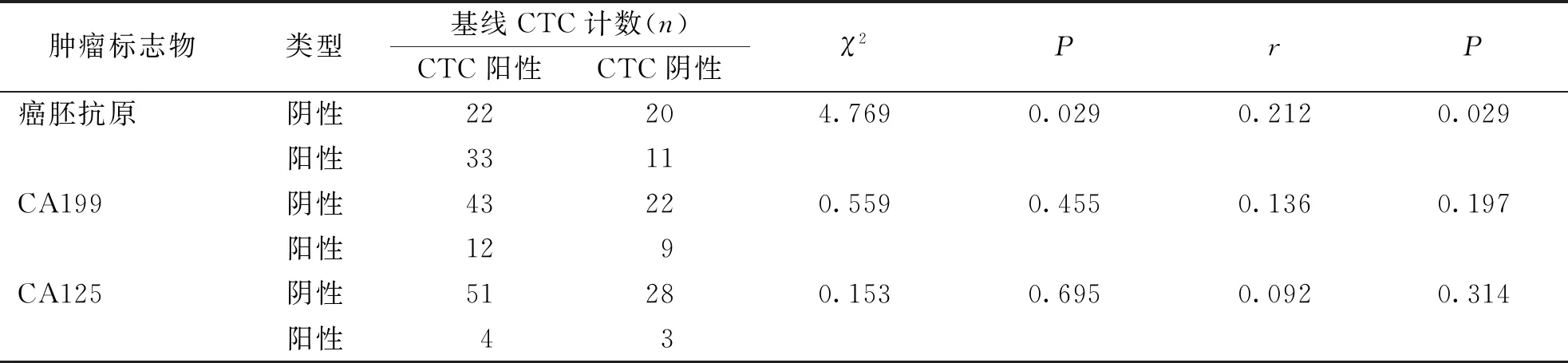
表4 不同肿瘤标志物检测结果与CTC检测结果相关性
2.5 外周血CTC变化
结果显示,CRC患者手术前1 d及手术后第7及30天时的外周血CTC计数分别为13.34±9.59、9.39±9.39及5.46±6.18;与手术前1 d比较,手术后第7及30天时的外周血CTC计数降低,差异有统计学意义(P<0.01),见图1。预后分析结果显示,CTC阳性组较CTC阴性组患者部分缓解(PR)和稳定(SD)比例下降,总生存时间缩短(P<0.05)。
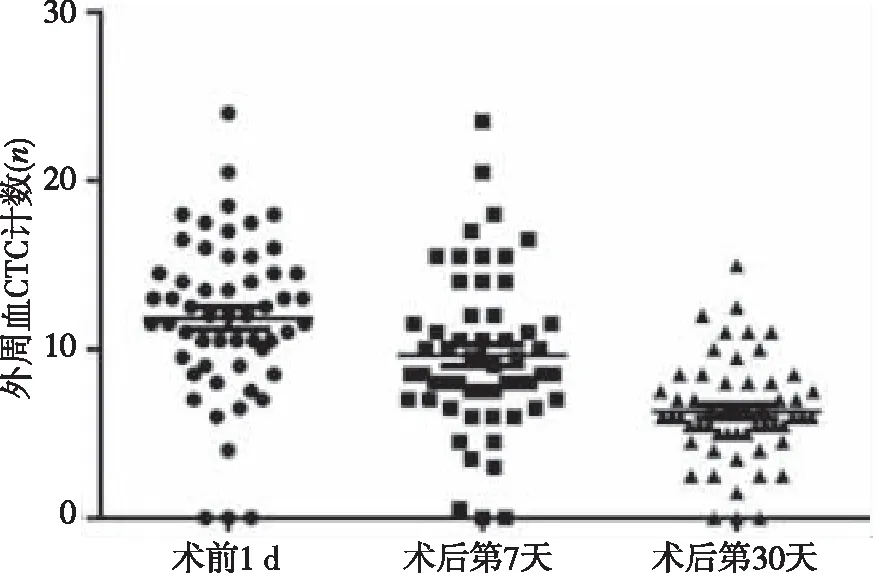
图1 CRC患者手术前后的外周血CTC变化
3 讨论
近年来,大量研究发现,外周血CTC在肺癌、乳腺癌以及CRC等恶性肿瘤的诊断和预后评估中具有重要的作用,具有方便、快捷且创伤低的优势,有极大的临床应用潜力[5-7]。Aggarwal等[8]通过对50例小细胞肺癌(SCLC)患者行前瞻性研究发现,CTC<50的患者较CTC≥50患者的无进展生存期(PFS)和总生存时间(OS)明显增长显着相关,提示CTC与SCLC患者的疾病阶段和生存相关,这表明CTC可用作临床反应的替代生物标志物。Chudasama等[9]研究发现,与低增殖CTC的患者相比,具有高增殖(Ki-67)状态的CTC的患者的PFS(P=0.001 1)和总体生存率(P=0.009 5)明显降低。Adriana等[10]通过利用对行化疗治疗的结肠癌患者于化疗1周后检测CTC发现,CTC阳性率与患者预后密切相关,且CTC可作为结肠癌患者制定个体化治疗方案的参考指标。目前,有关CTC的研究主要涉及外周血中的RNA和DNA表达、细胞信号传导途径以及血清生物标志物[11-14]。在一些医院中已经开展了外周血CTC的临床检测[15],但是,主要用作对手术及化疗进行初步分析和评估的工具[16-18],缺乏较大样本量的临床CTC研究,且很少有研究探讨外周血CTC数目与原发性恶性肿瘤及其病理组织学特征的相关性。
本研究对于CRC患者手术前CTC的数目,及其与肿瘤分化程度、淋巴结转移、肿瘤大小以及化疗效果和OS等关系进行了研究,并且比较了手术前以及手术后第7天和30天的CTC数目。本研究结果显示,86例结肠癌患者中CTC阳性例数为55例,检出率为63.95%,共检出CTC数745个,其中横结肠癌CTC检出率最高,达100%,且结肠癌CTC检出率74.46%(35/47)明显高于直肠癌51.28%(20/39),这与汪栋等[19]研究报道类似。相关性分析显示,CTC检出率与患者TNM分期和分化程度有关(P<0.05),与性别、年龄、肿瘤部位、肿瘤直径、病理组织学类型以及淋巴结转移等临床特征无关(均P>0.05)。复发转移是导致结肠癌患者死亡的最主要因素[20-23],因此,作为与转移高度相关的CTC,推测其在预测结肠癌复发和转移具有重要的临床意义。此外,在对CTC检出率与不同类型肿瘤标志物相关性研究发现,肿瘤标志物中阳性率最高的为癌胚抗原,达51.16%(44/86),与CTC阳性率的63.95%最为接近,且CTC阳性率与癌胚抗原相关性密切(P<0.05),而与CA199和CA125无明显相关性(P>0.05)。因此,对于结肠癌患者,可行癌胚抗原和CTC联合检测,以提高预测预后的准确性。
此外,本研究结果显示,与手术前1 d比较,手术后第7天及30天的外周血CTC计数均明显降低(P<0.01),提示外周血CTC可以作为评估手术效果和预后的临床指标。Liu等[24]的一项分析结果显示,外周血CTC数目与肿瘤体积相关。肿瘤体积过小与无法检测到外周血CTC有关。本研究中的所有患者均接受了肿瘤根治性切除术。绝大多数肿瘤细胞已经被清除,最大限度地减少了CTC从肿瘤原发灶释放进入外周血[25]。本研究观察到的术后第7 天和30天的外周血CTC计数显著减少可能可以作为评估手术效果和患者预后的重要指标之一。
综上所述,CRC患者外周血中可以检测到较高的CTC计数。外周血CTC计数与CRC的低分化相关,从一定程度上反映了肿瘤的恶性程度。此外,术后第7天和30天外周血CTC计数显著降低,提示动态监测CRC患者外周血CTC对于评估治疗效果和患者预后具有重要意义,未来还应该进行更大样本量和长期随访,来进一步确定外周血CTC计数的临床意义。

