沉默信息调节因子1基因敲除小鼠椎间盘软骨组织中胶原的动态变化*
夏晓枫, 车彪, 覃松, 刘骏, 罗斌
(长江航运总医院 骨外科, 湖北 武汉 430014)
椎间盘退行性疾病是临床骨科常见疾病,多表现为脊柱赘生物形成、椎间隙狭窄、椎间盘突出等临床特征。尽管牵引疗法、开放性手术、消融术等都可给椎间盘退行性疾病患者带来一定的临床收益[1-3],但目前尚未有任何方法能够完全逆转椎间盘退变趋势。椎间盘退行性疾病是在多种因子作用下导致椎间盘脊髓细胞各胶原水平及数量变化所产生的结果,探讨影响胶原动态变化的相关因子对于帮助临床医师认识椎间盘退行性疾病具有重要的临床意义[4]。国内外研究指出,沉默信息调节因子1(silent information regulator1,SIRT1)可影响细胞衰老进程[5-6],杨宜锜等[7]的研究则明确指出SIRT1可对骨代谢进行调节,尽管SIRT1基因表达水平与椎间盘退行性疾病或椎间盘退变相关细胞间存在一定的关系,但目前对于SIRT1基因如何影响椎间盘退行性病变的作用机制尚未完全清楚。Ⅰ型胶原(type-Ⅰ collagen,ColⅡ)、Ⅱ型胶原(type-Ⅱ collagen,ColⅡ)和Ⅹ型胶原(type-X collagen,Col X)水平的改变与骨细胞凋亡和衰老密切相关,而SIRT1可能通过影响胶原水平从而作用于椎间盘退行性改变[7]。为进一步分析SIRT1在椎间盘中的作用,本研究以Col2-CreSIRT1co/co(SIRT1+/+)小鼠作为动物模型,观察敲除SIRT1后小鼠软骨组织中ColⅡ、ColⅡ及ColX等胶原的动态变化。
1 材料与方法
1.1 材料
1.1.1动物 SIRT1co/co小鼠(白色,雄性)和Col2-CreERT2小鼠(黑色,雌性)均购自于美国杰克逊实验室。
1.1.2主要试剂及仪器 他莫昔芬(北京凯瑞基生物科技有限公司),戊巴比妥钠(枣庄水泰岚化工有限公司),甲醛溶液(厦门慧嘉生物科技有限公司),苏木精-伊红(上海蓝季科技发展有限公司),胰酶(北京凯瑞基生物科技有限公司),考马斯亮蓝(上海金穗生物科技有限公司),SIRT1引物[生工生物工程(上海)有限公司],山羊抗兔ColⅡ、ColⅡ及ColX一抗(均购自上海江莱生物科技有限公司),核酸蛋白测定仪(Thermo Fisher,上海艾研生物科技有限公司)、3.0T核磁共振(Achieva,飞利浦)、数字化X光机(岛津,日本)。
1.2 方法
1.2.1分组 所有小鼠均饲养于二级动物房内,12 h明暗循环(明7 ∶00~19 ∶00,暗19 ∶00~次日7 ∶00),清洁饮水、自由饮食。取出生6周的Col2-CreERT2小鼠与SIRT1co/co小鼠交配,挑选基因型为Col2-CreSIRT1co/co(SIRT1+/+)的小鼠为研究对象,取6周龄小鼠15只,Col2-CreSIRT1co/co小鼠腹腔注射10 g/L的他莫昔芬(75 mg/kg给药)诱导小鼠组织中的SIRT1基因敲除获得SIRT1-/-小鼠作为试验组;另取30只SIRT1+/+小鼠随机分为正常组及模型组,每组15只,均腹腔注射等体积的生理盐水(1次/d、连续5 d)。
1.2.2造模及样本收集 取模型组、试验组小鼠,俯卧位并固定四肢,颈后部剃毛备皮准备,消毒铺巾后肌注2%戊巴比妥钠(以40 mg/kg给药)麻醉小鼠,沿腰背部棘突上正中切口,并沿骨膜剥离、去除L1~L6椎间棘突、关节突、棘间韧带、棘上韧带等,两侧竖棘肌切断后检查是否切除干净,检查完全后逐层缝合筋膜、皮肤,术后肌注50 000 U青霉素抗感染,连续3 d;正常组行假手术,采用试验组同样的方法麻醉、消毒,但仅做切口后缝合,术后也给予抗感染处理。所有小鼠行手术后均单独放置于饲养箱中饲养,正常给食、喂水,同等温湿度下喂养。术后第4、8及12周时,每组随机选取5只小鼠,均腹腔注射过量戊巴比妥钠麻醉后处死,完整取下上下软骨板与椎体交界处的L5~L6椎间盘,用于后续实验。
1.2.3X线片及组织学检查 3组小鼠于手术第4周时行X线片检查并记录结果,并将1.2.2项下得到的椎间盘组织于10%甲醛溶液中固定、固定完全后流动水冲洗,并梯度乙醇脱水,浸蜡包埋并做石蜡切片,HE染色,正置生物显微镜下观察。
1.2.4软骨组织中SIRT1表达 取术后第4周获得的椎间盘软骨组织样本,剪碎组织小块后胰酶消化,过滤、离心后取上清液,采用考马斯亮蓝染色法、核酸蛋白测定仪测定蛋白浓度,制胶、电泳、半干法转膜、加一抗、二抗孵育后,化学发光底物反应,以β-actin为内对照;另取上清液做实时PCR扩增定量分析,SIRT1引物上游序列5′-CAGTGTCATGGTTCCTTGC-3′、下游序列5′-CACCGAGGA ACTACCTGAT-3′,产物长度104 bp,提取细胞总RNA,逆转录后PCR扩增,共40个循环,以U6为内参。
1.2.5ColⅠ、ColⅡ及Col X表达 取术后第4、8及12周小鼠的软骨组织切片,甲醇溶液孵育15 min,胰酶消化10 min、5%BSA封闭,加兔多克隆抗体ColⅠ、ColⅡ及Col X一抗,4℃过夜,加山羊抗兔IgG二抗(37 ℃、15 min),加抗生蛋白链菌素-HRP孵育(37 ℃、10 min),DAB显色、苏木精染色,脱水、封固,阴性对照组一抗以PBS代替。每个样本取3个视野行统计分析。
1.3 统计学处理

2 结果
2.1 组织学改变、X线观察及SIRT1水平
术后第4周的HE染色及X线片检查结果显示,正常组小鼠椎间盘纤维结构清晰、层次分明,且呈同心圆的规整性排列、髓核内可见髓核脊索细胞;模型组小鼠纤维环排列欠完整,可见轻度增生的软骨细胞、胶原环出现排列紊乱、髓核细胞数目有所减少;试验组小鼠椎间盘纤维环明显紊乱,髓核细胞明显减少;X线片结果显示,正常组和试验组小鼠颈椎和腰椎段生理前凸角度均较模型组大。Western Blot法检测SIRT1图像软件灰度值分析结果及实时定量PCR结果显示,试验组小鼠软骨组织的SIRT1水平显著低于正常组和模型组(P<0.05),模型组SIRT1水平显著低于正常组(P<0.05)。详见图1~图4。
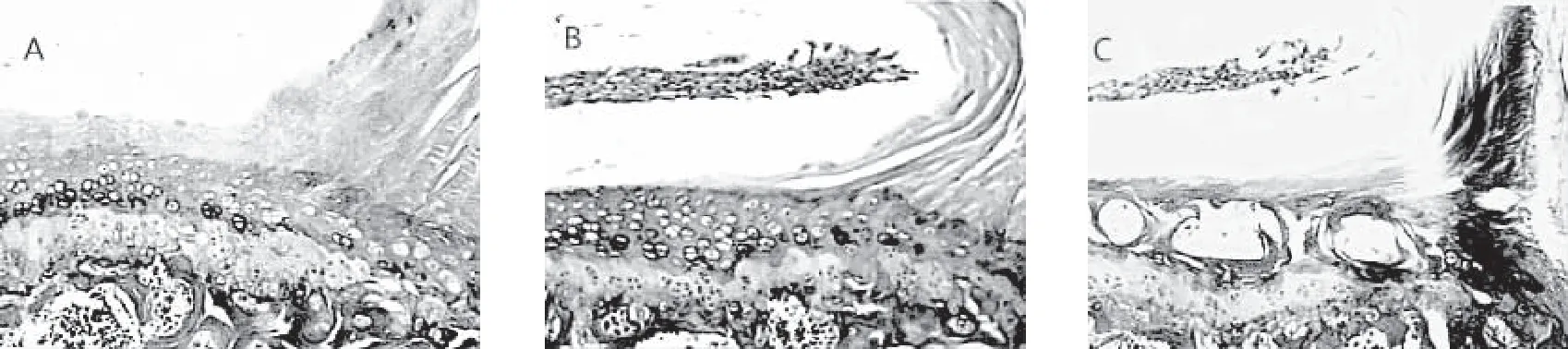
注:A为正常组,B为模型组,C为试验组。
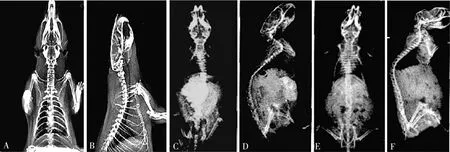
注:A为正常组正位图,B为正常组侧位图,C为模型组正位图,D为模型组侧位图,E为试验组正位图,F为试验组侧位图。
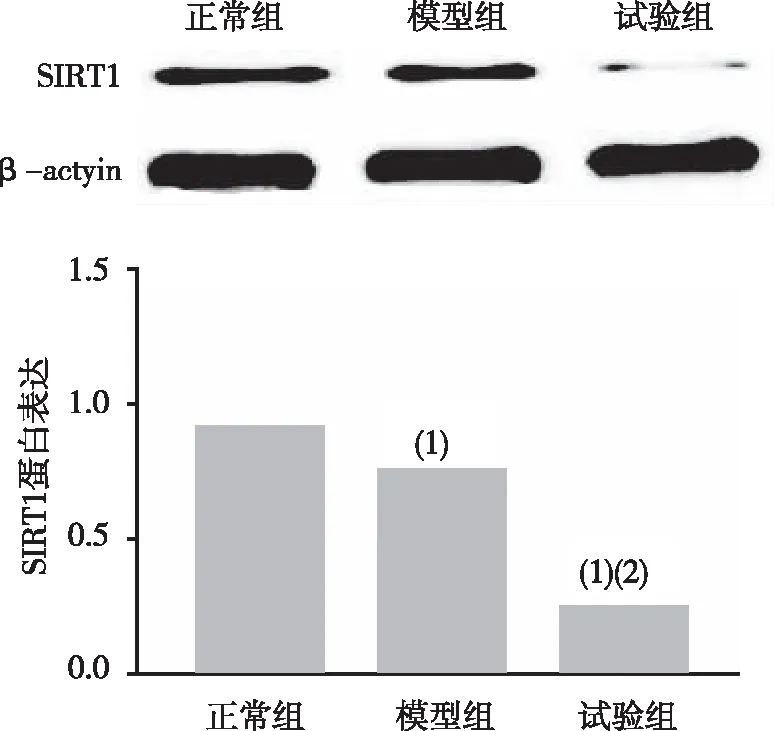
注:(1)与正常组比较,P<0.05;(2)与模型组比较,P<0.05。
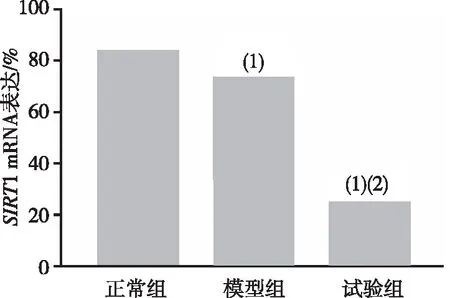
注:(1)与正常组比较,P<0.05;(2)与模型组比较,P<0.05。
2.2 ColⅠ、ColⅡ及Col X表达
结果显示,术后第8及12周时的3组小鼠椎间盘软骨组织中Col Ⅰ、Col X水平高于术后第4周、Col Ⅱ低于术后第4周,差异有统计学意义(P<0.05);同时点比较,正常组各时点的Col Ⅰ、Col X均低于模型组和试验组,差异有统计学意义(P<0.05),试验组ColⅠ、ColX高于模型组, ColⅡ显著低于模型组,差异有统计学意义(P<0.05)。见表1、图5。
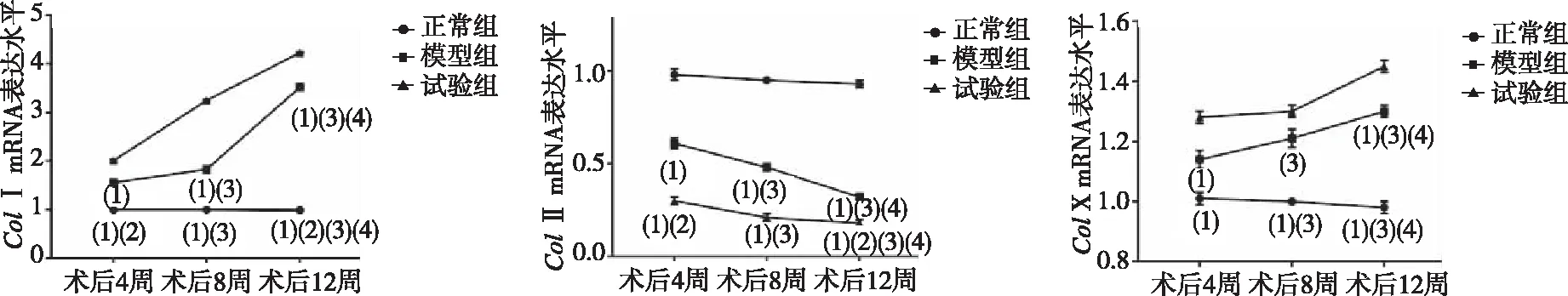
注:(1)示同时点与正常组比较,P<0.05;(2)示同时点与模型组比较,P<0.05;(3)示同组间与术后4周比较,P<0.05;(4)示与术后8周比较,P<0.05。
表1 各组小鼠不同时点椎间盘软骨组织的ColⅠ、ColⅡ及Col X表达
3 讨论
当前尚未明晰椎间盘退变的具体发生机制,且也尚未有任何方法能够完全逆转椎间盘退变趋势,导致椎间盘退行性疾病治疗效果十分有限。从多方面探究椎间盘退变机制也是当前学者们研究的重点。椎间盘由富有弹性的胶状物组成的中央部髓核和中位呈同心圆排列的纤维环组成,是人体中最大的无血管组织。正常情况下的髓核细胞处于生理性低氧张力、酸性环境中,其营养供给来源于纤维环途径和软骨终板途径[8-10],且以后者为椎间盘最为重要的供给途径。但当软骨终板细胞发生退变时,软骨终板钙化,降低椎间盘组织物质代谢,导致细胞外基质聚集、水分减少、乳酸堆积并导致椎间盘细胞死亡[11-12];软骨终板细胞退变也可通过影响肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-10(interleukin-10,IL-10)等炎性因子的水平而促进椎间盘退变[13]:这些改变都能够从胶原成分的动态改变加以分析。
ColⅠ是同心圆组织成分,负责椎间盘的抗力张强度(即吸收传递、牵拉变形等能力),ColⅡ是反应软骨基质的承受应力(即吸收震荡、弹性形变的能力),ColX则为软骨板提供了钙化环境,ColⅠ升高、ColⅡ下降导致髓核应力平衡被打破从而影响椎间盘的稳定性[14-15],且ColⅡ、ColX与基质血管之间又可通过激活Ca+通道而促进骨化[16-17]。可以说,ColⅠ、ColⅡ、ColX的动态变化可有效反应椎间盘退行性程度。本研究选择的 Col2-CreSIRT1co/co小鼠是一类含雌激素受体的配体结合区突变体(ERT)与Cre重组酶融合蛋白表达的小鼠,注射他莫昔芬后,其代谢产物与ERT相结合激活酶活性,从而达到SIRT1基因敲除的目的。目前,手术是建立椎间盘退变小鼠最常用的手段,与假手术的正常组比较,模型组小鼠胶原术后各时点的ColⅠ、ColX、ColⅡ均显著变化,这提示模型组发生了椎间盘退行性改变;而试验组与模型组相比,术后各时点的ColⅠ、ColX、ColⅡ均显著变化,意味着试验组不仅出现了椎间盘退行性改变,且这种病变进程相较于模型组加快,同既往研究类似[7,14]。就正常组、模型组、试验组3组小鼠的Western blot法检查SIRT1的灰度值比较,试验组的SIRT1表达下降,这提示,SIRT1参与了小鼠椎间盘退行性病变过程,且可能是SIRT1基因通过影响ColⅠ、ColX、ColⅡ的表达从而参与椎间盘退变。
髓核细胞数量减少是椎间盘退变最主要的病理表现之一,而细胞凋亡、老化都可导致髓核细胞活性丧失[18]。SIRT1是沉默信号调控因子(silence signal regulating factor 2,Sirt2)最为相似的同系物,能够延缓多种细胞的衰老、凋亡,可作用于核细胞κB(nuclearfactor-κ B,NF-κB)、P53、FOXO发挥生物学功能[19-21]。SIRT1可对P53去乙酰化抑制其活性而减少P53所调控的细胞凋亡信号通路;SIRT1对NF-κB的影响机制较复杂[22-24],目前认为SIRT1可对细胞凋亡蛋白1抑制子(inhibitor of apoptosis protein,IAP)的启动子相结合而导致NF-κB信号通路未能激活;SIRT1还通过去乙酰化直接/间接调控叉头框转录因子(forkhead box,FOXO)活性而抑制细胞Fas(细胞凋亡基因)配体活性,以及通过FOXO延长细胞损伤DNA的自我修复时间从而提高其抗应激能力[25]:SIRT1可能正是通过影响NF-κB、P53、FOXO一种或多种途径调控髓核细胞衰老、凋亡。因此,在SIRT1基因被敲除后,调控髓核细胞衰老、凋亡能力减弱,从而导致病变进程加快,而相比于模型组,其胶原成分变化更为明显。
综上所述,本研究发现,敲除椎间盘模型小鼠的SIRT1基因会使小鼠软骨组织中的ColⅠ、ColX水平升高和ColⅡ水平降低。但未就SIRT1基因影响的具体信号通路加以分析,未就SIRT1基因对椎间盘小细胞增殖、凋亡进行研究;且在椎间盘中其炎症反应的剧烈程度也是导致退行性变化的重要因素之一,未就SIRT1基因是否对于TNF-α、IL-10等重要炎症因子有相同的作用趋势加以研究,这些都有待于后续研究。

