miR-129和CDKN2B-AS1基因多态性与云南汉族人群2型糖尿病发病风险的相关性*
何思琦, 杨曼, 杨莹, 王飞英, 王晓苓, 卢廷莲 , 角铭, 李奕平**
(1.大理大学 临床医学院, 云南 大理 671000; 2.云南大学附属医院 & 云南省第二人民医院 内分泌科, 云南 昆明 650021; 3.云南省急救中心 急救科, 云南 昆明 650000)
研究发现2型糖尿病(type 2 diabetes mellitus, T2DM)是一种多基因遗传的慢性代谢性疾病,具有很强的遗传易感性[1-2]。非编码RNA(non-coding RNAs, ncRNAs)是一类基因组转录产物,主要包括微小RNA(microRNA, miRNA)和长链非编码RNA(long non-coding RNA, lncRNA),可在转录、转录后或表观遗传水平调控靶基因基因表达,并作为信号、诱饵、引导、支架和监督在疾病的遗传易感性中发挥重要作用[3-6]。既往研究表明miRNA和lncRNA参与调控糖脂代谢紊乱及T2DM相关信号通路,并与T2DM发生发展有关[7-12]。miRNA和lncRNA中的单核苷酸多态性(single nucleotide polymorphism, SNPs)可能通过影响成熟miRNA和lncRNA的表达或其对靶基因的识别,从而影响T2DM的遗传易感性[13-15]。近年来,有研究证明miRNA和lncRNA基因多态性可能与T2DM有关[14-16],miR-129及CDKN2B-AS1基因被证实与糖脂代谢相关[8, 11-12, 17-18]。miR-129基因中的rs791595位于内含子区域,可能与T2DM遗传易感性有关[16]。而CDKN2B-AS1基因中的rs10811661位于外显子区域,其等位基因与欧洲人群T2DM发病风险有关[14,19]。基于此,本研究选取miR-129基因SNPs位点rs791595及CDKN2B-AS1基因SNPs位点rs10811661,调查其在云南汉族人群T2DM患者和健康人群中的分布特征,并分析其与T2DM易感性的关系。
1 资料与方法
1.1 资料
1.1.1对象及分组 随机选取2018年2月—2020年3月内分泌科住院的746名T2DM患者(男471例,女275例)作为T2DM组。根据1999年世界卫生组织(world health organization, WHO)及2020年美国糖尿病协会(american diabetes association, ADA)[1]诊断标准:(1)空腹血糖(fasting plasma glucose, FPG)≥7.0 mmol/L或餐后2 h血浆血糖≥11.1 mmol/L+糖尿病(diabetes mellitus, DM)症状;(2)若无DM症状,需2次血糖检测异常。此外,测量胰岛素分泌和C肽水平以排除1型糖尿病(type 1 diabetes mellitus, T1DM)受试者。对40岁以下的受试者,检测胰岛细胞自身抗体和谷氨酸脱羧酶自身抗体,排除自身抗体阳性的受试者。本研究未纳入妊娠妇女,且病史排除了特定类型的DM,如糖皮质激素诱导的DM。选取同期体检的842例非糖尿病(non-diabetic, NDM)个体(男502例、女340例)作为NDM组。NDM组研究对象具有以下情况将被排除:(1)FPG≥6.1 mmol/L和(或)糖化血红蛋白(glycosylated hemoglobin, HbA1C)≥5.7%[1];(2)具有DM家族史;(3)具有高血压病和冠状动脉粥样硬化性心脏病等慢性疾病。所有研究对象均为居住于云南地区、彼此无血缘关系的汉族个体。
1.1.2主要试剂和仪器 凯杰微量血DNA提取试剂盒(QIAamp DNA Blood Mini Kit,批号163024128,货号51106,德国QIAGENE公司),基因分型试剂(TaqMan Genotyping Master Mix,ABI公司,美国),TaqMan探针分型试剂盒(rs791595探针试剂盒编号为C___7564161_10和rs10811661探针试剂盒编号为C__31288917_10,Thermo Fisher Scientific公司,美国),多功能微孔板读数仪(Thermo Scientific Varioskan LUX公司,美国),QuantStudio 6实时荧光定量PCR仪(ABI公司,美国)。
1.2 方法
1.2.1糖脂代谢指标检测 禁食12 h后清晨采集研究对象静脉血,分离血清。采用己糖激酶法测定血清FPG,氧化酶法测定血清总胆固醇(total cholesterol, TC),甘油磷酸氧化酶法测定血清甘油三酯(triglycerides, TG),直接法测定血清高密度脂蛋白胆固醇(high-density lipoprotein-cholesterol, HDL-C)和低密度脂蛋白胆固醇(low-density lipoprotein-cholesterol, LDL-C),酶法测定血清HbA1C。所有的代谢指标检测均使用HITACH自动分析仪7600-020测定。
1.2.2基因组DNA的提取 采用凯杰微量血DNA提取试剂盒提取全血基因组DNA,并采用多功能微孔板读数仪对DNA的质量进行检测。
1.2.3SNPs位点筛选及基因分型 采用Taq Man-MGB探针法对miR-129基因SNPs位点rs791595和CDKN2B-AS1基因SNPs位点rs10811661进行基因分型。根据分型样本数配置适量反应体系后加入384孔板,于Quantstudio6 PCR仪进行基因分型。反应体系为5 μL(PCR混悬液4 μL及25 mg/L DNA模板1 μL)。PCR反应条件为95 ℃预变性10 min,92 ℃变性10 s、60 ℃退火延伸1 min,共40个循环,最后40 ℃长延伸5 min。每块384孔反应板中包含每个SNPs位点的3个基因型(野生纯合子、突变纯合子、杂合子)的标准样品作为基因分型实验的阳性对照孔,同时设置阴性对照孔(用双蒸水代替DNA模板)。
1.3 统计学分析
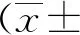
2 结果
2.1 基本临床特征
研究对象的基本临床特征详见表1,T2DM组和NDM组的年龄和性别比较差异无统计学意义(P>0.05)。T2DM组男性患者明显多于女性患者,且男性患者有更年轻化的发病趋势。T2DM组与NDM组个体的糖脂代谢指标(TC、TG、LDL-C、FPG、HbA1C及HDL-C)比较,差异有统计学意义(P<0.001),提示T2DM患者具有明显的糖脂代谢紊乱。
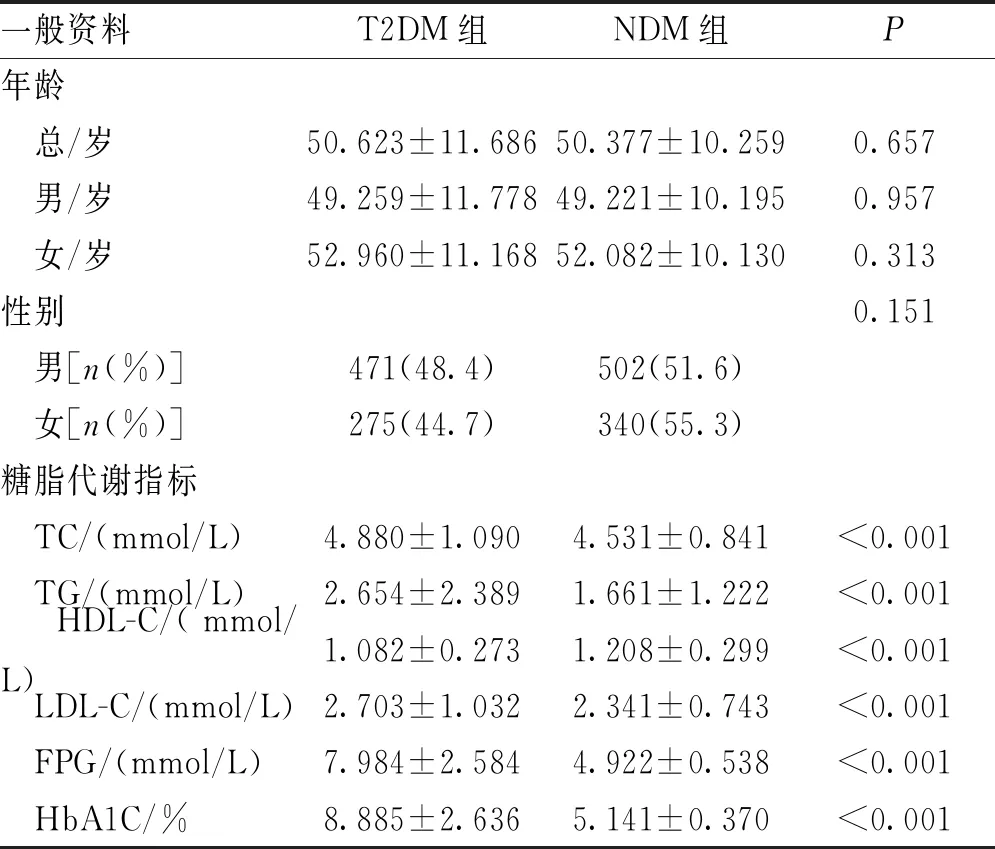
表1 T2DM组与NDM组受试者的临床特征及糖脂代谢指标
2.2 SNPs位点rs791595和rs10811661等位基因和基因型与T2DM的相关性
HWE分析显示,2个SNPs位点的基因型在T2DM组(P=0.858、0.457)及NDM组(P=0.058、0.068)的分布均符合HWE(P>0.05),说明本研究的2组受试者均符合群体代表性。SNPs位点rs791595和rs10811661的等位基因和基因型在T2DM组和NDM组中的分布结果显示,CDKN2B-AS1基因SNPs位点 rs10811661等位基因频率在T2DM组和NDM组中分布比较,差异有统计学意义,该位点等位基因C可能是T2DM的保护性因素(OR=0.851,95%CI为0.740~0.979,P=0.024);而miR-129基因SNP位点 rs791595等位基因及基因型频率在T2DM组和NDM组中分布频率比较,差异无统计学意义(P>0.025)。见表2。
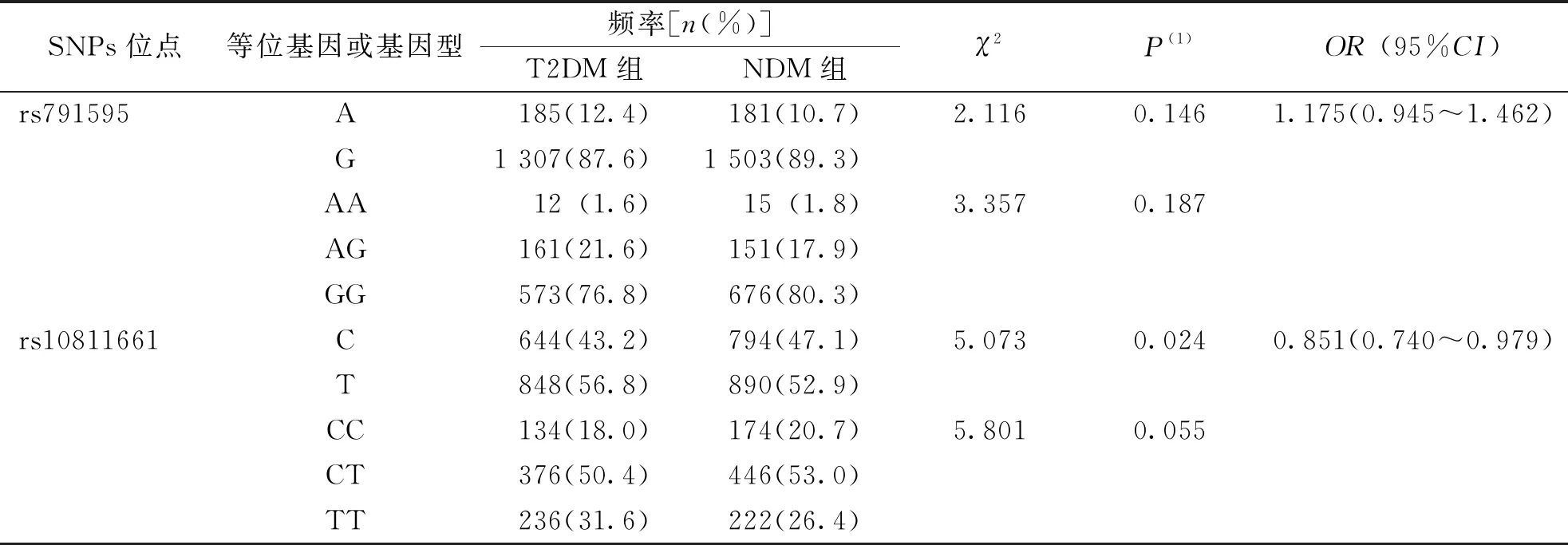
表2 SNPs位点rs791595和rs10811661的等位基因和基因型在T2DM组和NDM组间的分布
2.3 显性及隐性遗传模式下rs791595和rs10811661与T2DM的相关性
采用Logistic回归法分析SNPs位点rs791595位点和rs10811661在显性及隐性遗传模式下与T2DM的相关性。结果显示,显性遗传模式下,rs10811661 位点的C/T-C/C基因型相较于TT基因型是T2DM疾病进展中的保护因素(OR=0.780,95%CI为0.620~0.960,P=0.021);未发现rs10811661位点隐性及rs791595位点显性和隐性遗传模式下其基因型与T2DM存在相关性(P>0.025)。见表3和表4。
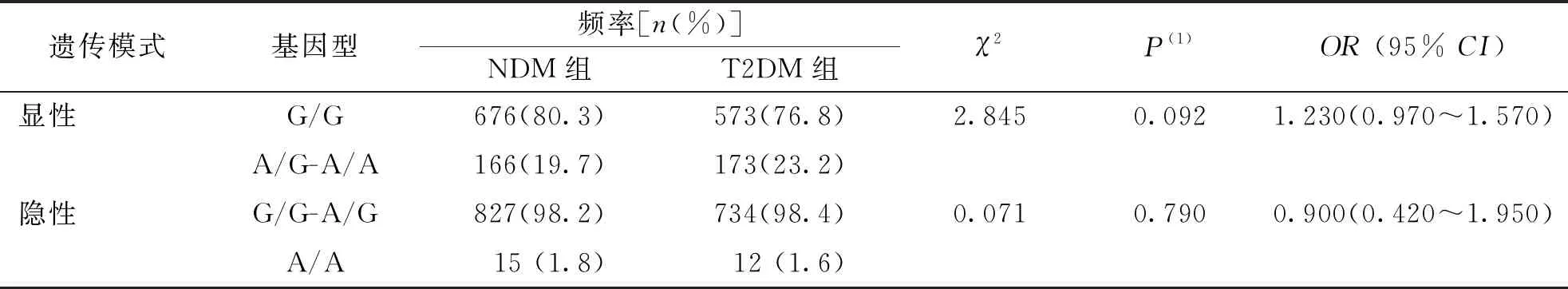
表3 SNPs位点rs791595在T2DM组与NDM组间显性和隐性遗传模式分析
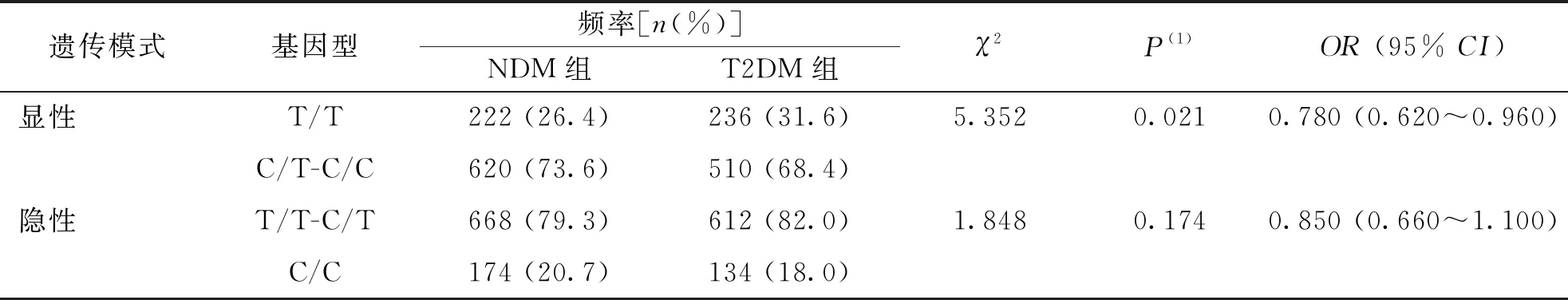
表4 SNPs位点rs10811661在T2DM组与NDM组间显性和隐性遗传模式分析
2.4 SNPs位点rs791595和rs10811661的基因型与糖代谢指标的相关性
采用单因素方差分析SNPs位点rs791595和rs10811661的基因型与代谢指标的相关性。结果显示,在T2DM组和NDM组中,2个SNPs位点rs791595及rs10811661各基因型的各糖脂代谢指标(包括FPG、TC、HDL-C、TG、LDL-C和HbA1C)比较,差异无统计学意义(P>0.017)。见表5~表8。
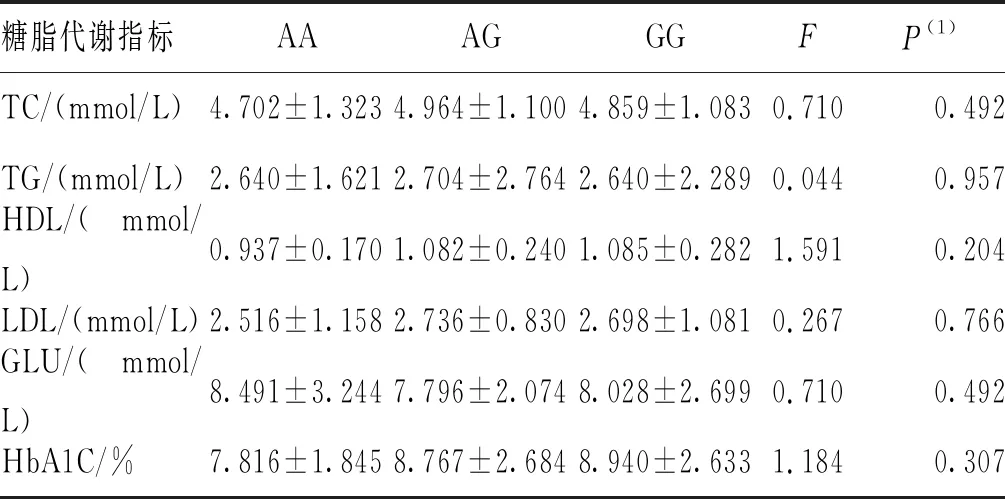
表5 T2DM组SNPs位点rs791595各基因型的糖脂代谢指标比较
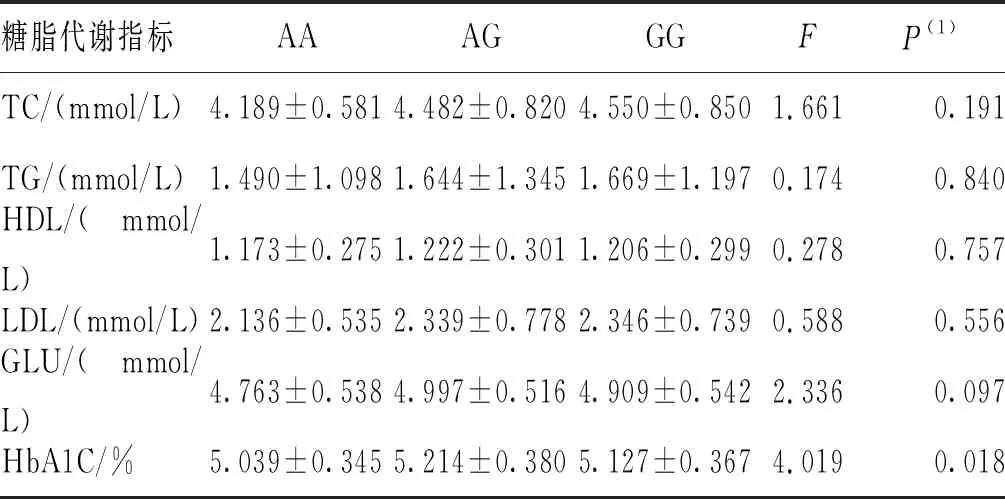
表6 NDM组SNPs位点rs791595各基因型的糖脂代谢指标比较
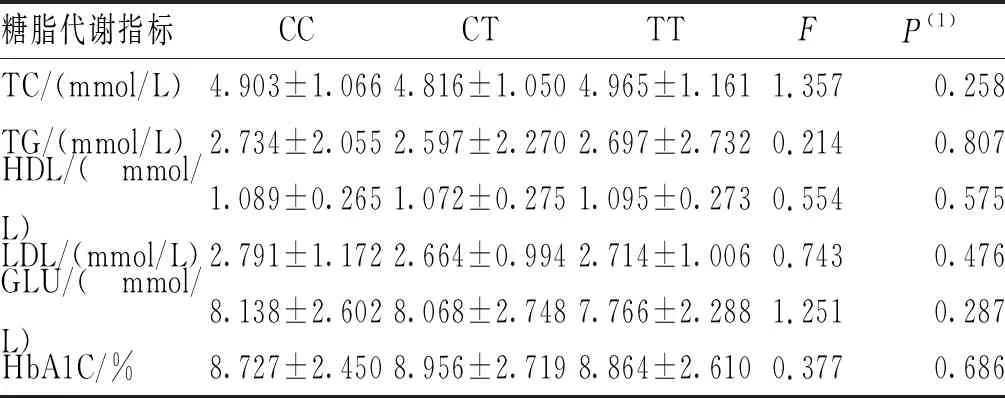
表7 T2DM组SNPs位点rs10811661各基因型的糖脂代谢指标比较
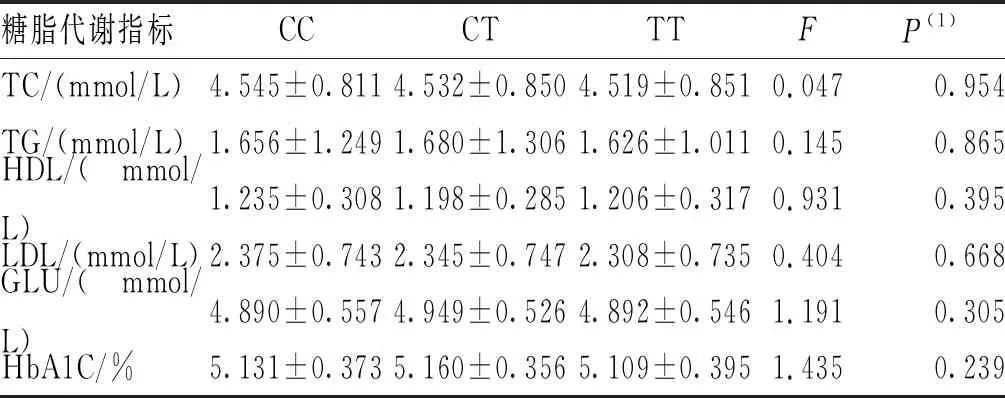
表8 NDM组SNPs位点rs10811661各基因型的糖脂代谢指标比较
3 讨论
T2DM发病机制复杂,具有强烈的遗传倾向。大量证据表明miR-129和CDKN2B-AS1在T2DM的发生发展中扮演重要角色[7, 10]。因此,本研究对746例T2DM患者和842例NDM个体miR-129和CDKN2B-AS1基因中的SNPs位点rs791595及rs10811661进行基因分型,评估其与中国云南汉族人群T2DM的相关性。
研究发现,miR-129循环表达水平在T2DM及代谢综合征(metabolic syndrome, MS)患者中显著上调[7- 8];miR-129与循环甘油水平、丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号通路、葡萄糖摄取及消耗、血脂和炎性因子水平有关[8, 11-12]。遗传相关性的研究亦表明miR-129基因SNPs位点rs791595可能与T2DM遗传易感性有关。2014年,Hara等[15]通过全基因组关联研究(Genome-Wide Association Studies, GWAS)证实rs791595A等位基因为日本人群T2DM的风险等位基因(P=2.55×10-13,OR=1.17)。但Nemr等[22]及Goto等[23]的研究报道rs791595等位基因及基因型分布频率在阿拉伯人群及日本人群T2DM组与对照组中差异无统计学意义。本研究也未发现miR-129基因SNPs位点rs791595等位基因及基因型与T2DM发病风险有关(P>0.05)。此外,2017年,Peng等[24]的研究显示未发现rs791595与中国人群T2DM伴糖尿病视网膜病变存在关联。提示引起SNPs位点rs791595研究结果存在差异的原因可能在于不同人群的T2DM风险等位基因频率存在差异,且同一人群纳入的不同研究对象及不同样本量也会影响最终的实验结果。
CDKN2B-AS1是DM易感基因周期素依赖性激酶抑制因子2B(cyclin dependent kinase inhibitor 2B,CDKN2B)的反义RNA[14, 19]。CDKN2B-AS1可通过调节CDKN2B启动子促进脂代谢[17-18],在DM环境中高表达[10, 25-26]。此外,CDKN2B-AS1还能与DM易感基因RBMS1稳定结合并正向调控其表达[19,27]。对于CDKN2B-AS1基因SNPs位点rs10811661,本研究结果显示rs10811661位点等位基因C在NDM组分布频率高于T2DM组(P=0.024),说明rs10811661的等位基因C可能是防止T2DM发生的保护性因素。2007年,来自英国的一项GWAS研究显示rs10811661T等位基因与欧洲人群T2DM发病风险有关[14]。随后,大量研究证实rs10811661等位基因T与韩国人群、中国人群、印度人群T2DM遗传易感性显著相关[28-32]。2010年,Cunnington等[13]报道DM风险等位基因rs10811661T与英国高加索人及混血南非DM人群中CDKN2B-AS1基因的低表达相关,该结果可能由于DM治疗过程中某些降糖生物分子应激性升高并靶向抑制CDKN2B-AS1基因表达引起。因此本研究推测rs10811661T等位基因与T2DM易感性有关可能由于其能引起体内CDKN2B-AS1基因表达水平变化并进一步影响β细胞功能导致,但这仍需要进一步的功能研究来证实。
此外,Xu等[29]发现rs10811661隐性遗传模式与中国T2DM人群T2DM相关,但未发现rs10811661显性遗传模式与T2DM的相关性。本研究结果显示,在显性遗传模式下,rs10811661 C/T-C/C基因型相较于TT基因型可能是T2DM疾病进展中的保护因素,这也与rs10811661 C可能是防止中国云南汉族人群T2DM发生的保护性因素结论相一致。但本研究未发现CDKN2B-AS1基因SNPs位点rs10811661基因型与糖脂代谢指标有关。与此同时,本研究也未发现miR-129基因SNPs位点rs791595基因型与糖脂代谢指标有关。造成该结果的原因可能是本研究纳入的人群样本量相对不足,需要在更大的人群中进行验证。
综上所述,本研究选取了miR-129基因及CDKN2B-AS1 基因的2个SNPs位点rs791595及rs10811661,研究其与中国汉族人群T2DM发生风险的相关性,结果提示CDKN2B-AS1基因的SNPs位点rs10811661可能与中国汉族人群T2DM遗传易感性有关,这可能是通过影响成熟CDKN2B-AS1的表达及其与T2DM相关靶基因的结合实现的。关于miR-129基因的SNPs位点rs791595与T2DM的关联目前研究较少,有待通过更多的人群相关性研究及扩大样本量来揭示miR-129基因多态性对T2DM发生发展产生的影响。

