轮状病毒感染性腹泻易感性与维生素D3水平关系研究
冯鹏华+李宝琪
(秦皇岛市第一医院儿科,河北秦皇岛 066000)
[摘 要] 目的:研究轮状病毒(Rotavirus,RV)感染性腹泻易感性与维生素D3水平关系,为RV感染性腹泻的预防和治疗提供理论依据。方法:秦皇岛市第一医院儿科2016年7月至2017年1月收治的125例RV感染性腹泻患儿纳入感染组,对照组招募100名健康儿童志愿者。检测两组受试儿童粪便RV,血清1-25羟维生素D3[1-25(OH)D3],血清白细胞介素-2(IL-2)、IL-4水平及免疫球蛋白G(IgG)、IgA、IgM,分析RV腹泻易感性与维生素D3的关系。结果:感染组1-25(OH)D3、IgG、IgA、IgM低于对照组,其IL-2高于对照组,差异有统计学意义(P<0.05)。多因素回归分析显示,1-25(OH)D3、IgG、IgA、IgM降低及IL-2升高是导致RV感染性腹泻易感性上升的危险因素(P<0.05);Pearson相关性分析结果,1-25(OH)D3与IL-2呈负相关,与IgG、IgA、IgM呈正相关(P<0.05)。结论:维生素D3水平降低可能造成儿童免疫功能失调,增加RV感染性腹泻易感性,补充维生素D3有望为RV感染性腹泻的防治提供新的思路。
[关键词] 轮状病毒;感染性腹泻;易感性;维生素D3
中图分类号:R725.7 文献标识码:A 文章编号:2095-5200(2017)04-056-03
DOI:10.11876/mimt201704023
轮状病毒(Rotavirus,RV)是儿童感染性腹泻最常见的原因,也是仅次于肺炎外导致儿童死亡的又一原因,患儿以大量水样便伴脱水、酸中毒及电解质紊乱为主要症状,目前全球范围内每年约有100万儿童死于严重腹泻[1]。机体感染RV所致免疫病理学异常是引发感染性腹泻相关临床症状的主要原因,且与患儿病情严重度有着密切关联[2]。最新研究发现,维生素D3可通过调节机体免疫反应,在肺炎、风湿等免疫相关性疾病的发生发展中发挥重要作用[3],但目前临床关于维生素D3与RV感染性腹泻易感性的研究缺乏。为弥补这一空白,本研究对125例RV感染性腹泻患儿与100名健康儿童志愿者进行了对照分析。
1 资料与方法
1.1 一般资料
秦皇岛市第一医院儿科2016年7月至2017年1月参照第八版《儿科学》中相关标准确诊[4]的125例RV感染性腹泻患儿为感染组,粪便RV阳性,且入院前未接受激素、抗病毒或维生素类药物治疗。对照组招募100名健康儿童志愿者,入组前筛查RV病毒,无RV感染方可入组。受试儿童均排除合并先天性免疫缺陷、支气管炎、上呼吸道感染、营养不良患儿;既往有感染、佝偻病等其他可能影响本研究结果的慢性病病史患儿。感染组125例患儿中,男79例(63.20%),女46例(36.80%),年龄4个月~8岁,平均(4.06±1.27)岁;对照组100例患儿中,男63例(63.00%),女37例(37.00%),年龄5个月~8岁,平均(3.99±1.15)岁。两组受试儿童年龄、性别比例比较,差异无统计学意义(P>0.05),具有可比性。本临床研究已征得我院医学伦理委员会批准,受试儿童监护人均签署知情同意书。
1.2 检测指标
此次研究检测指标包括粪便RV及血清指标:(1)粪便RV:取受试儿童粪便,以乳胶法检测粪便RV感染情况[5],RV抗原检测试剂盒购自芬兰Orion诊断公司;(2)血清指标:无菌采集受试儿童晨起空腹肘静脉血6 mL,分装于3个2 mL试管内,分别用于血清1-25羟维生素D3[1-25(OH)D3],
血清白细胞介素-2(IL-2)、IL-4水平及免疫球蛋白G(IgG)、IgA、IgM检测,其中,1-25(OH)D3检测采用酶联免疫吸附法(ELISA法)[6],试剂盒购自美国Rapidbio公司;IL-2、IL-4检测使用ELISA法,试剂盒购自美国R&D公司;IgG、IgA、IgM检测采用透射比浊法[7],试剂盒购自美国Roche公司。
1.3 分析方法
比较两组受试儿童粪便RV及血清指标检测结果的差异,将存在统计学差异的指标以自变量的形式纳入多因素分析,以感染性腹泻为因变量,采用Logistic逐步回归方程检验1-25(OH)D3等指标对RV感染性腹泻易感性的影响。此外,运用Pearson相关性分析,计算1-25(OH)D3与其他血清指标的相关性。
1.4 统计学处理
对本临床研究的所有数据采用SPSS20.0进行分析,性别、RV阳性率以(n/%)表示,并采用χ2检验,计量资料以(x±s)表示,并采用t检验,影响RV感染性腹泻易感染的相关因素采用Cox回归方程,相关性分析采用Pearson法,以P<0.05为差异有统计学意义。
2 结果
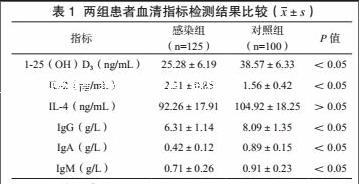
感染组1-25(OH)D3、IgG、IgA、IgM低于对照组,其IL-2高于对照组,差异有统计学意义(P<0.05)。见表1。
2.1 影响因素分析
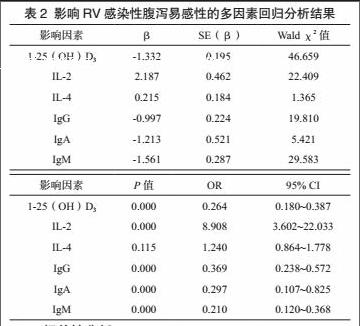
多因素回归分析结果,1-25(OH)D3、IgG、IgA、IgM降低及IL-2升高是导致RV感染性腹泻易感性上升的危险因素(P<0.05)。见表2。
2.2 相关性分析
Pearson相关性分析示,1-25(OH)D3与IL-2呈负相关(r=-0.426,P<0.05),与IgG(r=0.525)、IgA(r=0.631)、IgM(r=0.531)呈正相关,均P<0.05。
3 討论
RV是引起儿童感染性腹泻的主要病原体,其传染性极强,除粪-口途径外,还存在呼吸道传播途径,报道表明,6个月~3岁婴幼儿RV感染率极高,这与该年龄段婴幼儿机体免疫、消化系统尚未发育完善,而来自母体的抗体已明显下降有关[8]。由于RV感染性腹泻尚无特殊治疗药物,临床多强调以RV疫苗预防腹泻发生,但仍有部分家庭未按免疫频次要求接种或无RV疫苗接种史,导致我国儿童RV感染性腹泻发生率居高不下[9-10]。
在本次研究中,血清指標的观察可以发现,感染组患儿血清IL-2明显升高,IgG、IgA、IgM显著下降,说明患儿处于免疫功能失调状态,这是由于RV侵犯空肠绒毛上皮细胞可刺激其大量分泌T淋巴细胞,而T淋巴细胞激活可引发NF-κB通路活化,上调IL-2表达水平,作为一种具有细胞毒性的炎症因子,IL-2水平升高不仅意味着自身免疫受限,还可造成局部炎症反应增强、肠道屏障系统破坏[11-12]。初始CD4+T细胞接受抗原刺激后,在IL-4作用下可分化为Th2细胞,发挥抑制炎症应答作用,但本研究感染组患儿血清IL-4水平未见升高,考虑与患儿免疫系统尚未发育成熟,适应性细胞免疫应答无法有效发挥抗病毒效应有关[13]。感染组患儿IgG、IgA、IgM均明显下降,说明RA感染性腹泻患儿普遍处于体液免疫抑制状态,RV感染所致T细胞功能紊乱、B细胞分化增殖抑制及免疫球蛋白分泌下降可能是导致这一状态的主要原因[14]。
最新研究发现,作为一种脂溶性类固醇衍生物,维生素D3不仅可调控机体钙磷平衡,还具有神经内分泌-免疫调节激素作用,可参与免疫调节,并在保证肠道黏膜上皮细胞正常功能环节扮演重要角色[15]。有学者将维生素D3用于RV感染性腹泻患儿的治疗,发现维生素D3对于患儿临床症状的改善具有显著作用[16],说明维生素D3可能与RV感染性腹泻的发生发展具有一定关联。本研究多因素分析显示,维生素D3水平下降可造成儿童RV感染性腹泻易感性上升,且相关性分析显示维生素D3与IL-2、免疫球蛋白水平变化具有相关性,其机制可能为:1)维生素D3具有维持肠黏膜完整性、增强防御素表达作用,而维生素D3水平下降可造成肠黏膜屏障通透性上升、固有免疫功能下降,增加感染性腹泻易感性[17];2)维生素D3还可参与机体免疫调节,抑制T淋巴细胞分泌功能,其水平下降可造成T淋巴细胞激活、炎症因子释放,并造成体液免疫抑制,进而影响肠道功能、引起腹泻症状[18]。
维生素D3缺乏可造成儿童免疫功能失调,增加RV感染性腹泻易感性,其原因考虑与Th1细胞因子激活与体液免疫抑制有关,由于口服维生素D3不受肠道营养不良、病原菌侵害等因素影响,且不会造成肝肾负担,补充维生素D3有望成为RV感染性腹泻的新型治疗手段,值得进一步关注。
参 考 文 献
[1] 马慧, 黄敬孚, 林书祥,等. 儿童轮状病毒腹泻的流行病学研究[J]. 中国实用儿科杂志, 2010, 25(1):52-53.
[2] 高健, 张鸿彦, 张国利, 等. 2014年哈尔滨地区小儿轮状病毒腹泻流行特征探析[J]. 哈尔滨医科大学学报, 2016, 50(2): 159-161.
[3] Bucak I H, Ozturk A B, Almis H, et al. Is there a relationship between low vitamin D and rotaviral diarrhea?[J]. Pediatr Int, 2016, 4(58): 270-273.
[4] Badillo-Godinez O, Gutierrez-Xicotencatl L, Plett-Torres T, et al. Targeting of rotavirus VP6 to DEC-205 induces protection against the infection in mice[J]. Vaccine, 2015, 33(35): 4228-4237.
[5] Scharf R J, DeBoer M D, Guerrant R L. Recent advances in understanding the long-term sequelae of childhood infectious diarrhea[J]. Curr Infect Dis Rep, 2014, 16(6): 1-7.
[6] Das J K, Salam R A, Bhutta Z A. Global burden of childhood diarrhea and interventions[J]. Curr Infect Dis Rep, 2014, 27(5): 451-458.
[7] 陆爱英, 阳茂春. 两种不同方法检测EB病毒VCA-IgA的比较[C]// 全国临床免疫检验研讨会暨全国临床免疫学术会议. 2009.
[8] De V B, Vesikari T, Linhares A C, et al. A rotavirus vaccine for prophylaxis of infants against rotavirus gastroenteritis.[J]. Pediatr Infect Dis J, 2004, 23(10 Suppl):S179-82.
[9] Kandasamy S, Chattha K S, Vlasova A N, et al. Prenatal vitamin A deficiency impairs adaptive immune responses to pentavalent rotavirus vaccine (RotaTeq?) in a neonatal gnotobiotic pig model[J]. Vaccine, 2014, 32(7): 816-824.
[10] 徐子乾. 轮状病毒疫苗[J]. 中国疫苗和免疫, 2007, 13(6):611-613.
[11] Maffey L, Vega C G, Parreno V, et al. Controlling Rotavirus-associated diarrhea: Could single-domain antibody fragments make the difference?[J]. Rev Argent Microbiol, 2015, 47(4): 368-379.
[12] ORyan G M, Ashkenazi-Hoffnung L, ORyan-Soriano M A, et al. Management of acute infectious diarrhea for children living in resource-limited settings[J]. Expert Rev Anti Infect Ther, 2014, 12(5): 621-632.
[13] 熊田甜, 馬智超, 陈兵, 等. 2010—2015年深圳市宝安区轮状病毒腹泻流行特征[J]. 公共卫生与预防医学, 2016, 27(5): 37-39.
[14] Velázquez R F, Linhares A C, Mu?oz S, et al. Efficacy, safety and effectiveness of licensed rotavirus vaccines: a systematic review and meta-analysis for Latin America and the Caribbean[J]. BMC Pediatr, 2017, 17(1): 14.
[15] Kawashima H, Ishii C, Ioi H, et al. Transaminase in rotavirus gastroenteritis[J]. Pediatrics International, 2012, 54(1):86-88.
[16] Zhao Y, Yu B, Mao X, et al. Dietary vitamin D supplementation attenuates immune responses of pigs challenged with rotavirus potentially through the retinoic acid-inducible gene I signalling pathway[J]. Br J Nutr, 2014, 112(3): 381-389.
[17] Guarino A, Ashkenazi S, Gendrel D, et al. European Society for Pediatric Gastroenterology, Hepatology, and Nutrition/European Society for Pediatric Infectious Diseases evidence-based guidelines for the management of acute gastroenteritis in children in Europe: update 2014[J]. J Pediatr Gastroenterol Nutr, 2014, 59(1): 132-152.
[18] Taniuchi M, Platts-Mills J A, Begum S, et al. Impact of enterovirus and other enteric pathogens on oral polio and rotavirus vaccine performance in Bangladeshi infants[J]. Vaccine, 2016, 34(27): 3068-3075.
基金项目:秦皇岛市科学技术局,项目编号:201602A092。
第一作者:冯鹏华,本科,主治医师,研究方向:儿科临床,Email:sxpyfph6@163.com。

