脑微出血对急性脑梗死患者神经、认知功能和预后的影响▲
李红梅 热西达木·麦麦提 于庆亮
(新疆喀什地区第二人民医院1 神经内科,2 医院检验科,喀什市 844000,电子邮箱:306591051@qq.com)
急性脑血管病是目前我国居民第一位死亡原因,以急性脑梗死(acute cerebral infarction,ACI)多见。脑微出血是由脑内微小血管病变引起,以微小血管周围存在含铁血黄素沉积或吞噬含铁血黄素单核细胞为特征,具有出血倾向的脑小血管病[1]。研究表明,ACI患者的脑微出血的发生率为53.54%,且不同分型脑梗死患者脑微出血的发生率及严重程度不同[2]。出血性转化为ACI患者常见并发症[3]。存在脑微出血是否可增加ACI患者溶栓治疗的出血风险,并影响患者的神经和认知功能,目前国内外相关研究报告较少。最近研究显示,脑微出血与认知能力下降和痴呆密切相关[4]。本研究探讨脑微出血对ACI患者认知功能、神经功能、出血性转化及脑梗死再发的影响,旨为ACI预后的判断提供参考。
1 资料与方法
1.1 临床资料 收集2018年7月至2019年6月在新疆喀什地区第二人民医院神经内科住院治疗的200例ACI患者的临床资料,纳入标准:(1)符合全国第四届脑血管病学术会议制定的ACI诊断标准[5];(2)均为发病后2周内入院;(3)临床影像资料保存完整。排除标准:(1)严重心、肝、肾、肺等重要器官功能不全者;(2)既往有脑部疾病史;(3)先天性肢体畸形或既往严重躯体疾病影响本次评估结果者;(4)智力、意识、言语障碍等无法配合检查者;(5)合并帕金森病、多发性硬化等其他已知可能导致认知损害疾病者;(6)接受重组人组织型纤溶酶原激活物治疗。根据颅内微出血情况将患者分为无微出血组(n=98)、少量微出血组(n=71)和多发微出血组(n=31)。200例ACI患者中男性103例、女性97例,年龄45~85(62.12±4.58)岁,汉族108例,维吾尔族92例。患者及家属对本研究知情同意并签署同意书,本研究经医院伦理委员会批准。
1.2 研究方法
1.2.1 收集资料:收集患者年龄、性别、民族、不良嗜好(吸烟史、饮酒史)、既往史(高血压、糖尿病、冠心病、脑卒中、房颤等病史)、抗血小板药物使用史、脑血管疾病家族史。其中以连续或累计吸烟6个月及以上定义为吸烟史;以连续1年及以上每天饮白酒1两及以上或啤酒1瓶及以上定义为饮酒史;以未服用降压药物时收缩压≥140 mmHg和(或)舒张压≥90 mmHg或既往确诊为高血压定义为高血压史;以空腹血糖≥7.0 mmol/L或餐后2 h血糖≥11.1 mmol/L或糖化血红蛋白≥6.5%或随机血糖≥11.1 mmol/L或既往确诊为糖尿病定义为糖尿病史;以既往连续口服抗血小板药物定义为抗血小板药物使用史。
1.2.2 头颅MRI检查:所有患者于治疗前均行头颅MRI检查,仪器为美国GE公司生产的1.5T磁共振仪(Signa EXCITE HD)。磁敏感加权成像序列扫描参数为,重复时间=58 ms,回波时间=4.5 ms,视野=24 cm×24 cm,矩阵=256×256,层厚=2.0 mm。图片分析由两名有5年以上临床经验的影像学医师完成,意见不统一时由第3名医师与两名医师共同诊断,投票确定最终结果。脑微出血数目为0诊断为无微出血,脑微出血数目为1~4个诊断为少量微出血,脑微出血数目≥5个诊断为多发微出血[6]。
1.2.3 神经和认知功能评估:于发病后2周和6个月分别利用美国国立卫生研究院卒中量表(National Institute of Health Stroke Scale,NIHSS)[7]评估患者神经功能缺损程度,总分为0~42分,分数越高提示神经功能缺损越严重;利用简易智力状态检查量表(Mini-Mental State Examination,MMSE)[8]评估患者认知功能缺损程度,总分为0~30分,分数越低提示认知功能缺损越严重,文盲者MMSE得分≤17分提示认知功能障碍,小学文化者MMSE得分≤20分提示认知功能障碍,初中及以上者MMSE得分≤24分提示认知功能障碍。由同一名临床经验丰富的本科室医生进行量表评估。
1.2.4 神经功能恢复情况:发病后6个月利用改良Rankin量表(modified Rankin Scale,mRS)[9]评估患者神经功能恢复情况,总分为0~5分,分数越高提示神经功能恢复越好。
1.2.5 随访:每3个月电话随访一次,记录出血性转化及脑梗死再发情况。
1.3 统计学分析 采用SPSS 20.0软件进行统计学分析。计量资料以(x±s)表示,组间比较采用单因素方差分析,两两比较采用SNK-q检验;计数资料以例数(百分比)表示,组间比较采用χ2检验。以P<0.05为差异具有统计学意义。
2 结 果
2.1 200例ACI患者脑微出血分布情况及3组患者临床特征 200例ACI患者中,无脑微出血病灶98例(49.00%),有脑微出血病灶102例(51.00%)。有脑微出血病灶患者中,共检出625个脑微出血灶,其中脑叶-皮层下区253个(40.48%)、基底节区232个(37.12%)、幕下区140个(22.40%)。图1为有脑微出血病灶的ACI患者的头颅MRI图像。3组患者年龄、性别、民族、吸烟史、饮酒史、糖尿病史、房颤史、脑血管疾病家族史和抗血小板药物使用史比较,差异均无统计学意义(均P>0.05),但多发微出血组的高血压史、冠心病史和脑卒中史患者比例高于无微出血组及少量微出血组(均P<0.05),见表1。

图1 合并脑微出血的ACI患者的MRI表现

表1 3组患者临床特征的比较
2.2 3组患者神经和认知功能的比较 发病后6个月,3组患者NIHSS评分低于发病后2周,MMSE评分高于发病后2周(均P<0.05),且无微出血组、少量微出血组、多发微出血组NIHSS评分依次升高;发病后2周及6个月,无微出血组、少量微出血组、多发微出血组MMSE评分依次降低(均P<0.05)。见表2。
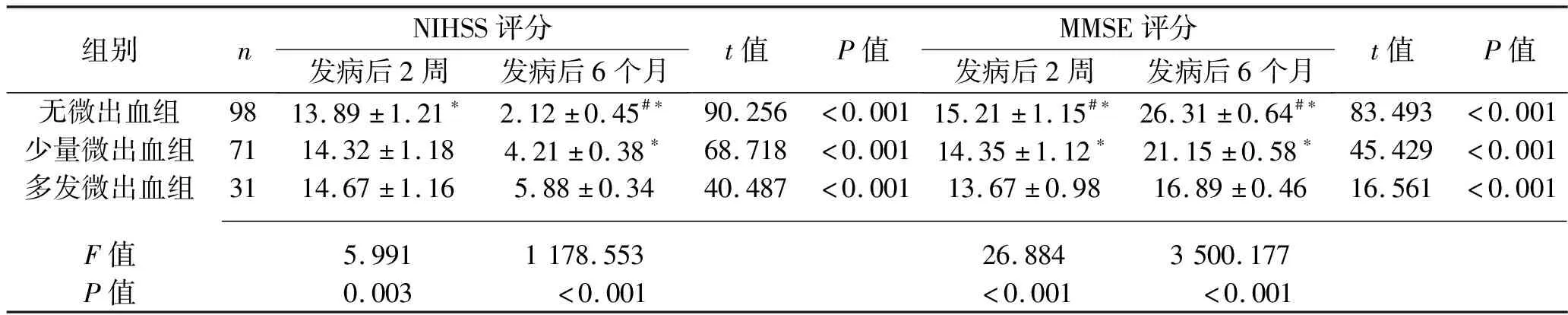
表2 3组患者神经和认知功能的比较(x±s,分)
2.3 3组患者神经功能恢复情况 发病后6个月无微出血组、少量微出血组、多发微出血组MRS评分分别为(4.12±0.48)分、(3.62±0.52)分、(2.73±0.54)分,3组间差异有统计学意义(F=92.090,P<0.001),呈依次降低的趋势(均P<0.05)。
2.4 3组患者随访期间出血性转化及脑梗死再发情况 随访截至2020年6月,无脱落和死亡病例,随访率100%。随访期间,无微出血组有5例(5.10%)出现出血性转化,无脑梗死再发病例;少量微出血组有8例(11.27%)出现出血性转化,有2例(2.82%)脑梗死再发;多发微出血组有12例(38.71%)出现出血性转化,有1例(3.23%)脑梗死再发。3组患者脑梗死再发率差异无统计学意义(χ2=2.951,P=0.229);多发微出血组出血性转化发生率高于无微出血组和少量微出血组(χ2=13.245,P=0.002)。
3 讨 论
目前认为脑微出血与脑梗死、脑出血、阿尔茨海默病及脑淀粉样血管病等多种脑血管疾病有关[10]。研究显示,脑微出血可作为脑出血再发,以及脑梗死患者溶栓、抗血小板及抗凝治疗后继发出血的重要预测指标[11]。传统MRI扫描技术在诊断脑出血时敏感度低于CT,但MRI中磁敏感加权成像序列对脑出血甚至是脑微小出血后残余痕迹敏感度较高[12]。以往研究显示,ACI患者中,脑微出血发生率为35%~70%[13]。本研究的200例ACI患者中,脑微出血发生率为51.00%,与以往研究结果[13]相似。有脑微出血病灶的患者共检出625个脑微出血灶,主要分布于脑叶-皮层下、基底节区、幕下区。同时本研究结果显示,多发微出血组患者高血压史、冠心病史和脑卒中史比例高于其他两组(P<0.05),多发微出血可能与长期高血压以及心脏病变导致的小动脉硬化有关[14]。
ACI的治疗以溶栓和抗凝治疗为主。出血性转化为ACI患者的自然转归过程之一,也可发生于溶栓和抗凝治疗后。研究显示,出血性转化是ACI患者溶栓治疗的并发症之一,同时也是导致患者病情恶化和死亡的重要原因[15]。ACI多见于中老年人,因此类人群受到血管硬化、脆性增加、狭窄、粥样硬化改变以及血压反复波动等因素影响,具有高发病率和复发率的特点[16]。有研究表明,脑微出血与出血倾向有关,且脑内出血部位大多为脑微出血分布较聚集部位[17-18]。本研究结果显示,3组患者脑梗死再发率差异无统计学意义,但多发微出血组出血性转化的发生率高于其他两组(P<0.05),提示脑微出血的存在可增加ACI患者出血性转化发生的风险。
ACI患者的症状与发病部位有关,可伴有不同程度神经和认知功能障碍。但近年来研究显示,脑微出血与认知功能障碍有关,是导致认知功能障碍的重要因素之一[19-21]。高忠明等[22]研究发现,伴脑微出血的ACI患者溶栓治疗3个月后MRS评分低于不伴脑微出血的患者。本研究结果显示,发病后6个月3组患者NIHSS评分低于发病后2周,MMSE评分高于发病后2周,提示溶栓治疗可改善患者神经和认知功能,与以往研究结果[22-25]相似。但发病后6个月,脑微出血数目越多的患者NIHSS评分越高,MMSE评分和MRS评分越低,提示脑微出血可能是影响ACI患者预后的危险因素之一,其可能增加出血风险而影响溶栓疗效,从而导致脑神经和认知功能障碍。因此,溶栓治疗时应注意患者有无脑微出血,并做好相应预防措施以减少因脑微出血导致的出血风险。
综上所述,ACI患者脑微出血发生率较高,脑微出血以脑叶-皮层下部位多见,脑微出血与ACI患者神经和认知功能损伤密切相关,脑微出血越严重越易发生出血性转化,且神经和认知功能恢复越差。

