miR-25通过靶向BCL2L11在脓毒症致AKI细胞模型中发挥保护性作用
吴 斌,王美堂
脓毒症是由感染因素引起的最致命的全身性炎症综合征,可引起休克、多器官功能障碍综合征,甚至死亡[1]。急性肾损伤(acute kidney injury,AKI)是脓毒症最严重的并发症之一[2]。如果能在AKI早期进行干预,可显著降低脓毒症患者的病死率[3]。因此,研究脓毒症致AKI的病理生理改变机制,寻求有效治疗手段是一个亟待研究的课题。
miRNAs是一类非编码RNA,通过抑制翻译或降解mRNA来负调控基因表达[4]。目前关于miRNAs在脓毒症肾损伤中的研究较少[5]。已有研究发现miR-204可通过抑制核因子 κB(nuclear factor kappa-B,NF-κB)途径活化,抑制脂多糖(lipopolysaccharide,LPS)诱导的RMCs细胞损伤[6],miR-107则可通过诱导TNF-α分泌,加重肾小管上皮细胞损伤[7]。上述研究提示miRNAs在脓毒症致AKI的发生、发展中起着重要调节作用。先前研究发现miR-25在脓毒症患者体内表达下调[8]。Yao等[9]发现miR-25通过靶向PTEN抑制脓毒症诱导的心肌细胞凋亡。然而,miR-25是否脓毒症致AKI的发病机制尚不清楚。因此,本研究通过建立LPS诱导肾小管上皮细胞(HK-2)损伤的细胞模型体外模拟AKI研究miR-25的保护性作用,旨在为临床治疗脓毒症致AKI提供新的治疗思路。
1 材料与方法
1.1 材料与试剂 HK-2细胞购自上海富衡生物科技有限公司。胎牛血清、青霉素-链霉素、Dulbecco改良Eagle培养基(DMEM)、Lipofectamine 3000转染试剂及TaqMan-MicroRNA逆转录试剂盒均购自美国Invitrogen公司。LPS购自美国Sigma-Aldrich公司。MiR-25模拟物(miR-25 mimic)、miR-25抑制剂(miR-25 inhibitor)和阴性对照物(negativecontrol,NC)购自上海吉凯基因医学科技股份有限公司,过表达BCL2L11质粒(pc-BCL2L11)及空载质粒(vector)均由上海生工生物工程有限公司负责构建。细胞计数试剂盒(Cell counting kit-8,CCK-8)购自日本Dojindo公司。RNA提取试剂、逆转录试剂盒及SYBR荧光定量试剂盒均购自日本Takara公司。荧光素酶报告基因分析系统购自美国Promega公司。蛋白强裂解液、发光显影液、抗体稀释液购自上海生工生物工程有限公司。一抗购自美国Abcam公司,包括:B淋巴细胞瘤-2(B-cell lymphoma-2,BCL-2,ab32124,1:1000)、BCL-2相 关 的X基 因 (BCL2-Associated X,Bax,ab53154,1∶1000)、 剪切的半胱氨酸蛋白酶-3(cleaved Caspase-3,ab32042,1∶1000)、cleaved Caspase-9(ab2324,1:1000)和 β-肌动蛋白(β-actin,ab8226,1:2000)。BCL-2样蛋白11(BCL-2-likeprotein 11,BCL2L11,#374358,1∶1000)抗体购自美国Santa Cruz公司。
1.2 细胞培育与处理 使用含10%胎牛血清、1%青霉素(100 U/ml)和链霉素(100μg/ml)的DMEM培养基,将细胞置于37°C,相对湿度,含5%CO2的培养箱进中行细胞培养。 用不同浓度(0、1、2、4、6、8和10μg/ml)LPS处理HK-2细胞12 h摸索LPS诱导AKI细胞模型的浓度。
1.3 细胞转染 根据说明书,使用Lipofectamine 3000试剂分别将miR-25 mimic、miR-25 inhibitor、NC、pc-BCL2L11及Vector转染至HK-2细胞中。转染72 h后,收集细胞进行后续实验。1.4 CCK-8检测细胞活性变化 当HK-2细胞(104个细胞/孔)分别完成pc-BCL2L11、miR-25 mimic、miR-25 inhibitor转染和LPS刺激时,利用CCK-8评估细胞活力。将10μl CCK-8加入至细胞细胞液中并继续培养3 h,后用分光光度计测量450 nm处的吸光度。
1.5 实时定量PCR(qRT PCR)检测细胞mRNA表达水平 根据试剂说明,使用Trizol试剂提取HK-2细胞中的总RNA。使用分光光度计定量mRNA浓度后,将mRNA逆转录合成cDNA,后用SYBR试剂盒进行PCR扩增检测荧光水平,使用β-actin作为内参基因,2-ΔΔCT方法计算进行相对表达量的计算。采用TaqMan-MicroRNA逆转录试剂盒和TaqManmiRNA分析对miRNA表达进行定量,U6被用作内参基因进行计算。引物序列见表1。
1.6 荧光素酶报告基因分析 根据说明书指导,将BCL2L11基因的野生型(wild-type,wt)和突变型(mutant-type,mut)的3'UTR片段克隆到pGL3荧光素酶报告载体中。将HK-2细胞(2×104细胞/ml)接种于6孔培养板上,次日用Lipofectamine(Invitrogen)将报告质粒和miR-25 mimic共转染至细胞。采用双荧光素酶检测试剂盒检测转染72 h后的荧光素酶活性。
1.7 酶联免疫吸附试验(ELISA)检测炎症因子水平将处理后的HK-2细胞上清液进行定量,根据说明书指导检测TNF-α、IL-1β和IL-6水平。
1.8 蛋白印迹法(Western blot)检测细胞蛋白表达水平 收集HK-2细胞沉淀,并用RIPA蛋白裂解液(已添加蛋白酶抑制剂)进行溶解。将提取的蛋白质通过SDS-PAGE凝胶电泳进行分离,后转移至PVDF膜上。室温下,在5%脱脂牛奶中封闭1 h后,将膜与一抗在4℃下培养过夜。次日洗涤后,用与HRP结合的相应二抗在室温下孵育膜2 h,最后用增强化学发光溶液在成像系统中进行荧光定量。
1.9 统计学方法 所有实验至少进行3次,数据用平均值(mean)±标准差(SD)表示。应用SPSS 22.0软件(美国,SPSS)进行统计分析,两组或多组间的比较采用Student t检验或单因素方差分析,P<0.05为差异有统计学意义。

表1 引物序列
2 结果
2.1 miR-25抑制LPS诱导的HK-2细胞凋亡和增殖阻滞 用0、1、2、4、6、8和10μg/ml LPS处理HK-2细胞可使其细胞活力水平在LPS处理下同样以剂量依赖性方式降低(P<0.05);不同浓度LPS处理HK-2细胞还可显著诱导细胞表达miR-25呈剂量依赖性降低(P<0.05)。见表2。
细胞转染miR-25 mimic后,细胞表达miR-25水平均明显升高(P<0.05),相反转染miR-25 inhibitor后,miR-25水平均显著下降(P<0.05),从而验证了miR-25 mimic及inhibitor的有效性;与LPS诱导损伤的细胞相比,过表达miR-25的HK-2细胞经LPS处理后,细胞活性显著增加,而转染miR-25 inhibitor的细胞呈相反表现。见表3。
Western blot结果(表4)示,与LPS诱导损伤组细胞相比,过表达miR-25的细胞表达促凋亡蛋白Bax、cleaved Caspase-3和cleaved Caspase-3均显著降低(P<0.05),而抑制凋亡蛋白BCL-2表达显著增高(P<0.05),转录miR-25 inhibitor则有相反的变化(P<0.05)。
2.2 miR-25减轻LPS对HK-2细胞的炎症损伤HK-2细胞过表达miR-25可逆转LPS刺激HK-2细胞后IL-6、IL-1β 和TNF-α 浓度的增加(P<0.05),而当细胞低表达miR-25时,则具有相反的效果(P<0.05)。 见表5。
2.3 过表达BCL2L11逆转miR-25介导的对LPS诱导HK-2细胞炎症和凋亡的抑制作用 使用TargetScan软件进行预测,发现BCL2L11的3'UTR序列与miR-25互补(图1)。为验证此观点,检测荧光素酶活性,发现当细胞转染miR-25模拟物可显著降低野生型(Wt)BCL2L11 3'UTR的荧光素酶活性(P<0.05),而突变型(Mut)3'UTR的荧光素酶活性(P>0.05),见表6。另外,当细胞过表达或者低表达miR-25时,BCL211L蛋白水平会随之降低或者升高(P<0.05),见表7。通过将BCL2L11过表达质粒和miR-25 mimic转染到这些细胞中,Western blot结果(表8)示细胞转染BCL2L11后该蛋白表达显著增加(P<0.05),提示质粒有效性。细胞过表达BCL2L11可显著逆转miR-25对LPS诱导的HK-2细胞凋亡和炎症的影响(P<0.05)。见表9。

图1 使用TargetScan预测miR-25和BCL2L11之间的结合位点
3 讨论
本研究经细胞实验发现,miR-25过表达可靶向BCL2L11,降低其表达水平,并可抑制凋亡和炎症反应的发生,提示miR-25可能参与了脓毒症致AKI的进展。
表2 不同LPS处理浓度对K-2细胞活性及mi R-25表达水平的影响(? s)

表2 不同LPS处理浓度对K-2细胞活性及mi R-25表达水平的影响(? s)
注:以不同浓度(0、1、2、4、6、8和10 μg/ml)LPS处理HK-2细胞12 h。与对照组(0 μg/ml)比较,①P < 0.05
组别 0 1 2 4 6 8 10细胞活性(%) 99.67±5.01 77.00±3.01 67.70±2.46 60.87±2.50 54.67±3.07 42.63±4.26 miR-25表达水平 1.12±0.11 0.92±0.06 0.77±0.06 0.64±0.06 0.51±0.07 0.34±0.10 0.16±0.06
表3 miR-25与LPS共同处理对HK-2细胞活性的影响(? s )

表3 miR-25与LPS共同处理对HK-2细胞活性的影响(? s )
注:与对照组(Control)或NC组比较,①P < 0.05
组别 Control NC mimic inhibitor Control NC mimic inhibitor未处理 LPS(8 μg/ml)miR-25水平 0.99±0.06 1.01±0.06 0.36±0.08 0.73±0.07 0.70±0.10 3.86±0.55 0.19±0.08 细胞活性(%) 98.17±6.17 96.67±4.83 99.43±4.51 99.27±5.18 53.30±3.63 50.60±1.97 73.90±5.82 26.27±4.06
表4 miR-25与LPS共同处理对HK-2细胞表达蛋白的影响(? s)

表4 miR-25与LPS共同处理对HK-2细胞表达蛋白的影响(? s)
注:与Control组比较,①P < 0.05;与LPS+NC组比较,②P < 0.05
组别 Control LPS LPS+NC LPS+mimic LPS+inhibitor 0.17±0.04 Bax/β-actin 0.16±0.05 0.93±0.07 1.01±0.10 0.23±0.07 1.08±0.16 Cleaved Caspase-3/β-actin 0.19±0.05 1.06±0.15 1.08±0.15 0.17±0.12 1.01±0.19 Cleaved Caspase-0/β-actin 0.20±0.10 0.96±0.13 0.97±0.13 0.23±0.10 0.98±0.26
表5 各组细胞炎症因子水平比较(? s )

表5 各组细胞炎症因子水平比较(? s )
注:与Control组比较,①P < 0.05;与LPS+NC组比较,②P < 0.05
组别 IL-6 (pg/ml) IL-1β( pg/ml) TNF-α(pg/ml) 475.00±35.76 893.67±85.62 LPS+NC 611.67±22.55 465.00±61.88 905.67±74.84 LPS+miR-25 mimic 271.00±38.74 145.67±14.01 303.33±26.58 LPS+miR-25 inhibitor 813.00±35.59 697.67±34.56 1110.67±95.51
表6 荧光素酶报告基因验证结合靶点(? s )

表6 荧光素酶报告基因验证结合靶点(? s )
注:与NC组比较,①P < 0.05
组别 NC mimic NC mimic荧光素酶活性 1.05±0.06 1.00±0.07 Wt-BCL2L11 Mut- BCL2L11
表7 miR-25对细胞表达 BCL2L11蛋白水平的影响(? s)

表7 miR-25对细胞表达 BCL2L11蛋白水平的影响(? s)
注:与Control组比较,①P < 0.05,与LPS+NC组比较,②P < 0.05
组别 Control LPS LPS+NC LPS+mimic LPS+inhibitor BCL2L11蛋白水平 0.17±0.06 1.09±0.12 0.38±0.06 1.16±0.06
表9 miR-25与BCL2L11共表达对HK-2细胞活性、炎症因子释放及蛋白表达水平的作用(? s)
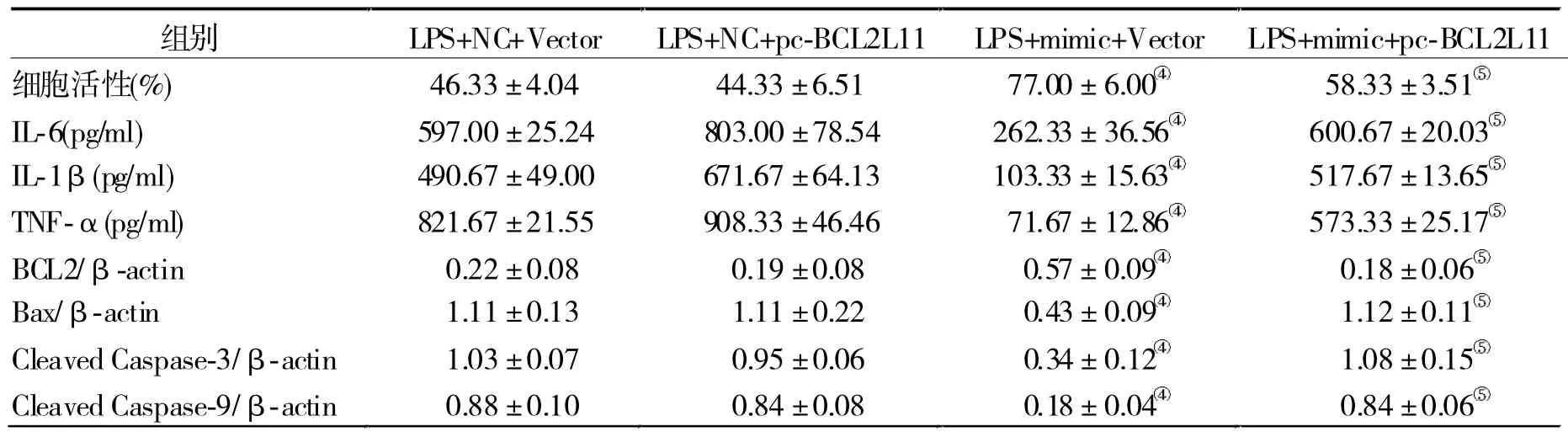
表9 miR-25与BCL2L11共表达对HK-2细胞活性、炎症因子释放及蛋白表达水平的作用(? s)
注:与LPS+NC+Vector组比较,④P < 0.05;与LPS+miR-25 mimic+Vector组比较,⑤P < 0.05
组别 LPS+NC+Vector LPS+NC+pc-BCL2L11 LPS+mimic+Vector LPS+mimic+pc-BCL2L11
表8 BCL2L 11质粒转染有效性验证(? s)

表8 BCL2L 11质粒转染有效性验证(? s)
注:与对照组比较,①P < 0.05
组别 Control Vector pc-BCL2L11 BCL2L11表达水平 0.34±0.09 0.33±0.08
凋亡是一种程序性细胞死亡过程,参与了败血症致AKI的发生[10]。在本研究中,发现当HK-2细胞miR-25过表达后,LPS刺激细胞表达凋亡相关蛋白Bax、Caspase 3和Caspase 9减少,而BCL-2增加。因此,本研究推测miR-25过表达可能通过抑制内源性凋亡途径,对脓毒症诱导的AKI起到保护作用。促炎症反应在脓毒症致AKI的发病机制中占重要地位。本研究发现LPS刺激HK-2细胞可使其表达促炎细胞因子TNF-α、IL-6和IL-1β的水平显著升高,而细胞过表达miR-25时,可发挥其抗炎特性,降低上述4种细胞因子的水平。
越来越多的研究通过miRNAs可靶向调节目的基因发挥[11]。本研究证明miR-25可负调控BCL2L11表达基于BCL2L11抑制的研究发现,过表达BCL2L11可逆转miR-25过表达对LPS诱导HK-2损伤的影响,提示miR-25对LPS诱导HK-2细胞损伤的影响是通过调节BCL2L11实现的。已知BCL2L11属于BH3家族,是细胞凋亡信号通路中的关键调节因子[12]。既往尚无研究报道BCL2L11与脓毒症致AKI的关系,因此本研究将为未来进一步探讨BCL2L11的作用提供理论基础。
综上所述,本研究发现,在LPS诱导HK-2损伤时,miR-25呈低表达水平。过表达miR-25可通过靶向抑制BCL2L11,减少炎症因子产生和抑制凋亡反应的发生,从而减轻LPS诱导的HK-2细胞损伤。

