shRNA靶向血管生成素2基因沉默联合奥沙利铂对子宫内膜癌生长抑制作用的研究
周凌,孙慧婷,杨思慧,荆秀娟,周怀君
(1.南京医科大学 鼓楼临床医学院,江苏 南京 210008;2.常州市第二人民医院 生殖中心,江苏 常州 213003;3.南京中医药大学 中西医结合鼓楼临床医学院,江苏 南京 210008;4.南京医科大学鼓楼临床医学院 妇产科,江苏 南京 210008)
子宫内膜癌(endometrial cancer,EC)是最常见的妇科癌症,也是世界四大女性癌症之一。2020年估计美国有65 620名妇女被诊断为EC,约有12 590名妇女将死于这种疾病[1]。据2015年国家癌症中心统计,我国EC发病率为33/10万,死亡率为22/10万[2]。尽管子宫内膜样肿瘤预后良好,但高达20%的患者会复发。对于浆液性肿瘤,约50%的患者病情恶化或不能通过一线治疗治愈[3]。目前EC的治疗原则以手术为主,辅以放疗、化疗、内分泌治疗及生物治疗等。内分泌治疗和化疗是晚期、复发或转移性EC患者最主要治疗手段,然而其有效率较低,患者的中位生存时间仍短于1年[4]。治疗失败的原因就是耐药,耐药的产生来自两方面的因素:内因是各种形式的肿瘤异质性,癌症基因组不稳定性;外因则是药物的选择压力[5]。目前还做不到个体化的精准治疗,合适的综合性治疗也能使癌症患者生存获益,如药物的联合应用,但是盲目地将不同的治疗方法相叠加并不一定能得到1+1>2的效果[6]。近年来,化疗+免疫检查点抑制剂(immunecheckpoint inhibitor,ICI)+抗血管生成治疗为肿瘤微环境的重塑提供了新的方向。这种协同作用 在对IMpower 150 的研究中得到了印证,化疗+抗血管生成治疗+ICI 方案可使肝转移的晚期非鳞状非小细胞肺癌患者的生存期显著延长[7]。但是ICI所显示出的较强毒副作用使其使用受到限制。而化疗联合抗血管生成治疗因其毒副作用较小又能延长生存期,所以在各种晚期和复发性恶性肿瘤治疗中得到广泛使用。化疗联合抗血管生成治疗的效果强弱与药物的选择及给药手段密切相关。
铂类药物作为一类经典的抗癌药物,在临床化疗上具有举足轻重的地位,也是治疗EC常用的药物,经过一代顺铂、二代卡铂的改良研制出以奥沙利铂为代表的三代铂类药物。奥沙利铂通过与核DNA形成交叉联结干扰DNA 复制和转录系统而发挥抗癌活性[8]。与其他铂化合物相比奥沙利铂因耐受性更好、毒副作用更小而得到广泛应用,但它仍然存在一些毒副作用,如神经毒性、血液和胃肠道毒性、中性粒细胞减少、恶心和呕吐等,这些无疑限制了其可用剂量范围[9]。目前,采用联合用药对抗化疗药物的毒性及耐药性是一种较好的方法。我们的前期实验证实,奥沙利铂具有抑制EC裸鼠移植瘤生长的作用,又能抑制肿瘤组织中血管生成素2(angiopoietin 2,Ang2)的表达[10]。这提示我们奥沙利铂与抗Ang2联合应用可能对抗EC起到协同作用。Ang/Tie 轴是介导血管重塑和新生血管成熟过程的信号通路[11]。生理状态下,血管旁支持细胞如周细胞、血管平滑肌细胞分泌的Ang1可与Tie2结合,从而调节内皮细胞之间、内皮细胞与血管外膜细胞之间的相互作用,促进血管成熟,并维持血管正常的有序结构。但肿瘤细胞分泌Ang2,它可与Ang1 竞争性结合Tie2,而Ang2与Tie2 的结合并不能引起后续信号通路的正常激活[12-14],因此,肿瘤新生血管具有结构排列紊乱、血管壁不完整、血管壁不连续的特点[15],从而进一步加重局部乏氧状态,并严重影响抗肿瘤药物的投递。肿瘤内部处于高酸、低氧微环境,异常的血管结构也为肿瘤细胞的侵袭和转移提供了途径。靶向Ang/Tie 轴的药物能够促进肿瘤血管正常化,在防止肿瘤转移的同时能够与化疗药物或ICI联合使用,增强药物的递送效率。促进肿瘤血管正常化的抗血管生成疗法与其他疗法的联合是治疗肿瘤的新策略[12]。
RNA干扰,特别是小干扰RNA(siRNA),提供了一种沉默特定基因来控制肿瘤血管生长的替代方法。虽然siRNA治疗在体内降解快、内化差,但纳米颗粒可以作为其无毒、高效的传递载体,甚至可以引入多种治疗药物的联合传递[16-18]。本实验小组采用shRNA靶向 Ang2/Tie2 轴的抗血管生成疗法促进肿瘤血管的正常化,研究shRNA靶向Ang2基因沉默联合奥沙利铂对子宫内膜癌EC生长的抑制作用。
1 材料与方法
1.1 细胞培养和奥沙利铂使用剂量
人类EC Ishikawa细胞由北京大学人民医院魏丽慧教授提供。细胞在加入10%胎牛血清和100 U·ml-1青霉素及100 U·ml-1链霉素的DMEM 培养基[(赛默飞世尔科技(中国)有限公司]中培养。奥沙利铂购自江苏恒瑞医药股份有限公司(批号:09111511)。使用奥沙利铂处理细胞时,奥沙利铂在细胞培养液中终浓度为10 mg·ml-1,细胞在37 ℃、5%CO2的环境中培养24 h或48 h[19]。
1.2 实验分组
体外细胞和在体动物实验均随机分为5组,分别为生理盐水组、奥沙利铂组、空载质粒组、Ang2敲低组、Ang2敲低联合奥沙利铂组。其中生理盐水组、奥沙利铂组的干预因素是生理盐水,规避奥沙利铂溶剂带来的干扰;空载质粒组、Ang2敲低组、Ang2敲低联合奥沙利铂组干预因素是PBS和质粒,设立空载质粒组规避PBS和质粒给实验组带来的干扰;Ang2敲低联合奥沙利铂组既有Ang2的敲低又有奥沙利铂双重因素的干预。
1.3 Ang2 shRNA设计和构建质粒稳转细胞系
由Genepharma(上海吉玛制药技术有限公司)设计Ang2特异性shRNA,并合成携带Ang2 shRNA的pRNAT-CMV3.2-Neo及阴性对照pRNAT-CMV3.2-Neo-neg质粒。在6孔细胞培养板中接种293T细胞,在细胞融合度达50%时进行转染。使用Opti-MEM稀释lipofectamineTM3000(美国赛默飞世尔科技公司),同时使用Opti-MEM稀释P3000TM,并将Ang2-shRNA的pRNAT-CMV3.2-Neo质粒、PSPXA2质粒及PMD2G质粒按照4∶3∶1的比例混匀加入稀释好的P3000TM中,按照同样方法将阴性对照pRNAT-CMV3.2-Neo-neg质粒与PSPXA2质粒及PMD2G质粒混匀后加入稀释好的P3000TM中。将稀释后的lipofectamineTM3000分别与上述混合物共同孵育15 min,加入293T细胞中,37 ℃培养24、48 h后收取细胞上清作为病毒液,将收取的病毒液加入融合度达30%的Ishikawa细胞中,37 ℃培养72 h后加入嘌呤霉素筛选稳转成功的Ishikawa细胞。
1.4 qRT-PCR分析Ang2 mRNA表达
使用Trizol试剂(南京诺唯赞生物科技股份有限公司)制备细胞总RNA,用HiScript Ⅱ Q Select RT SuperMix for qPCR试剂盒(南京诺唯赞生物科技股份有限公司)将总RNA逆转录成cDNA。将SYBR qPCR Master Mix(南京诺唯赞生物科技股份有限公司)、cDNA和引物按比例混匀。使用QuantStudio 6 Flex(美国应用生物系统公司)进行检测。将GAPDH管家基因作为内参基因,消除因提取的cDNA浓度不同产生的差异。Ang2正向引物5′-AACATCCCAGTCCACCTGAG-3 ′,反向引物5′-GGTCTTGCTTTGGTCCGTTA-3′;GAPDH正向引物5′-AAGGTCGGAGTCAACGGATTT-3′,反向引物5′-ACCAGAGTTAAAAGCCCCTG-3′。cDNA按照按试剂盒说明书进行扩增,PCR循环条件为95 ℃ 30 s预变性;95 ℃ 5 s、60 ℃ 30 s,40个反应循环;溶解曲线95 ℃ 15 s、60 ℃ 60 s、95 ℃ 15 s。每组设置3个复孔,每项实验重复3次。
1.5 蛋白质印迹法检测Ang2蛋白相对含量
收集细胞或组织,使用RIPA(上海碧云天生物技术有限公司)裂解细胞或组织。按比例加入SDS-PAGE蛋白上样缓冲液(上海碧云天生物技术有限公司),沸水浴10 min使蛋白充分变性。将处理好的蛋白样品加入配好的10%SDS聚丙烯酰胺凝胶孔内,电泳30 mV 20 min、50 mV 60 min,转膜250 mV 120 min。将PMDF膜用5%脱脂牛奶封闭1 h。用鼠标单克隆抗体Ang2(MM0020-1F29,ab56301)[艾博抗(上海)贸易有限公司]和鼠标单克隆抗体GAPDH分别在4 ℃过夜孵育。用抗鼠辣根peroxidase-conjugated二抗[艾博抗(上海)贸易有限公司]室温孵育2 h。最后涂匀Immobilon Western 曝光液(美国默克密理博公司),并用Tanon全自动化学发光图像分析系统进行显影。通过ImageJ对数字化自动图像进行密度分析。
1.6 Ishikawa细胞凋亡实验
将各组细胞用不含EDTA的胰酶消化收集,PBS洗涤细胞两次,收集5×105个细胞,使用annexin V-PE凋亡检测试剂盒(江苏凯基生物技术股份有限公司)行凋亡检测,用Buffer轻柔垂悬细胞,加入1 μl annexin V-PE进行染色,室温避光孵育15 min。采用流式细胞仪(FACSCalibur,Becton Dickinson)检测凋亡水平,并使用BD FACSDiva软件对结果进行分析。实验重复3次。
1.7 Ishikawa细胞侵袭实验
用基质胶[碧迪医疗器械(上海)有限公司] 1∶10包被24孔板的小室(corning,America)底部,放置于37 ℃培养箱中1 h使胶凝固。将Ishikawa细胞用无血清培养基垂悬,按1×105个细胞·孔-1转移上室中。将含10%胎牛血清的DMEM加入下室作为趋化因子诱导细胞运动。培养48 h后用棉签轻轻擦去小室上层表面的细胞,在下室加入4%多聚甲醛固定细胞15 min,0.5%结晶紫染色。在放大200倍的倒置显微镜下随机选取5个视野进行细胞计数。实验重复3次。
1.8 动物实验
本研究经南京大学附属南京鼓楼医院伦理委员会批准。40只4周龄雌性BALB/c裸小鼠(北京维通利华实验动物技术有限公司)经南京鼓楼医院动物护理与使用委员会批准使用,圈养在专门的SPF设施中。小鼠随机分为生理盐水组、奥沙利铂组、空载质粒组、Ang2敲低组、Ang2敲低联合奥沙利铂组,每组8只。用PBS按照1×107个细胞、0.2 ml·小鼠-1,用30 G针头和1 ml注射器在动物背部皮下注射相应细胞,每天观察。当肿瘤生长14 d时,生理盐水组给予等同治疗组剂量的生理盐水腹腔注射,奥沙利铂和Ang2敲低联合奥沙利铂治疗组给予奥沙利铂(根据人小鼠体表面积换算方法,0.25 mg·m-2) 腹腔注射[20-21],每周注射1次,连续5次。每两天测量1次肿瘤体积(体积=长×宽×宽×0.52),观察肿瘤生长情况。所有小鼠在首次注射后第28天处死。收集裸鼠,选择各组裸鼠代表拍照,然后将肿瘤剖出拍照,测量肿瘤体积,计算抑瘤率[抑瘤率=(对照组平均体积-实验组平均体积)/对照组平均体积×100%],抑瘤率≥40%并经统计学处理P<0.05为有效。然后将一半肿瘤组织立即放入液氮中进行RT-PCR和蛋白质印迹法检测 Ang2的表达情况;另一半放入4%多聚甲醛中进行免疫组织化学检测,分析肿瘤血管分布情况。
1.9 裸鼠移植瘤组织微血管密度检测
采用免疫组织化学方法检测移植瘤组织vWF蛋白来标记肿瘤血管。制作肿瘤组织石蜡切片并作常规处理至抗原修复,5% BSA 封闭20 min,vWF、一抗 [艾博抗(上海)贸易有限公司] 4 ℃过夜孵育,PBS冲洗3次后滴加生物素标记的二抗(江苏盈科生物制药有限公司),37 ℃ 孵育30 min后DAB试剂(江苏盈科生物制药有限公司)显色,苏木素复染后封片。针对vWF抗体染色行微血管密度(MVD) 计数,先在低倍镜下(40倍和100倍)扫描切片,选择2~3个染色密度较高的区域作为“热点”区域,然后使用尼康E-400显微镜在200倍镜下计数视野内被染色的血管数。MVD定义为每高倍镜下的血管数(HPF,×200),取8个肿瘤标本的平均值[22]。
1.10 统计学处理

2 结 果
2.1 各组Ishikawa细胞中Ang2 mRNA和蛋白的表达情况
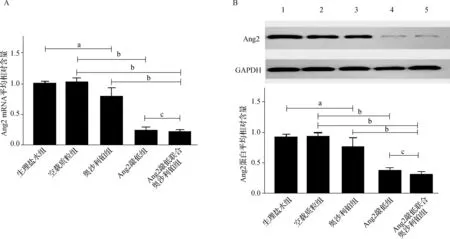
a P<0.05;b P<0.001;c P>0.05A.RT-PCR检测结果;B.蛋白质印迹法检测结果图1 各组Ishikawa细胞中Ang2 mRNA和蛋白的表达情况
Ang2敲低组、Ang2敲低联合奥沙利铂组与空载质粒组相比,Ang2 mRNA含量分别降低了76.54%、80.24%(均P<0.001),Ang2蛋白表达量分别降低60.79%、65.09%(均P<0.001);奥沙利铂组与生理盐水组比较,Ang2 mRNA和蛋白表达量分别降低了21.8%和22.9%(均P<0.05);Ang2敲低联合奥沙利铂组与奥沙利铂组比较,Ang2 mRNA和蛋白表达量均降低(均P<0.001),但与Ang2敲低组比较无明显降低(P>0.05)。
2.2 各组Ishikawa细胞凋亡率和侵袭数量检测
各组Ishikawa细胞凋亡率分别为:生理盐水组(8.56±1.23)%,空载质粒组(7.90±2.32)%,奥沙利铂组(52.13±4.14)%,Ang2敲低组(35.93±4.96)%,Ang2敲低联合奥沙利铂组(61.55±5.03)%。奥沙利铂组与生理盐水组比较细胞凋亡率明显增加(P<0.001);Ang2敲低组、Ang2敲低联合奥沙利铂组与空载质粒组比较细胞凋亡率显著增加(均P<0.001);Ang2敲低联合奥沙利铂组与Ang2敲低组比较细胞凋亡率明显增加(P<0.001),与奥沙利铂组比较细胞凋亡率有所增加,但差异无统计学意义(P>0.05)。见图2A。
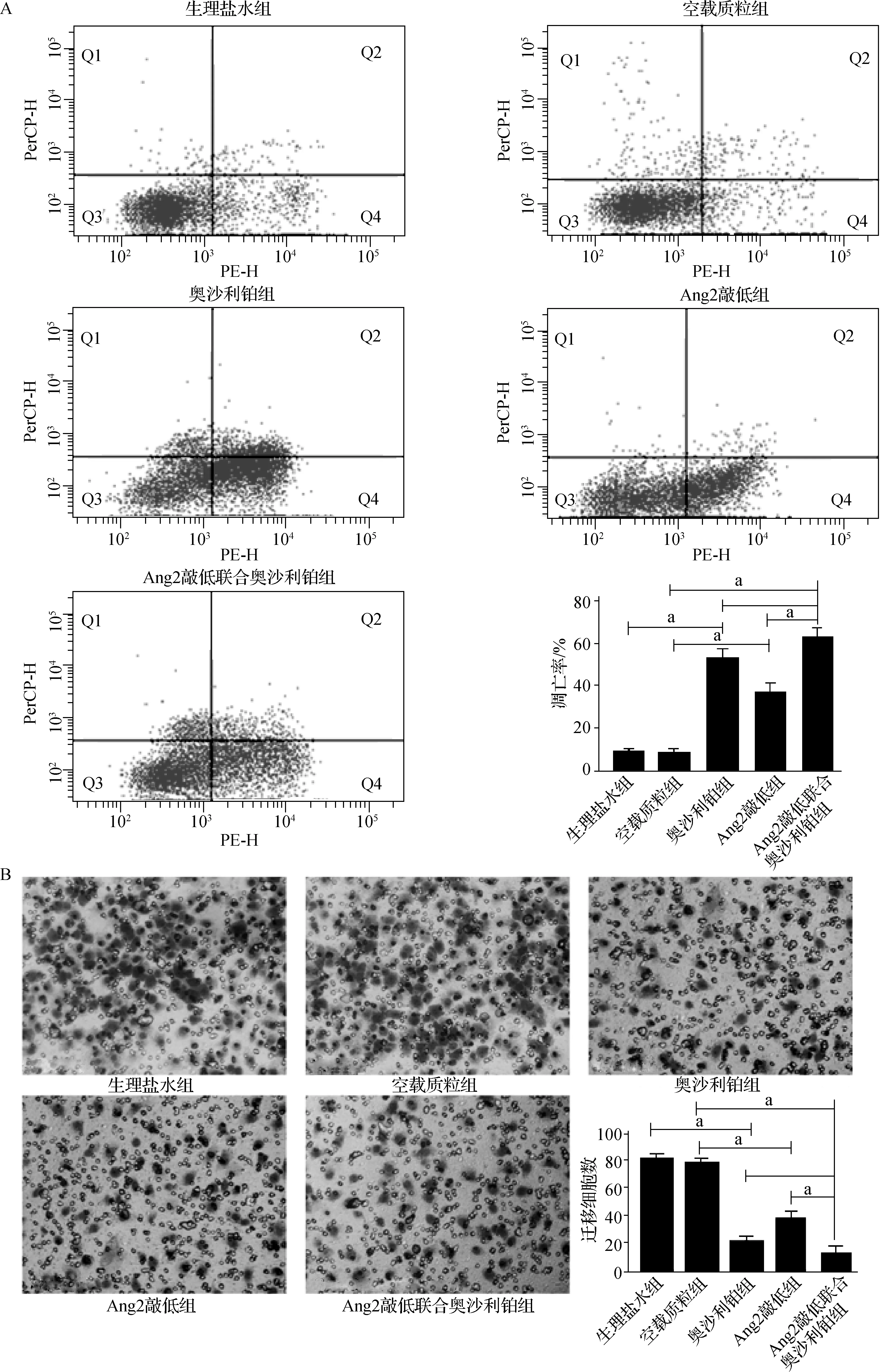
a P<0.001图2 各组Ishikawa细胞凋亡率和侵袭数量检测结果
各组细胞迁移数分别为:生理盐水组80.56±4.28,空载质粒组77.90±2.32,奥沙利铂组20.13±4.16,Ang2敲低组38.93±4.86,Ang2敲低联合奥沙利铂组12.55±4.96。奥沙利铂组与生理盐水组比较细胞迁移数明显减少(P<0.001);Ang2敲低组、Ang2敲低联合奥沙利铂组与空载质粒组比较细胞迁移数显著减少(均P<0.001);Ang2敲低联合奥沙利铂组与Ang2敲低组比较细胞迁移数明显减少(P<0.001),与奥沙利铂组比较细胞迁移数差异无统计学意义(P>0.05)。见图2B。
2.3 各组裸鼠皮下移植瘤在体生长情况和离体状态下肿瘤体积及抑瘤率
裸鼠背部植入不同处理的Ishikawa细胞第7天生理盐水组、奥沙利铂组、空载质粒组可见肿瘤出现,Ang2敲低组在第14天可见肿瘤出现,Ang2敲低联合奥沙利铂组在第21天可见肿瘤出现。肿瘤植入成功率100%。在第21天时生理盐水组、奥沙利铂组、空载质粒组瘤体直径约10 mm,Ang2敲低组、Ang2敲低联合奥沙利铂组瘤体直径约4 mm和2 mm。各组处理28 d后肿瘤生长情况见图3。各组移植瘤体积和抑瘤率见表1。Ang2敲低联合奥沙利铂组、Ang2敲低组、奥沙利铂组与生理盐水组相比肿瘤体积显著减小,差异具有统计学意义(均P<0.001);Ang2敲低联合奥沙利铂组与奥沙利铂组及Ang2敲低组相比肿瘤体积显著减小,差异具有统计学意义(均P<0.001)。Ang2敲低联合奥沙利铂组、Ang2敲低组、奥沙利铂组抑瘤率均大于40%,符合抑瘤率有效的判断标准。
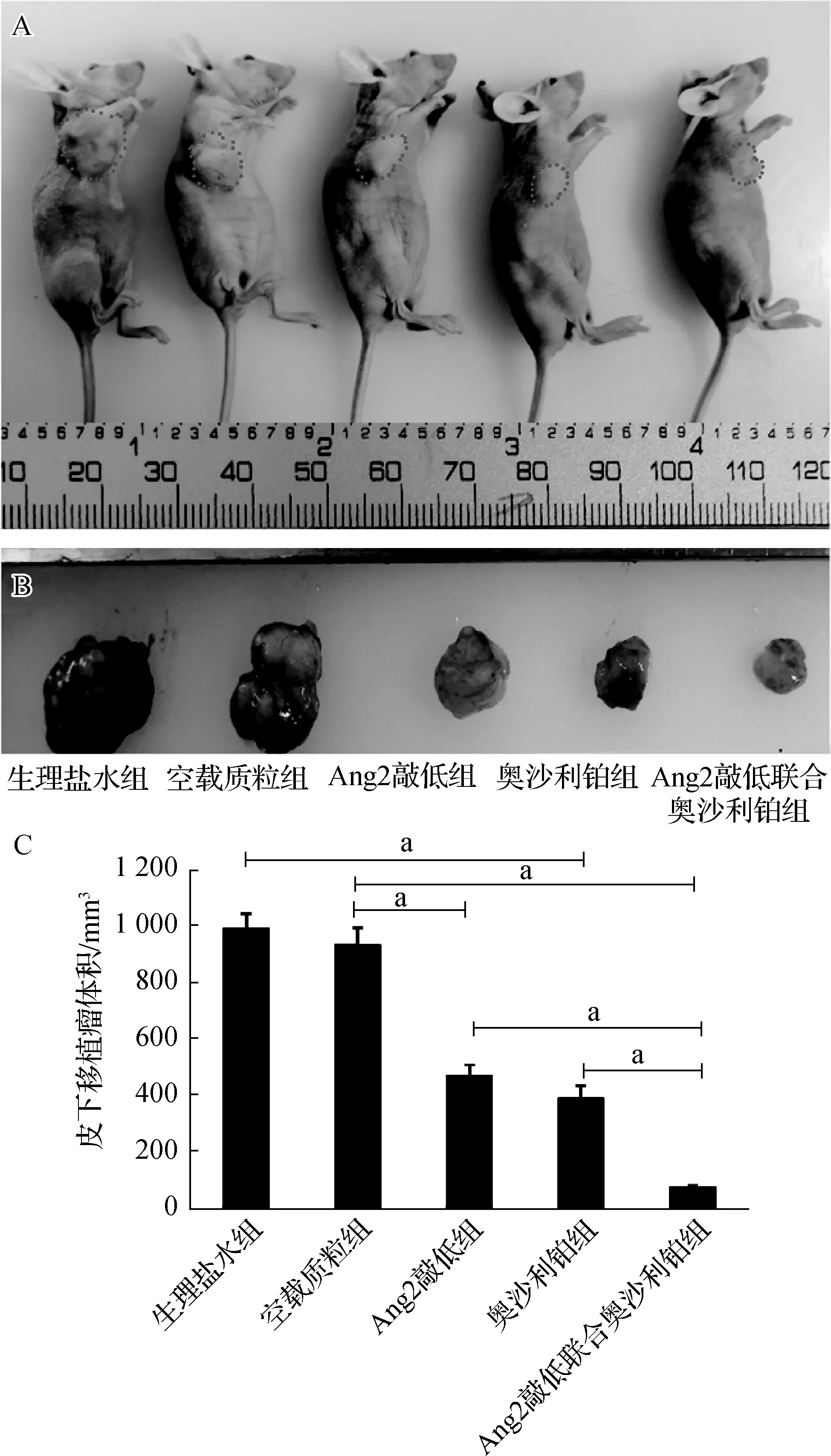
a P<0.001A.每组的裸鼠代表;B.与 A图裸鼠相对应的解剖瘤体积;C.各组肿瘤体积比较图3 各组裸鼠皮下移植瘤生长情况
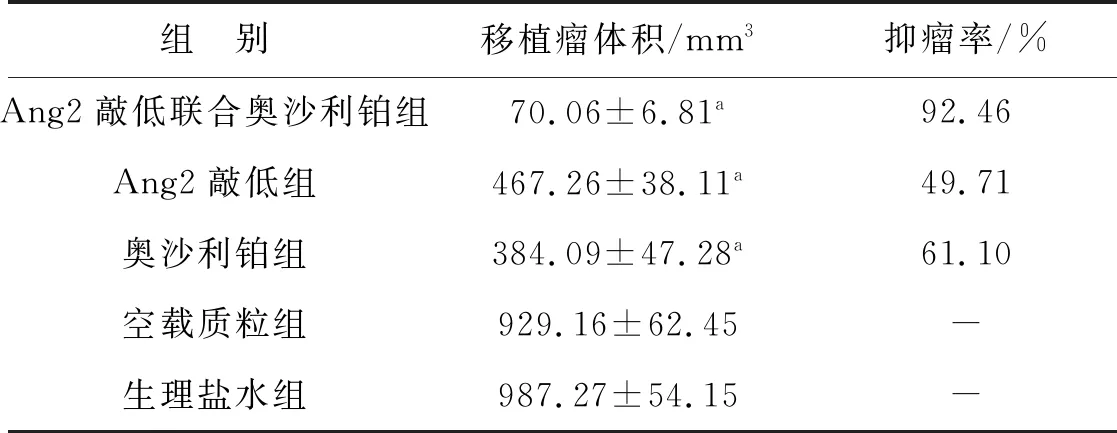
表1 各组裸鼠皮下移植瘤体积及抑瘤率
2.4 各组移植瘤内Ang2的表达和MVD
Ang2敲低组、Ang2敲低联合奥沙利铂组与空载质粒组比较Ang2 mRNA的表达显著降低(均P<0.001),奥沙利铂组与生理盐水组比较Ang2 mRNA的表达明显降低(P<0.05),Ang2敲低联合奥沙利铂组与Ang2敲低组、奥沙利铂组比较Ang2 mRNA表达也显著降低(均P<0.001),见图4A。Ang2敲低组、Ang2敲低联合奥沙利铂组与空载质粒组比较Ang2 蛋白表达显著降低(P<0.05或P<0.001),奥沙利铂组与生理盐水组比较Ang2 蛋白的表达明显降低(P<0.05),Ang2敲低联合奥沙利铂组与Ang2敲低组、奥沙利铂组比较Ang2 蛋白表达也显著降低(均P<0.001),见图4B。Ang2敲低组、Ang2敲低联合奥沙利铂组与空载质粒组比较MVD明显降低(均P<0.001),奥沙利铂组与生理盐水组比较MVD明显降低(P<0.001),Ang2敲低联合奥沙利铂组与Ang2敲低组、奥沙利铂组比较MVD显著降低(P<0.05或P<0.001),见图4C、表2。
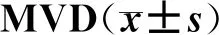
表2 各组移植瘤组织中 HPF·高倍镜-1
3 讨 论
由于恶性肿瘤发生机制复杂多样、肿瘤的异质性和进化特性,个性化的精准治疗很难实现。目前抗癌的策略无非两个方面:一是采取各种手段杀伤癌细胞;二是破坏癌细胞的生存环境。上述两方面的联合疗法是医学工作者的共识。化疗联合抗血管生成是当前临床上最常用疗法。在本实验中我们选择奥沙利铂和Ang2 shRNA对抗Ishikawa细胞活性,这种方法有两方面的优势,一是奥沙利铂与Ang2 shRNA联合具有抗肿瘤的协同作用,二是减弱了耐药性和毒副作用。
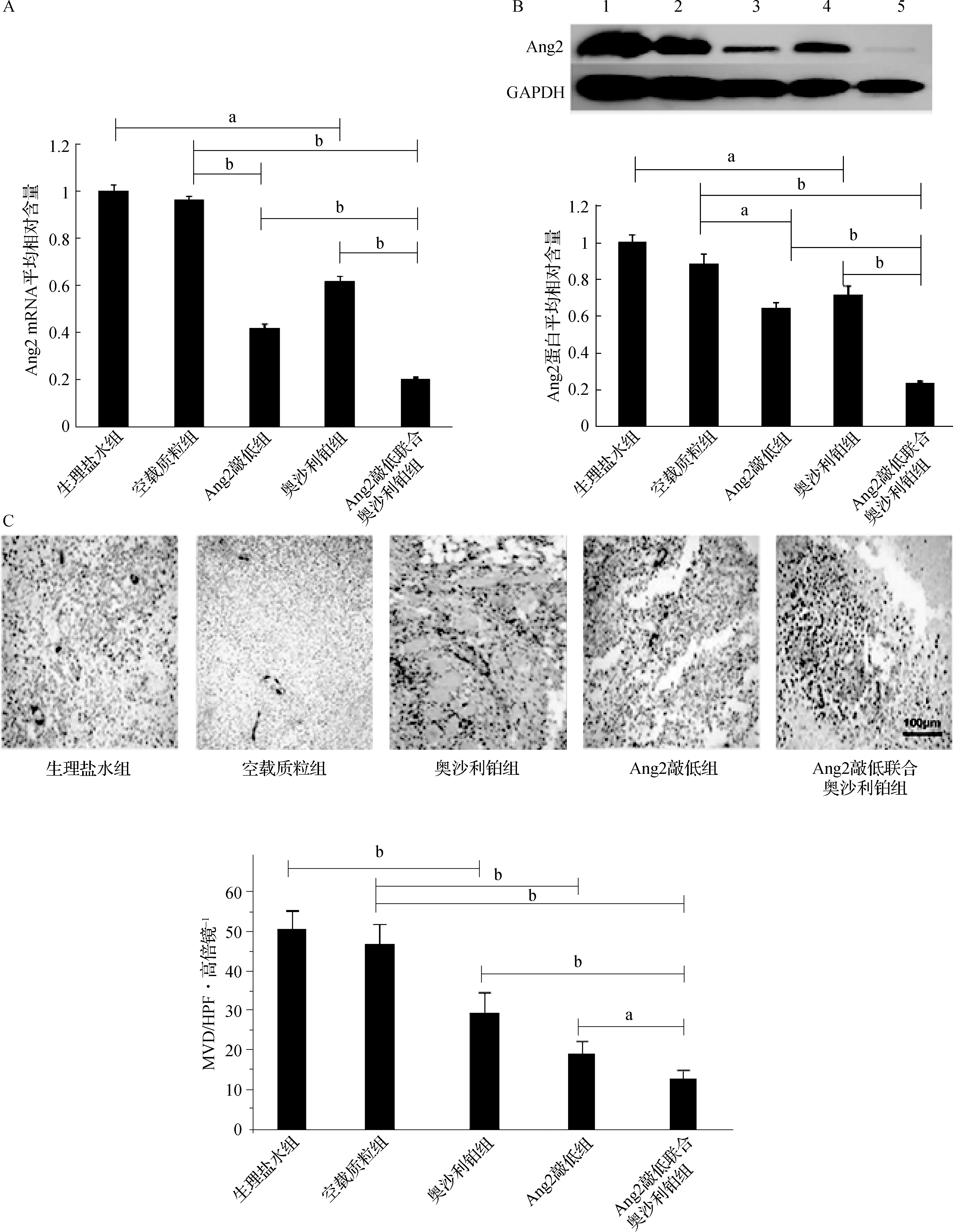
a P<0.05;b P<0.001A.各组移植瘤组织Ang2 mRNA含量;B.各组移植瘤中Ang2蛋白表达情况;C.各组MVD的比较图4 各组移植瘤组织中Ang2 mRNA和蛋白表达情况及MVD
奥沙利铂对人肿瘤细胞系,特别是顺铂耐药细胞系具有有效的抗肿瘤活性。临床前研究也提示奥沙利铂脂质体制剂具有显著的抗血管生成活性[23]。在我们的实验中也证明了这一点:应用小剂量奥沙利铂治疗后,奥沙利铂组和Ang2敲低联合奥沙利铂组 中 Ang2无论在细胞水平还是在Ishikawa异种移植物肿瘤组织中的表达都显著降低,特别是联合治疗组Ang2的表达更低,而且新生血管密度也明显低于奥沙利铂组、空载质粒组和Ang2敲低组。Liu等[24]也发现低剂量奥沙利铂对H22肝癌荷瘤小鼠血管内皮生长因子(VEGF)和MVD的表达有明显的抑制作用,认为低剂量奥沙利铂在体内可能对肿瘤组织的血管生成有抑制作用。这说明此种联合既能抑制Ang2又能抑制VEGF的可能性。然而,上述研究结果与Fan等[25]的研究结果相矛盾,他们发现奥沙利铂在结肠癌细胞中诱导了VEGF家族的几个成员表达增加,包括VEGF-a、VEGF-c和PIGF。该研究未涉及在体动物实验,在体情况下能否诱导VEGF-a、VEGF-c和PlGF不太清楚,另外不同肿瘤细胞的特异性也可能会导致这种结果的出现。奥沙利铂对不同肿瘤细胞除了发挥细胞毒性之外还有不同的作用。奥沙利铂是否在EC细胞中对VEGF家族的几个成员有作用,还需要进一步的研究证实。本研究结果显示,奥沙利铂与Ang2 shRNA联合具有抗血管生成的协同作用。
面对癌症的进化,人们一再看到新药的有效性,随之而来的是肿瘤耐药,目前用于EC的抗血管生成最常用的为VEGF/VEGFR2抑制剂,但是并非所有患者都对该抑制剂有反应,有些患者在长期使用后还是出现了耐药性[26]。于是,通过恢复肿瘤的血液灌注和氧气供应以使肿瘤血管正常化的学说被提出,并开始了第二代抗血管生成剂的研发,即靶向Ang/Tie 轴的药物[27]。基于上述学说,本实验采用奥沙利铂与Ang2 shRNA联合的治疗方法,一方面抑制血管的生成,另一方面使血管正常化,增加奥沙利铂的利用效率。所以联合治疗组裸鼠移植瘤生长速度非常缓慢,大大提高了抑瘤率。
另一方面,我们采用siRNA靶向Ang2的新型治疗手段,siRNA几乎没有毒副作用,故不产生耐药性[28]。所以siRNA在癌症研究领域得到了前所未有的应用。许多研究已经使用siRNAs靶向与癌症的起始和生长相关的基因,并表明该技术可能是在动物模型中治疗癌症的有效手段。在最近的报道中,siRNA被用来靶向胃癌细胞中的sphingosine kinase1(SphK1)、cyclin D1、survivin基因、HER-2/neu受体以及VEGF基因[29-33]。在这些研究中,siRNA的使用已经在体内有效地抑制了肿瘤的生长,并可能成为一种新的抗血管生成治疗方法。靶向VEGF siRNA是第一个在人类临床试验中用于治疗年龄相关性黄斑变性的例子。在小鼠身上的临床前研究显示,siRNA直接注射后,VEGF表达下调,新生血管生成减少[34]。我们的实验也获得了与之一致的结果。
我们在体外细胞实验中发现,Ang2 shRNA可以促进Ishikawa细胞的凋亡、抑制细胞侵袭能力,这也是移植瘤生长缓慢的一个重要原因。此结果提示Ang2可能通过某些途径影响了Ishikawa细胞的生物学行为,这需要以后进行深入的机制研究。
总之,本实验通过体外实验证明了奥沙利铂联合Ang2 shRNA能有效地抑制EC细胞Ang2的表达。奥沙利铂联合Ang2 shRNA与单纯奥沙利铂疗法相比对Ishikawa细胞的凋亡有更好的促进作用,对细胞的侵袭能力有更明显的抑制作用。动物模型研究进一步证明了降低Ang2的表达可增强小剂量奥沙利铂对小鼠移植瘤模型肿瘤生长和血管生成的抑制作用,是一种有希望的、新颖的、安全的、能提高化疗效果的治疗措施。这是一初步的研究结果,还须进一步进行作用机制的探讨及治疗效应标志物的检测。
——一道江苏高考题的奥秘解读和拓展

