lncRNA LINC00339靶向miR-520a-3p对卵巢癌细胞增殖和侵袭的影响
李倩,刘丹彤,姚海荣,齐冰丽
(沧州市中心医院 妇产科,河北 沧州 061000)
卵巢癌是女性生殖系统常见的恶性肿瘤之一,发病率仅次于宫颈癌和子宫癌,患者生存预后较差[1]。目前临床上主要采用手术结合放疗和化疗等综合方案治疗卵巢癌,但是治疗效果不令人满意。深入分析卵巢癌的发病机制,并开发出新的治疗靶点有重要意义[1]。长链非编码RNA(long noncoding RNA,lncRNA)是长度超过200个核苷酸且不编码蛋白质的RNA,广泛存在于真核细胞转录组中,在表观遗传学调控中发挥重要作用[2]。既往研究证实,lncRNA在肿瘤细胞增殖、分化、凋亡、侵袭、迁移和细胞周期的调控中起到重要作用。近年来,lncRNA在卵巢癌诊断和治疗中的作用引起了广泛重视[3]。LINC00339是新发现的一种lncRNA,在乳腺癌、胃癌、肝细胞癌和胶质瘤中表达水平升高[4-7]。LINC00339在卵巢癌中的作用及其机制既往少有报道。miR-520a-3p在肿瘤中可能发挥抑癌基因作用[8-9]。本课题组前期用Target Scan软件预测到微小RNA(microRNA,miRNA)-520a-3p可能是LINC00339的靶基因。本研究分析LINC00339对miR-520a-3p的靶向调控作用,并分析其对卵巢癌细胞增殖和侵袭的影响,旨在阐明LINC00339在卵巢癌中的生物学意义。
1 材料与方法
1.1 细胞和试剂
卵巢癌细胞系(SKOV3、A2780、OVCAR3、HO-8910)和正常卵巢上皮细胞系(HOSEpiC)均购于中国科学院上海细胞库。胎牛血清和RPMI-1640培养基购于广州硕恒生物科技有限公司;LipofectamineTM2000试剂购于美国Sigma公司;sh-LINC00339、anti-miR-520a-3p、miR-520a-3p mimics、pcDNA3.1-LINC00339及其对照质粒均购于美国Invitrogen公司;引物由苏州泓迅生物科技股份有限公司设计并提供;双荧光素酶报告基因检测试剂盒、四甲基偶氮唑盐比色(methyl thiazolyl tetrazolium,MTT)试剂盒、Transwell小室、十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)凝胶快速制备试剂盒和BCA蛋白定量检测试剂盒均购于英国Abcam公司;反转录试剂盒、2倍稀释的SYBR绿色荧光染料实时PCR试剂盒购于上海联迈生物工程有限公司。
1.2 逆转录-聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)检测细胞中LINC00339和miR-520a-3p的相对表达水平
用TRIzol法提取细胞中总RNA,用逆转录试剂盒获得cDNA,反应体系为2 μl 5倍稀释的反应混合液、1 μl RNA和7 μl H2O,条件为37 ℃ 15 min,85 ℃ 15 s。随后用2×SYBR Green PCR Mastermix试剂盒,以cDNA为模板进行PCR,反应体系为10 μl SYBR、1 μl cDNA、1 μl引物和8 μl H2O,条件为95 ℃ 10 min、95 ℃ 30 s、60 ℃ 15 s、72 ℃ 20 s(40个循环),72 ℃ 10 min。用2-△△Ct法计算LINC00339和miR-520a-3p相对表达量。引物序列:LINC00339:上游5′-GGTTGACGAAGTCTGGAACG-3′,下游5′-GCCCATCATTTCATTGGGTA-3′;miR-520a-3p:上游5′-CGAGAGGGCTGGTCCTT-3′,下游5′-GTCCCGAATGTGCTGAGTT-3′;GAPDH:上游5′-TCCTCTGACTTCAACAGCGACAC-3′,下游5′-CACCCTGTTGCTGTAGCCAAATTC-3′。
1.3 沉默LINC00339对SKOV3细胞增殖和侵袭的影响
1.3.1 细胞培养和转染 将细胞置于含10%胎牛血清的RPMI-1640培养基中进行培养,培养环境为37 ℃、5%CO2。待细胞融合度达80%时进行传代。转染前24 h将SKOV3细胞接种于6孔培养板中,当细胞融合达40%时取sh-NC和sh-LINC00339,用血清培养基稀释至100 nmol·L-1,每孔加入2 ml。随后加入LipofectamineTM2000试剂进行转染,操作步骤严格按照试剂盒说明书进行。转染6 h后更换为完全RPMI-1640培养基,48 h后取对数生长期细胞进行后续检测。
1.3.2 克隆形成实验和MTT实验检测SKOV3细胞增殖活力 克隆形成实验:收集对数生长期SKOV3细胞,用胰蛋白酶消化后接种于6孔板中,在37 ℃、5% CO2条件下培养细胞3周。当培养皿中出现肉眼可见的克隆时停止培养,用4 %多聚甲醛进行固定,结晶紫染色,显微镜下观察细胞克隆数目。MTT实验:收集对数生长期SKOV3细胞,接种于96孔板中,培养48 h后弃去培养基,加入MTT溶液,避光孵育4 h,弃去上清液,加入二甲基亚砜,在酶标仪(490 nm波长)上检测光密度(OD)值,反映细胞增殖能力。
1.3.3 Transwell实验检测SKOV3细胞侵袭力 首先在Transwell板上室铺基质胶(用无血清培养基将Matrigel基质胶稀释8倍),随后将SKOV3细胞接种于Transwell小室;下室中加入细胞培养基。培养48 h后取出Transwell小室,用多聚甲醛固定黏附于下室微孔膜下面的SKOV3细胞,用结晶紫染色15 min,随后用PBS洗涤3次,待干燥后在显微镜下取5个视野进行观察,计算平均侵袭细胞数。
1.4 双荧光素酶报告基因验证LINC00339和miR-520a-3p的靶向作用关系
将LINC00339突变型荧光素酶报告载体(LINC00339-MUT)、野生型荧光素酶报告载体(LINC00339-WT)分别同miR-520a-3p模拟物、模拟阴性对照共转染到细胞中,检测荧光素酶活性。为了进一步验证LINC00339与miR-520a-3p的靶向关系,向细胞中转染相关质粒,步骤同1.3.1。将细胞分为:(1) 对照组(miR-NC组)、模拟物组(miR-520a-3p mimics组)、miR-520a-3p抑制组(anti-miR-520a-3p组),检测各组LINC00339相对表达水平(方法同1.2);(2) 空载体组(pcDNA3.1组)、LINC00339过表达组(pcDNA3.1-LINC00339组)、阴性对照组(sh-NC组)、LINC00339抑制组(sh-LINC00339组),检测各组miR-520a-3p相对表达水平(方法同1.2)。
1.5 LINC00339靶向miR-520a-3p对SKOV3细胞增殖和侵袭的影响
用质粒转染SKOV3细胞,步骤同1.3.1。将SKOV3细胞分为对照组(sh-NC+miR-NC组)、LINC00339抑制组(sh-LINC00339+miR-NC组)、LINC00339抑制+miR-520a-3p抑制组(sh-LINC00339+anti-miR-520a-3p组),检测各组细胞增殖(方法同1.3.2)和侵袭(方法同1.3.3)。
1.6 统计学处理

2 结 果
2.1 LINC00339和miR-520a-3p在卵巢癌细胞中的表达
与HOSEpiC细胞比较,SKOV3、A2780、OVCAR3和HO-8910细胞中LINC00339相对表达量明显升高(均P<0.001),而miR-520a-3p相对表达量明显降低(均P<0.001),见图1。
2.2 沉默LINC00339对SKOV3细胞增殖和侵袭和影响
与sh-NC组比较,sh-LINC00339组LINC00339相对表达量,克隆细胞数,转染24、48、72h时细胞增殖活力和侵袭细胞数明显降低(均P<0.05),见图2。
2.3 LINC00339靶向miR-520a-3p的鉴定
Target Scan软件预测到LINC00339和miR-520a-3p有结合位点(图3A)。miR-520a-3pmimics可以明显抑制PGLO-LINC00339-WT的荧光素酶活性(P<0.001),而anti-miR-520a-3p可以增强PGLO-LINC00339-WT活性(P<0.001,图3B)。miR-520a-3pmimics可以下调LINC00339表达水平(P=0.018),而anti-miR-520a-3p可以上调LINC00339表达水平(P<0.001,图3C)。另外,pcDNA3.1-LINC00339可以下调miR-520a-3p相对表达量(P=0.001),而sh-LINC00339可以上调miR-520a-3p相对表达量(P=0.031,图3D)。以上结果说明LINC00339可以靶向作用于miR-520a-3p。
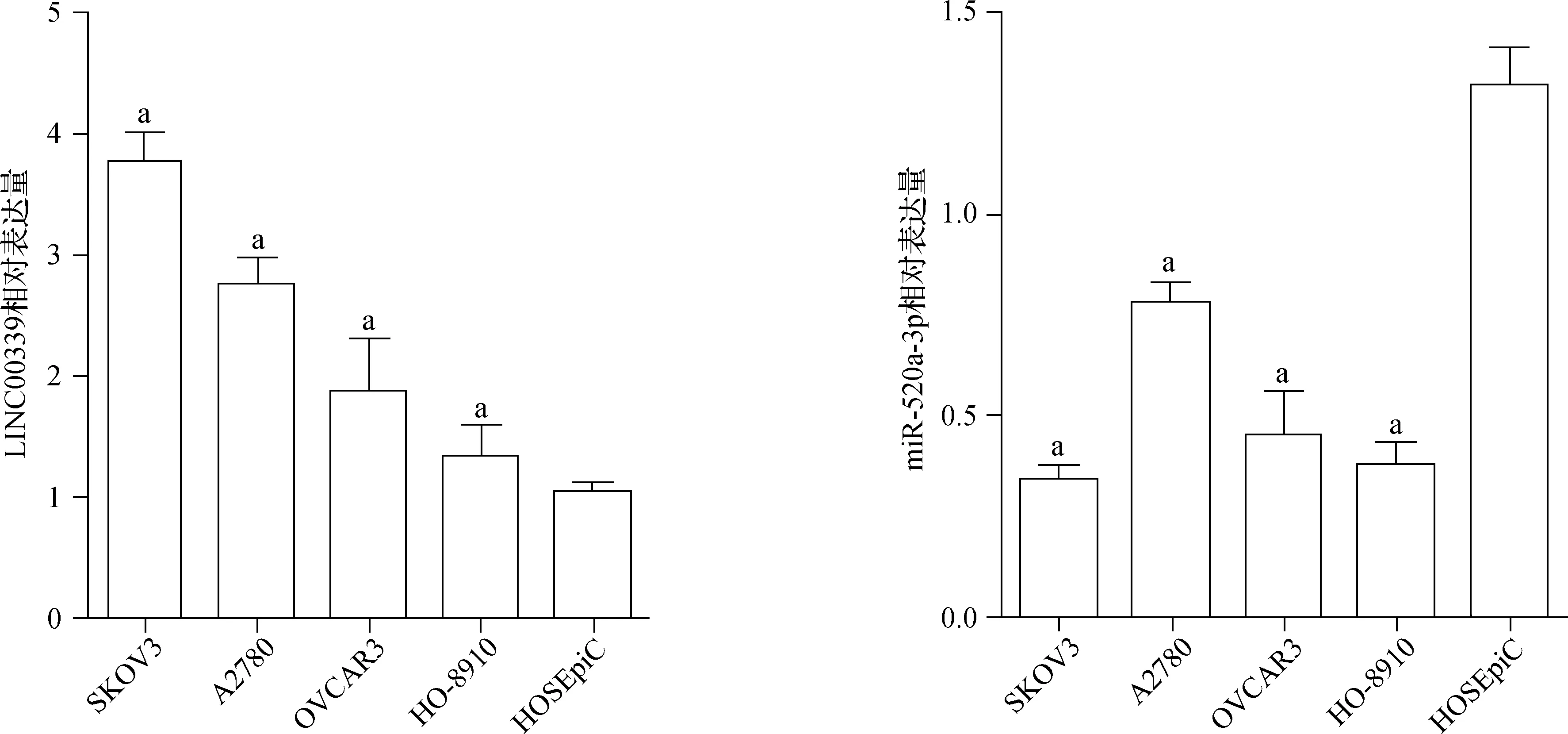
a与HOSEpiC细胞比较,P<0.05图1 RT-PCR检测卵巢癌细胞和正常卵巢上皮细胞中LINC00339和miR-520a-3p的相对表达量

a 与sh-NC组比较,P<0.05A.RT-PCR检测LINC00339相对表达量;B.克隆形成实验检测细胞增殖活力;C.MTT实验检测细胞增殖活力;D.Transwell实验检测细胞侵袭能力图2 沉默LINC00339对SKOV3细胞增殖和侵袭和影响
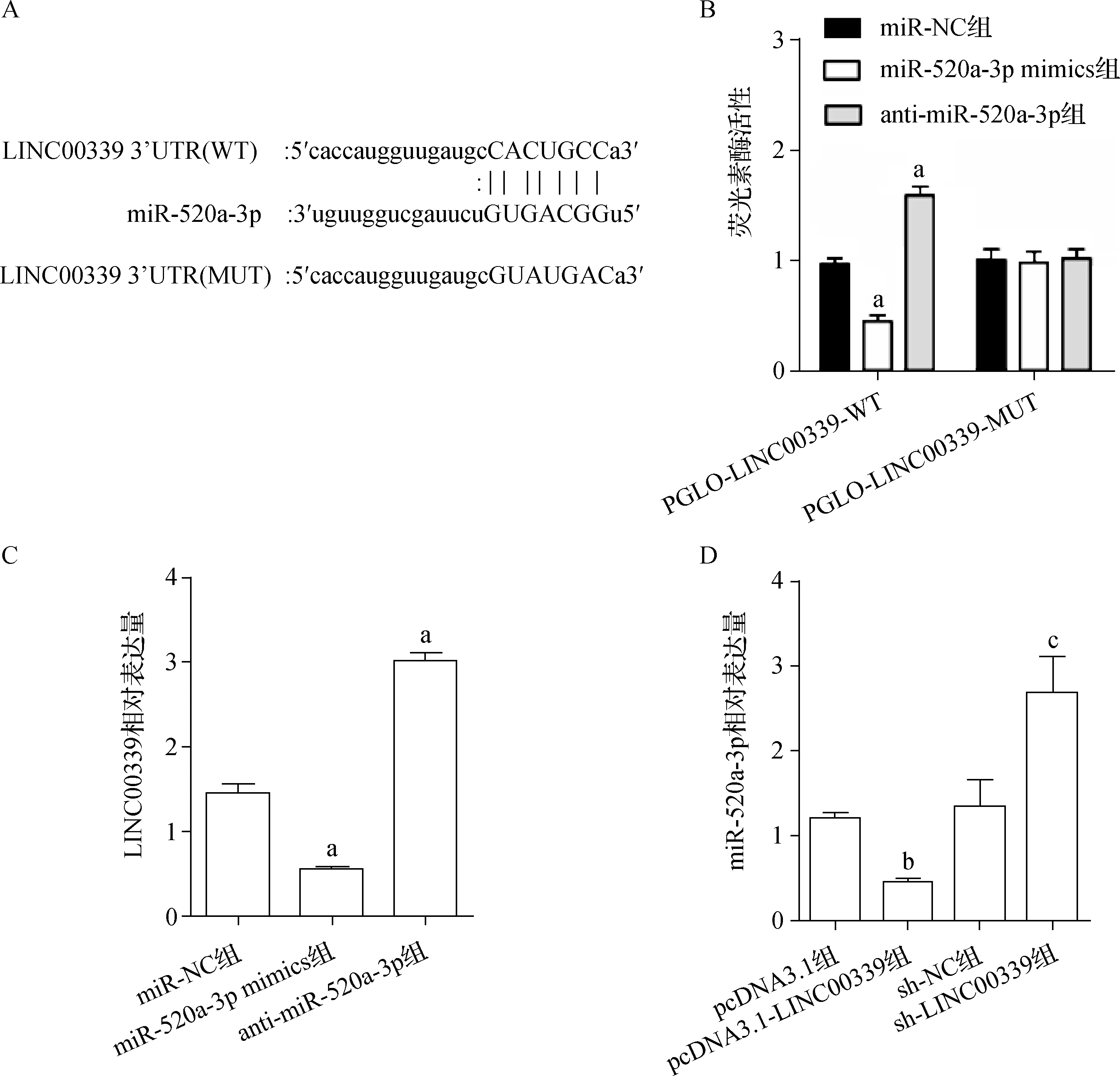
a与miR-NC组比较,P<0.05;b与pcDNA3.1组比较,P<0.05;c与sh-NC组比较,P<0.05A.Target Scan软件预测到LINC00339和miR-520a-3p有结合位点;B.各组荧光素酶活性;C.过表达或抑制miR-520a-3p对细胞LINC00339表达水平的影响;D.过表达或抑制LINC00339对细胞miR-520a-3p的影响图3 LINC00339靶向miR-520a-3p的鉴定
2.4 LINC00339靶向miR-520a-3p对细胞增殖和侵袭的影响
共转染sh-LINC00339和miRNA阴性对照质粒后,克隆细胞数,转染24、48、72 h时细胞增殖活力和侵袭细胞数明显降低(均P<0.05),而共转染sh-LINC00339和anti-miR-520a-3p质粒可逆转上述效应(均P<0.05),见图4。
3 讨 论
卵巢癌的发病机制目前尚未完全明确,表观遗传学调控在卵巢癌中的作用越来越受到重视[10]。lncRNA是表观遗传调控分子,不但可以调节组蛋白和DNA的化学修饰,而且能够调控表观遗传通路本身的基因,进而从根本上对基因组的表达产生影响[2,11]。lncRNA在卵巢癌发生和发展中起到重要作用,例如lncRNA ATB可以促进卵巢癌细胞的增殖、侵袭和迁移,并且与患者不良生存预后有关[12]。lncRNA可能作为卵巢癌分子生物学标志物,在卵巢癌早期诊断和治疗中发挥重要作用[13]。
LINC00339也被称为HSPC157,基因位于chr1:22,024,558-22,031,224(GRCh38/hg38)和chr1:22,351,681-22,357,716(GRCh37/hg19),主要表达于卵巢癌细胞的细胞质中[14]。与癌旁组织比较,卵巢癌组织中LINC00339表达水平较高[14]。本研究结果显示,卵巢癌细胞系(SKOV3、A2780、OVCAR3、HO-8910)中LINC00339的相对表达量明显高于正常卵巢上皮细胞系(HOSEpiC),转染LINC00339-siRNA后SKOV3细胞的增殖活力和侵袭能力明显下降,提示LINC00339可能参与卵巢癌的发生和发展。
LINC00339在肿瘤中的作用机制目前尚未完全明确,lncRNA对miRNA的调节机制可能是其发挥作用的重要途径。有研究发现,LINC00339可以抑制miR-377-3p,上调DCP1A表达,进而促进胃癌细胞的增殖和侵袭[5]。Wang等[15]也发现,LINC00339靶向调控miR-377-3p/HOXC6,促进三阴性乳腺癌细胞的增殖,并抑制凋亡。在胶质瘤中,LINC00339可以通过miR-539-5p/TWIST1/MMPs轴促进瘤组织血管新生[16]。LINC00339还能通过miR-145调控上皮间质转换,促进食管鳞癌的进展[17]。

a 与sh-NC+miR-NC组比较,P<0.05;b 与sh-LINC00339+miR-NC组比较,P<0.05A.克隆形成实验检测细胞增殖;B.MTT实验检测细胞增殖;C.Transwell实验检测细胞侵袭能力图4 LINC00339靶向miR-520a-3p对细胞增殖和侵袭的影响
miR-520a-3p在肿瘤中低表达,可能作为抑癌基因而发挥作用[18]。有研究发现,miR-520a-3p可能通过EGFR信号通路[19]、JAK/STAT信号通路[9]和PI3K/AKT/mTOR信号通路[20]等抑制肿瘤细胞的增殖、侵袭、迁移和上皮间质转换。本课题组前期用Target Scan软件预测到miR-520a-3p可能是LINC00339的靶基因,本研究中我们用双荧光素酶报告基因实验进行验证。本研究发现,共转染sh-LINC00339和miRNA阴性对照质粒后,克隆细胞数,转染24、48、72 h时细胞增殖活力和侵袭细胞数明显下降,而共转染sh-LINC00339和anti-miR-520a-3p质粒可逆转上述效应。结果提示,LINC00339可能通过靶向作用于miR-520a-3p促进卵巢癌细胞的增殖和侵袭。
本研究存在以下局限性:(1) 并未检测增殖和侵袭相关蛋白指标的变化;(2) 未直接分析miR-520a-3p下游分子信号通路的变化;(3) 未分析LINC00339与卵巢癌临床病理特征及生存预后的关系。
综上所述,LINC00339在卵巢癌细胞中高水平表达,可能通过靶向调控miR-520a-3p促进癌细胞的增殖和侵袭。LINC00339可能会成为卵巢癌的治疗靶点,未来需要深入分析其潜在生物学机制,并且分析其临床应用价值。
——一道江苏高考题的奥秘解读和拓展

