LncRNA DLG1-AS1调控miR-203/ZEB2轴诱导甲状腺乳头状癌细胞恶性化生长和转移的机制研究
冯立新,翟传夫,谭清玉
(临沂市中医医院 普外三科,山东 临沂 276000)
甲状腺癌是最常见的内分泌恶性肿瘤,以甲状腺乳头状癌(papillary thyroid carcinoma,PTC)最为常见[1]。虽然相较于髓样癌和未分化癌,大部分PTC生长缓慢、侵袭性弱、分化良好,但是仍有部分患者会发生远处转移,而且由于缺乏有效的靶向治疗手段,导致预后不良。对于PTC发病分子机制的研究已经揭示了相当数量的遗传改变的参与,包括原癌基因、肿瘤抑制因子[2]、非编码RNA[3]等的发现为新靶向治疗的研究提供了新的见解。LncRNA DLG1-AS1是最近在宫颈癌中新鉴定的致癌因子[4]。通过分析癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据集,我们观察到DLG1-AS1在多种肿瘤组织包括PTC组织中表达上调。而且通过初步RNA测序分析表明,DLG1-AS1存在与miR-203靶向结合的互补序列。miR-203是一种在PTC组织中特异性低表达的肿瘤抑制性miRNA[5]。因此,在本研究中,我们选择PTC细胞B-CPAP为研究对象,旨在探讨lncRNA DLG1-AS1/miR-203/靶基因轴在PTC细胞恶性化生长、转移和上皮间质转化(epithelial-mesenchymal transition,EMT)中的作用,以期为PTC的诊断和治疗提供新的分子靶点。
1 材料与方法
1.1 细胞株和主要试剂
PTC细胞TPC1、KTC-1、B-CPAP、HTori-3和正常甲状腺上皮细胞Nthy-ori3-1购自中国科学院上海分院细胞库;PRMI 1640培养基和胎牛血清购自美国Gibco-BRL公司;pcDNA3.1(+)载体质粒和Lipofectamine 2000转染试剂购自美国Invitrogen公司;TRIzol Plus RNA纯化试剂和mirVana miRNA提取试剂盒购自美国Thermo Fisher Scientific公司;PrimeScriptTM RTMaster Mix逆转录试剂盒和SYBR Premix Ex Taq II试剂盒购自大连宝生生物科技有限公司;All-in-OneTMmiRNA qRT-PCR购自美国Genecopoeia公司;CCK-8溶液购自上海碧云天生物科技有限公司;胰蛋白酶、RIPA 裂解液、BCA蛋白浓度测定试剂盒、SDS-PAGE 配胶试剂盒、免疫印迹化学发光剂 ECL购自中国碧云天公司;DLG1-AS1小分子干扰RNA(siRNAs)和阴性对照购自美国Sigma-Aldrich公司;miR-203抑制物和阴性对照序列购自广州锐博生物技术有限公司;免疫印迹一抗ZEB2、E-cadherin、N-cadherin、vimentin、β-catenin和二抗购自美国Abcam公司;双荧光素酶报告试剂盒购自美国Promega公司。
1.2 细胞培养及细胞转染
分别将TPC1、KTC-1、B-CPAP、HTori-3、Nthy-ori3-1细胞培养在PRMI 1640完全培养基(PRMI 1640培养基和胎牛血清按9∶1比例配制PRMI 1640完全培养基,另加入青霉素100 U·ml-1和链霉素100 mg·ml-1)中,37 ℃、5%CO2、饱和湿度条件下培养。取对数期的B-CPAP细胞分为空白对照组、阴性对照组(瞬时转染pcDNA3.1空载体和阴性对照序列)、shDLG1-AS1组(瞬时转染pcDNA3.1-shDLG1-AS1)、shDLG1-AS1+miR-203抑制物组(瞬时转染pcDNA3.1-shDLG1-AS1和miR-203抑制物),分别将pcDNA3.1-shDLG1-AS1(2 μg)、pcDNA3.1空载体(2 μg)、mir-203抑制物(50 nmol·L-1)、阴性对照序列(50 nmol·L-1)用Lipofectamine 2000转染6孔培养皿中的B-CPAP细胞(约1×106个细胞·ml-1)。空白对照组细胞未转染。转染48 h后收集细胞,应用实时荧光定量聚合酶链反应(qRT-PCR)检测转染效率,并用于后续实验。
1.3 qRT-PCR检测细胞中DLG1-AS1和miR-203的相对表达
DLG1-AS1检测:TRIzol试剂盒提取各组细胞总RNA后用反转录试剂盒转录成cDNA。用1.0 μg cDNA模板、上下游引物各0.5 μg和SYBR Premix Ex Taq Ⅱ试剂盒配制20 μl PCR反应体系。热循环条件为:95 ℃单循环30 s,95 ℃ 40 s和58.5 ℃ 30 s循环40次。miR-203检测:采用mirVana miRNA提取试剂盒提取各组细胞miRNAs,然后用All-in-OneTMmiRNA qRT-PCR试剂盒进行miR-203检测。热循环条件为:95 ℃单循环30 s,95 ℃ 40 s和60 ℃ 30 s循环35次。用2-ΔΔCt方法处理数据,内参分别为GAPDH mRNA和小分子U6 mRNA。用于PCR扩增的引物序列如下:DLG1-AS1上游5′-CCGAAACTTTCCGCCAAGATG-3′,下游5′-CCTCACTTCCCATTGGCTGAG-3′;miR-203上游5′-GGGGTGAAATGTTTAGGAC-3′,下游5′-CAGTGCGTGTCGTGGAGT-3′;GAPDH上游5′-CTCACCGGATGCACCAATGTT-3′,下游5′-CGCGTTGCTCACAATGTTCAT-3′;U6上游5′-CTCGCTTCGGCAGCACA-3′,下游5′-AACGCTTCACGAATTTGCGT-3′。
1.4 荧光素酶报告基因检测
通过使用miRcode(http:∥www.mircode.org/)、starBase(http:∥starbase.sysu.edu.cn/index.php)、RegRNA(http:∥regrna2.mbc.nctu.edu.tw/index.html)联合预测了通过互补碱基配对可与DLG1-AS1结合的miRNAs。我们用双荧光素酶报告试验检测 DLG1-AS1与候选者miR-203的结合能力。构建了野生型和突变型荧光质粒psiCheck2-DLG1-AS1-Luc和 psiCheck2-DLG1-AS1-MUT-Luc,并将其与miR-203模拟物共转染至B-CPAP细胞。荧光素酶报告试验检测荧光素酶活性。同样,我们利用Targetscan(http:∥www.targetscan.org/vert_71/)、miRDB(http:∥www.mirdb.org/)、RNA22(https:∥cm.jefferson.edu/rna22/)联合预测了能够与miR-203直接结合的靶基因。分别构建了野生型和突变型荧光质粒psiCheck2-ZEB2-Luc和psiCheck2-ZEB2-MUT-Luc,并与miR-203模拟物共转染。荧光素酶报告试验检测荧光素酶活性。
1.5 CCK-8法检测细胞的增殖能力
取对数生长期的各组细胞用胰蛋白酶消化后接种于96孔板上,于37 ℃、5%CO2培养箱中孵育,分别培养12、24、48、72、96 h后每孔加入10 μl CCK-8溶液,继续培养,2 h后用酶标仪检测各孔吸光度(OD)值。
1.6 Transwell小室法检测细胞侵袭和迁移能力
取1×103个B-CPAP细胞重悬于含有1 μg·ml-1丝裂霉素C的RPMI 1640培养基中,接种在上层Transwell小室中(迁移实验)或者预先用Matrigel基质胶包被的上层Transwell小室中(侵袭实验,预先用无血清1640培养基将50 mg·L-1的Matrigel 1∶4稀释后,包被Transwell小室底部膜,4 ℃风干,水化基底膜),下层培养基加入10%胎牛血清。培养24 h后,残留在上膜上的B-CPAP细胞被完全清除。用甲醇固定移行的B-CPAP细胞,0.1%结晶紫染色。计数至少10个随机视野中的细胞数量。
1.7 蛋白质印迹法检测上皮间质转化(EMT)相关蛋白表达
用十二烷基硫酸钠缓冲液制备总细胞裂解物,裂解B-CPAP细胞(1×107个细胞)。用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离等量蛋白样本,然后转移到硝化纤维素滤膜上。用抗锌指E盒结合蛋白2(Zinc finger E-box binding protein 2,ZEB2)、E-cadherin、N-cadherin、vimentin、β-catenin抗体进行孵育后,用IRdye 800山羊抗兔IgG或IRdye 700山羊抗鼠IgG处理1 h。用ECL化学发光法进行检测,通过Image J软件(NIH)进行灰度扫描、定量,蛋白表达水平根据β-actin进行标化。

a 与Nthy-ori3-1细胞相比,P<0.05;b 与空白对照组相比,P<0.05A.各组细胞DLG-AS1表达差异;B.各组细胞miR-203表达差异;C.干扰DLG-AS1表达效果验证;D.miR-203抑制物转染效果验证图1 PTC细胞和正常甲状腺上皮细胞中DLG1-AS1和miR-203的表达差异
1.8 统计学处理
2 结 果
2.1 DLG1-AS1和miR-203在PTC细胞中的表达
2.1.1 DLG1-AS1和miR-203在PTC细胞和正常甲状腺上皮细胞中的表达差异 经qRT-PCR法检测,与正常甲状腺上皮细胞Nthy-ori3-1相比,PTC细胞TPC1、KTC-1、B-CPAP、HTori-3中DLG1-AS1相对表达量均升高,同时miR-203相对表达量均降低,差异有统计学意义(P<0.05),见图1A、B。B-CPAP细胞中DLG1-AS1相对表达量最高,故而选择B-CPAP细胞进行后续实验。
2.1.2 转染效率验证 与空白对照组(DLG1-AS1:1.00±0.07;miR-203:1.00±0.10)和阴性对照组(DLG1-AS1:0.95±0.08;miR-203:1.03±0.10)相比,shDLG1-AS1组DLG1-AS1相对表达量(0.41±0.05)下降,同时miR-203相对表达量(1.79±0.21)上升,差异有统计学意义(均P<0.05);与shDLG1-AS1组相比,shDLG1-AS1+miR-203抑制物组miR-203相对表达量(0.78±0.08)显著降低,差异有统计学意义(P<0.05),见图1C、D。这些结果证明转染成功。
2.2 荧光素酶报告基因分析
使用miRcode、starBase、RegRNA 3个数据库预测了通过互补碱基配对可与 DLG1-AS1结合的miRNAs,其中miR-203包含在3个数据库中。同样使用Targetscan、miRDB、RNA22 3个数据库预测,ZEB2是miR-203下游重要的靶基因。经双荧光素酶报告发现miR-203模拟物降低含有野生型3′UTR的DLG1-AS1的荧光素酶活性,但不降低含有突变型3′UTR的DLG1-AS1的荧光素酶活性(图2A);另外miR-203 mimics与ZEB2 3′UTR WT共转染后,荧光素酶活性显著降低,但是并不降低含有MUT 3′UTR的ZEB2 mRNA的荧光素酶活性(图2B)。证实DLG1-AS1可以直接与miR-203结合,同样miR-203也可以直接与ZEB2 mRNA结合,突变位点就是这种相互作用的位置。另外根据TCGA数据库检索,LncRNA DLG1-AS1在肿瘤组织中的相对表达量升高,同时miR-203在肿瘤中的表达水平则明显低于正常组织(图3)。

a 与空白对照组相比,P<0.05;b 与阴性对照组相比,P<0.05;c 与shGLD1-AS1组相比,P<0.05图4 各组B-CPAP细胞增殖曲线图

a 与miR-NC组相比,P<0.05A.DLG1-AS1存在与miR-203靶向结合序列,经荧光素酶报告分析,DLG1-AS1野生型与miR-203共转染后荧光强度明显降低;B.miR-203存在与ZEB2 mRNA靶向结合序列,经荧光素酶报告分析,ZEB2野生型与miR-203共转染后荧光强度明显降低图2 DLG1-AS1和miR-203靶基因的筛选和验证
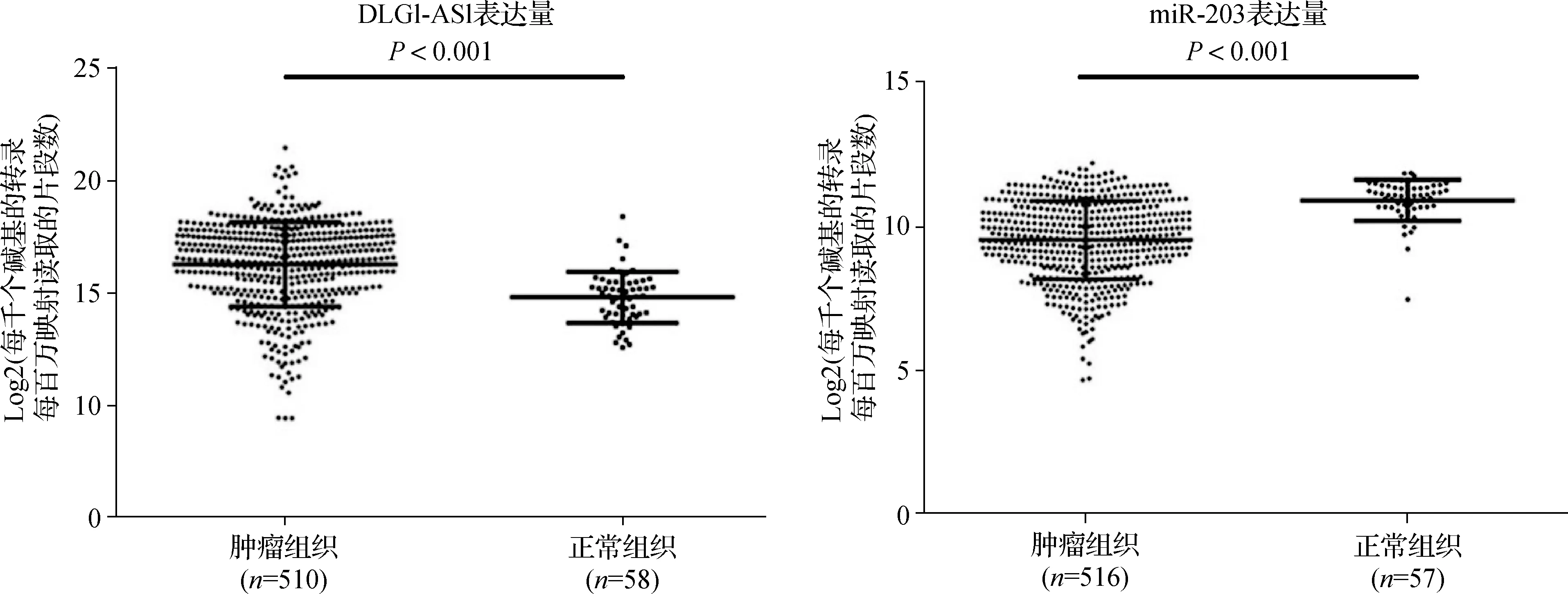
图3 TCGA数据库检索DLG1-AS1和miR-203在PTC组织和癌旁正常组织中的表达差异
2.3 干扰DLG1-AS1表达对B-CPAP细胞增殖活性的影响
与空白对照组及阴性对照组相比,shDLG1-AS1组B-CPAP细胞增殖活性显著降低(均P<0.05);但是与shDLG1-AS1组相比,shDLG1-AS1+miR-203抑制物组B-CPAP细胞增殖活性则显著升高(均P<0.05)。见图4。
2.4 干扰DLG1-AS1表达对B-CPAP细胞迁移和侵袭活性的影响
与空白对照组[迁移细胞数量(523±93)个·视野-1,侵袭细胞数量(368±49)个·视野-1]和阴性对照组[迁移细胞数量(514±59)个·视野-1,侵袭细胞数量(358±33)个·视野-1]相比,shDLG1-AS1组B-CPAP细胞迁移细胞数量[(227±41)个·视野-1]和侵袭细胞数量[(149±28)个·视野-1]均明显减少(均P<0.05);但是与shDLG1-AS1组相比,shDLG1-AS1+miR-203抑制物组B-CPAP细胞迁移细胞数量[(369±26)个·视野-1]和侵袭细胞数量[(237±43)个·视野-1]则显著增多(均P<0.05)。见图5。

图5 Transwell实验观察干扰DLG1-AS1表达对B-CPAP细胞迁移和侵袭活性的影响 ×100
2.5 干扰DLG1-AS1对EMT相关蛋白表达的影响
与空白对照组和阴性对照组相比,shDLG1-AS1组中ZEB2、N-cadherin、vimentin、β-catenin蛋白表达下调,同时E-cadherin表达上调(均P<0.05)。与shDLG1-AS1组相比,shDLG1-AS1+miR-203组中ZEB2、N-cadherin、vimentin、β-catenin蛋白表达上调,同时E-cadherin表达下调(均P<0.05)。见表1、图6。
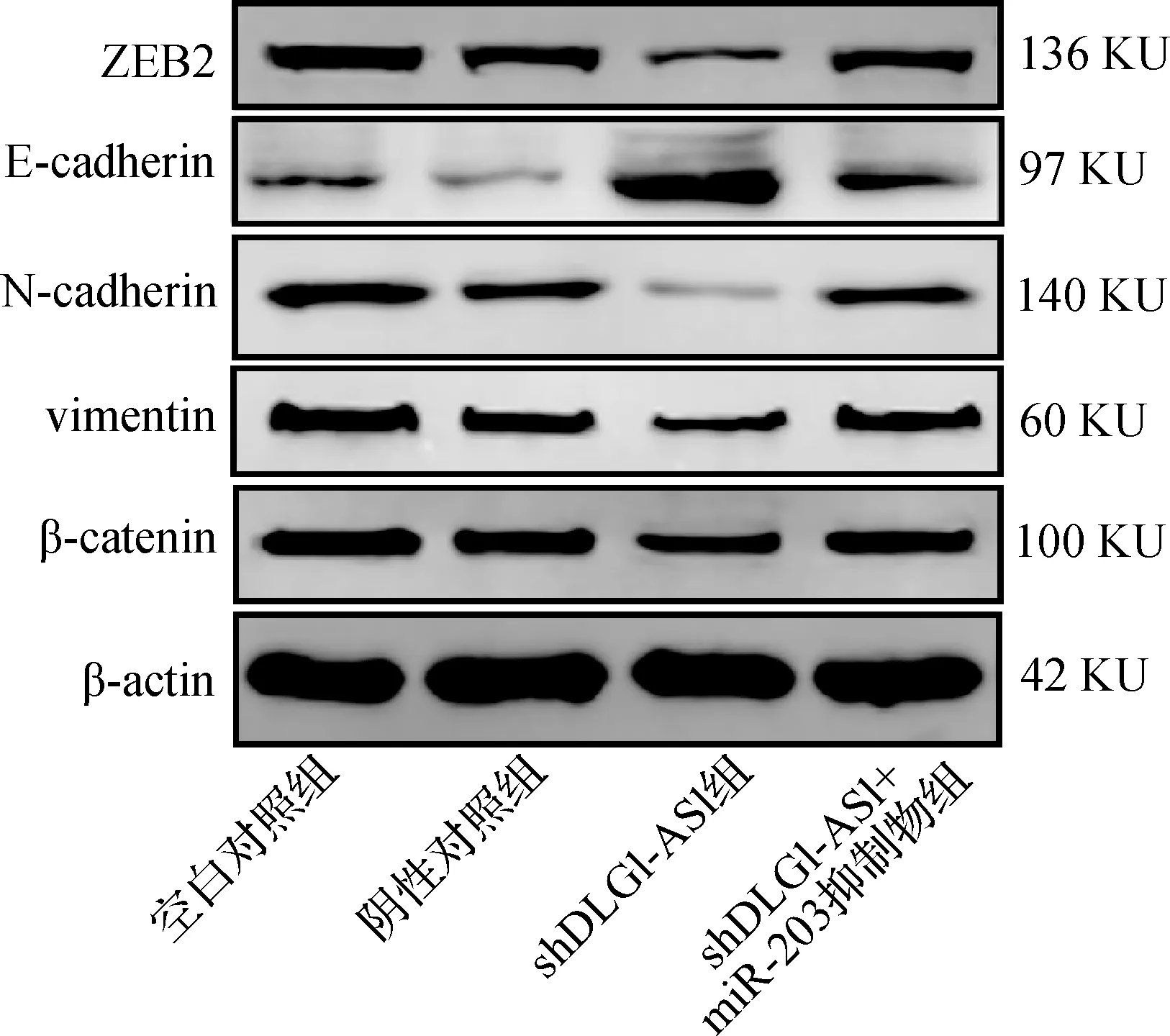
图6 干扰DLG1-AS1表达对B-CPAP细胞中EMT相关蛋白表达的影响

表1 蛋白质印迹法检测各组细胞中EMT相关蛋白的相对表达量
3 讨 论
甲状腺癌的发病率在头颈部肿瘤中居首位,可分为PTC、甲状腺滤泡癌、甲状腺髓样癌和甲状腺未分化癌4种亚型,其中PTC约占甲状腺癌的80%,常见于女性人群[1]。LncRNA是高度保守的非编码RNA分子,长度超过200个核苷酸序列。与miRNAs相比,LncRNAs具有复杂的结构和多样的表达调控。研究表明LncRNAs在蛋白质功能调控、基因印迹、转录和转录后调控等方面发挥着重要作用[6]。而且在PTC发生和发展过程中,LncRNAs已成为新的治疗目标以及诊断和预后标志物[7]。在本研究中,我们证实LncRNA DLF1-AS1可以作为竞争性内源RNA(competitive endogenous RNA,ceRNA),与 mRNA的3′UTR中的miR-203识别元件结合,释放出miR-203,对下游靶基因ZEB2 mRNA进行抑制或降解,从而调节ZEB2蛋白以及EMT相关蛋白的表达。
PTC的发生和发展是一个多因素、多阶段的过程,受到多种癌基因、抑癌基因或转移相关基因的影响[8]。最近很多学者开始关注LncRNA DLG1-AS1在多种恶性肿瘤组织和细胞中的表达模式和功能。例如Rui等[4]学者证实DLG1-AS1在宫颈癌中表达上调,可以通过吸附miR-107进而上调致癌基因ZHX1的表达,从而促进宫颈癌细胞的增殖。Li[9]发现,在三阴性乳腺癌组织和MCF-10A细胞中,DLG1-AS1相对表达量上调,进而促进肿瘤细胞的增殖和迁移活性;其作用机制与介导miR-203表达下调有关。在本研究中,我们发现DLG1-AS1在PTC细胞(TPC1、KTC-1、B-CPAP、HTori-3细胞)中的表达水平也较正常甲状腺上皮细胞Nthy-ori3-1明显升高,尤其以B-CPAP细胞中DLG1-AS1表达量升高最明显。由于我们后续需要敲低DLG1-AS1表达,以证实其在PTC细胞恶性化生长和转移中的作用,因此我们选择表达量最高的B-CPAP细胞进行细胞转染实验。通过干扰DLG1-AS1表达,B-CPAP细胞的增殖、迁移和侵袭活性显著降低,说明DLG1-AS1也在PTC生长和转移过程中发挥着致癌作用,DLG1-AS1过表达可能是促进PTC生长和转移进而导致肿瘤进展和预后不良的重要分子机制之一。
非编码RNA(ncRNA)是转录组的关键组成部分,在正常的生物学活性和病理过程(如病毒感染和肿瘤发生)中均起着重要作用[10]。LncRNA和miRNA是ncRNA的最重要元素,并起着至关重要的调节作用。lncRNA可以通过与miRNA的互补结合来调节基因表达[11]。miR-203基因序列定位于染色体14q32.33上,该区域是染色体上的不稳定区域,编码了约12%的人类mRNA。最近更多的研究表明miR-203是一个关键的肿瘤抑制因子,参与了包括PTC、黑色素瘤、子宫内膜癌在内的许多肿瘤的发病机制[12-14]。Wu等[15]观察到miR-203在PTC组织和细胞系中的表达水平明显低于正常对照组,而且miR-203表达下调与survivin的过度表达有关,因此miR-203在PTC中具有生物标志物的功能,可作为治疗PTC新型治疗策略的候选靶点。此外,You等[16]发现,上调miR-203表达可抑制AKT3蛋白表达,不仅可降低荷瘤小鼠模型的肿瘤体积和重量,而且也可抑制体外TPC-1细胞的迁移、集落形成、增殖和侵袭活性以及增殖相关蛋白(ki67和CDK4)、侵袭和迁移相关蛋白(MMP-2和MMP-9)的表达,促进细胞凋亡,提高上皮细胞标志物E-cadherin的表达和降低间质细胞标志物vimentin蛋白的表达。在本研究中,我们证实miR-203通过阻断EMT相关信号因子抑制B-CPAP细胞的迁移、侵袭活性,包括降低ZEB2、N-cadherin、vimentin、β-catenin的表达,同时诱导E-cadherin蛋白表达。
ZEB2是促进很多肿瘤细胞转移的关键因子。Kan等[17]观察到,过表达miR-335通过靶向抑制ZEB2表达进而抑制PTC肿瘤细胞的侵袭和迁移活性。在本研究中,我们通过数据库筛选、实验和双荧光素酶报告试验,进一步确定ZEB2是miR-203调控的靶基因。EMT是上皮细胞经历表型转变获得间充质表型以促进迁移和侵袭的过程。EMT的激活引发上皮标志物E-cadherin下调以及间充质标志物(N-cadherin、vimentin、β-catenin)表达增加。而E-cadherin的缺失主要是由ZEB2转录因子介导的,ZEB2通过与E-cadherin(CDH1)基因启动子区域的E-box元件结合,上调组蛋白去乙酰化酶活性和染色质缩合阻遏E-cadherin 的转录,进而启动EMT过程。在本研究中,我们观察到干扰GLD1-AS1表达后,B-CPAP细胞的ZEB2蛋白表达下调,同时E-cadherin蛋白表达上调,N-cadherin、vimentin、β-catenin表达降低,因此抑制EMT过程可能是干扰GLD1-AS1表达抑制B-CPAP细胞增殖、迁移和侵袭活性的重要机制。
综上所述,LncRNA DLG1-AS1通过与miR-203竞争结合,消除miR-203对靶基因ZEB2表达的抑制,促进PTC细胞发生EMT,这可能是PTC恶性化生长和转移的重要机制。因此,LncRNA DLG1-AS1/miR-203/ZEB2轴可作为PTC诊断和治疗的潜在分子靶点。

