4种猪源病毒多重PCR检测方法的建立及初步应用
王 莹,刘雨田,孙成友,迟田英,宋芳芳,于小静,吴晓东,王志亮
(中国动物卫生与流行病学中心,山东青岛 266032)
非洲猪瘟(African swine fever,ASF)、尼帕病毒病(Nipahvirus disease,NiVD)、口蹄疫(foot-and-mouth disease,FMD)和猪水疱病(swine vesicular disease,SVD)都是猪的高度易感性传染病,其中ASF、NiVD和FMD属于烈性传染病。ASF是当今世界上养猪业危害最严重的猪病之一,其病原非洲猪瘟病毒(African swine fever virus,ASFV)是双链DNA病毒,也是迄今为止发现的唯一一种虫媒传播的DNA病毒[1]。软蜱作为传播媒介能够携带ASFV使其在野猪和家猪之间传播[2]。NiVD是由尼帕病毒(Nipahvirus,NiV)引起的主要侵害中枢神经系统和呼吸系统的急性高度致死性人兽共患病[3-4]。1998年,它被发现于马来西亚,次年在尼帕镇的一名患者体内首次分离到病毒并得以命名[5]。在当时为控制疫情,马来西亚政府扑杀了上百万头猪。21世纪初期新加坡因与马来西亚有生猪贸易往来,也暴发过NiVD。猪水疱病病毒(swine vesicular disease virus,SVDV)属于小RNA病毒科肠病毒属,与人的柯萨奇B5病毒有密切抗原关系[6]。该病毒传染性强,致病率高,可引起各品种、各日龄猪只发病[7]。FMD是由口蹄疫病毒(foot-and-mouth disease virus,FMDV)引起的一种急性、热性、高度接触传染性并可快速远距离传播的动物疫病。大多数国家属于“FMD疫区”,已消灭FMD的国家或区域仅占少数。针对FMD,我国主要采取监测和预防免疫措施,其中Asia I型已退出免疫,实现了全国免疫无疫水平[8]。目前我国主要流行A型和O型FMDV。
集约化、规模化养殖方式使猪群之间的接触概率大大增加,猪群发生病毒混合感染的比例也相对上升,这给养猪业带来了较大经济损失。要加强对动物疫病的认识,特别是加强对新发病和外来病的了解,疫病诊断技术研发十分关键。目前,操作性强且能同时检测ASFV、NiV、SVDV和FMDV 4种重要猪源病毒的多重PCR检测方法还未见报道。分子生物学虽然在不断发展,但PCR方法仍是病原检测的首选。本研究根据GeneBank登录的相关病毒序列,筛选出保守序列进行人工合成,将合成序列插入pMD-19T载体中构建重组质粒,以此作为PCR反应模板,使用Primer 5.0软件设计引物,建立了ASFV、NiV、FMDV和SVDV的多重PCR检测方法。
1 材料与方法
1.1 质粒标准品和样品
根 据GeneBank中登录的ASFV、NiV、FMDV和SVDV全基因组序列,选择各自保守基因ASFVP72(KF303314.1)、NiVN(FJ648082.1)、SVDVVP1(AB716937.1)和FMDV全基因组(KY234501.1)中3D基因(7 797~8 071 bp)进行人工合成,以pMD-19T为载体进行阳性质粒标准品构建。用于临床样品检测的核酸以及猪圆环病毒(PCV)、猪细小病毒(PPV)、猪伪狂犬病病毒(PRV)、猪流行性腹泻病毒(PEDV)、猪瘟病毒(CSFV)、猪繁殖与呼吸综合征病毒(PRRSV)核酸样本,由中国动物卫生与流行病学中心国家外来动物疫病诊断中心保存。
1.2 主要试剂和仪器
2×Phusion U Green Multiplex PCR Master Mix(Thermo scientific),MinElute Virus Spin Kit(QIAGEN),PrimeScript ™ II 1st Strand cDNA Synthesis Kit(TaKaRa),PCR仪(GeneMax),电泳仪(Bio-Red)以及凝胶成像系统(上海天能)。其他试剂均为国产分析纯。
1.3 引物设计与合成
根据合成的基因序列,利用Primer 5.0软件进行初步分析并设计引物,对引物通过在线Blast确定引物特异性。引物序列由宝生物(大连)有限公司合成。引物序列、目的基因、扩增片段长度详见表1。

表1 多重PCR引物详细信息
1.4 多重PCR方法建立与条件优化
在单一PCR基础上,对多重PCR反应条件进行优化:一是优化引物浓度。根据多重PCR扩增条带明暗程度,设置ASFV、NiV、FMDV、SVDV引物体积比分别为1:1:1:1、2:1:1:1、2:2:1:1。二是优化退火温度。设置退火温度分别为45、48、51、54、57、60 ℃。通过优化,筛选出多重PCR最适反应条件,并将最适条件下的多重PCR产物送测序。
1.5 敏感性试验
利用紫外分光光度计测定质粒初始浓度并计算每种质粒拷贝数;将质粒用EASY Dilution溶液进行10倍倍比稀释,作为敏感性试验反应模板;用优化后的多重PCR反应体系验证敏感性。
1.6 特异性试验
以PCV、PPV、PRV、PEDV、CSFV和PRRSV cDNA为模板进行多重PCR检测,同时设立ASFV、NiV、FMDV、SVDV阳性对照和无菌水阴性对照,用优化后的多重PCR反应体系验证特异性。
1.7 重复性试验
应用建立的多重PCR方 法,对ASFV+NiV+FMDV+SVDV、ASFV+NiV+FMDV、ASFV+NiV+SVDV、ASFV+FMDV+SVDV、NiV+FMDV+SVDV、ASFV+NiV、ASFV+FMDV、ASFV+SVDV、NiV+FMDV、NiV+SVDV、FMDV+SVDV、ASFV、NiV、FMDV和SVDV样本进行多次重复试验,验证多重PCR方法稳定性。
1.8 临床样品检测
48份临床样品采集自全国各地养猪场,包括组织匀浆液、全血和拭子。将提取的样品核酸经反转录后以cDNA为模板进行多重PCR扩增。
2 结果
2.1 多重PCR条件优化
为获得最佳试验效果对引物扩增条件进行摸索和调整,确定了多重PCR最佳反应体系:最适退火温度为57 ℃(图1),ASFV、NiV、FMDV、SVDV引物最佳体积比为2:1:1:1;PCR Master Mix 12.5 μL,按优化比例混合上下游引物各2.5 μL,每种病毒模板0.5 μL,然后无菌水补足至25.0 μL。最佳扩增条件:98 ℃ 30 s;98 ℃ 10 s,57 ℃ 30 s,72 ℃ 30 s,35个循环;最后72 ℃延伸10 min。测序结果与参考基因序列同源性在98% 以上。
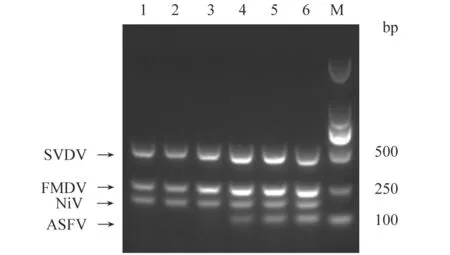
图1 多重PCR退火温度优化结果
2.2 敏感性试验
由紫外分光光度计测得ASFV、NiV、FMDV、SVDV质粒初始浓度分别为132、154、491、154 ng/μL。根据换算公式:质粒拷贝数(拷贝/μL)=[6.02×1023× 质粒浓度(ng/μL)×10-9]/(660×质粒碱基数),换算为拷贝数。通过换 算,ASFV、NiV、FMDV和SVDV质粒拷贝数分别为3.90×1010、4.60×1010、2.09×1011和3.70×1010copies/μL。按照最佳反应条件和体系,将上述质粒10倍倍比稀释液混合后作为模板进行扩增。结果(图2)显示,本试验建立的多重PCR方法检测ASFV、NiV、FMDV和SVDV 4种 病毒的最低检出量分别为390.0、46.0、20.9和37.0 copies/μL。
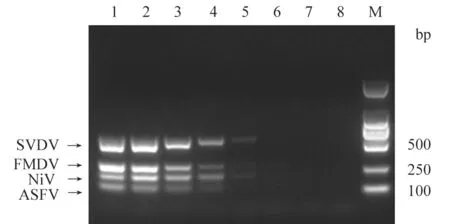
图2 多重PCR敏感性试验结果
2.3 特异性试验
采用优化的多重PCR体系及反应条件,以常见猪源病毒PCV、PPV、PRV、PEDV、CSFV和PRRSV核酸或cDNA为模板进行扩增。结果(图3)显示,PCV、PPV、PRV、PEDV、CSFV和PRRSV模板扩增后均未见到扩增产物,只有ASFV、NiV、FMDV和SVDV扩增出了相应目的条带。

图3 多重PCR特异性试验结果
2.4 重复性试验
不同组合的核酸模板均能扩增得到与预期大小相符的目的条带(图4),表明建立的多重PCR方法重复性好。
图4 多重PCR重复性试验结果
2.5 临床样品检测
利用建立的多重PCR方法对本实验室保存的48份临床样品进行检测,没有发现混合感染情况,检测到ASFV阳性25份、FMDV阳性1份,未检出NiV以及SVDV。随机选取23份样品进行单一PCR复检,检测结果与多重PCR一致(图5、表2)。

图5 部分临床样品多重PCR检测结果
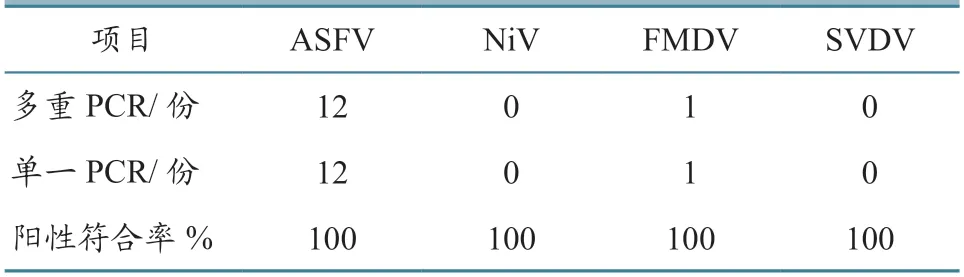
表2 23份临床样品多重PCR与单一PCR检测结果比较
3 讨论
2018年ASF传入我国,随后疫情蔓延至所有省份,对养猪业造成了沉重打击。由于没有相应ASFV疫苗和治疗药物,履行严格的检疫程序和扑杀病死猪是ASF主要防控措施[9]。2020年,我国共报道18起ASF疫情,其中16起与生猪调运有关,2起发生于养殖场[10],说明防控ASFV传播仍然非常必要。虽然我国目前尚未有关于NiVD的报道,但是在我国南部边境城市的蝙蝠血液、尿液中均能检测到NiV抗体[11]。SVD和FMD均以猪口部、鼻部、乳头以及蹄冠等处发生水疱为主要症状,从临床症状上对这两种水疱性疫病不易识别,需要通过实验室检测进行诊断区分。FMD是我国重点防治的动物疫病,目前还没有SAT型FMD的报道,但SAT2型FMDV已由非洲扩散至西亚、中东地区[12]。由于从国外进口猪肉、人员往来以及经济贸易等因素存在,SAT2型FMDV传入风险不容忽视。现有养殖模式下,生猪同时感染2种或2种以上病原体也很常见[13],因此建立可同时检测上述4种病毒的方法,对于保证生猪生产健康发展具有重要意义。
多重PCR在单一PCR基础上发展而来,在1次反应中加入2对或2对以上引物,可达到1次扩增检测多种病原的目的。多重PCR在试验原理上与单一PCR相同,但并不是简单综合,反应体系中组成成分的浓度用量与反应条件都需要经过试验摸索,还要在琼脂糖凝胶上区分不同大小的目的片段。引物设计对多重PCR检测成败至关重要,直接影响多重PCR反应的特异性与敏感性。多对引物在同一体系中同时反应时,不同引物之间不可避免存在相互竞争和干扰,这就要求引物必须高度特异,避免PCR反应的非特异性扩增。各组引物退火温度要尽量接近,只有这样,在同一反应条件下每种病毒才都能做到最大限度扩增,同时也容易筛选最适退火温度。
本研究首次建立了ASFV、NiV、FMDV、SVDV多重PCR检测方法,分别针对ASFVP72、NivN、FMDV3D和SVDVVP1基因序列的保守区域设计引物,对ASFV、NiV、FMDV、SVDV核酸可分别扩增出115、188、275和540 bp的基因片段。片段扩增大小与预期相符,测序结果与目的基因序列一致,表明设计的引物特异性良好,适用于FMDV 7个血清型的通用检测以及与ASFV、NiV、SVDV的鉴别检测。敏感性试验表明,ASFV、NiV、FMDV、SVDV 4种病毒检测敏感性较高,可有效避免低病毒含量样品出现假阴性情况。4对引物在扩增每种病毒DNA/cDNA或进行多重PCR时,只能检测到相应病毒目的片段,对PCV、PPV、PRV、PEGV、CSFV和PRRSV核酸扩增结果均为阴性,说明本研究建立的多重PCR具有良好的特异性。以4种病毒质粒的不同排列组合为模板进行试验,发现扩增片段与预期大小一致,表明建立的多重PCR方法重复性好。在多重PCR中,各引物使用相同物质的量参与反应时,扩增效果并非均一[14]。本研究对4种病毒引物比例进行了优化,在不产生非特异性扩增和过多引物二聚体的前提下,最终得到当ASFV、NiV、FMDV、SVDV引物体积比为2:1:1:1时,多重PCR能达到最好的扩增效果。
利用本方法对48份临床样品进行检测,发现检测结果与4种病毒普通PCR方法复检一致,符合率为100%。对ASFV样品检测结果分析发现,所用样品已通过OIE推荐的荧光定量PCR方法确诊,检测到ASFV阳性26份。在本研究中检测到25份ASFV阳性,经查证,未检出的那份ASFV阳性样品是猪粪便拭子,说明本研究建立的多重PCR检测方法具有较高的实用价值,能够满足基本的临床检测需求。
经验证,本研究建立的多重PCR方法敏感性高、特异性强、稳定性好,可在1份样品中同时检测ASFV、NiV、FMDV和SVDV 4种病原,为我国ASF、NiVD、FMD和SVD监测、流调等活动提供了新的技术支持。

