抑制Polo样激酶1表达靶向DNA错配修复相关通路并抑制卵巢癌的相关研究*
李 娟,何 苗,袁春兰,李红梅,邓小梅,肖 雪
(四川省医学科学院,四川省人民医院机器人微创中心,四川成都610072)
卵巢癌(ovarian cancer,OC)是最致命的妇科恶性肿瘤,其高死亡率归因于发现晚、耐药和缺乏靶向治疗[1]。虽然患者最初对常规化疗敏感,但大多数患者在12~24个月内复发,最终死于该病。因此,迫切需要识别OC的潜在预后标志物和开发新的治疗策略来提高临床疗效。错配修复(mismatch repair,MMR)是一种进化上保守的机制,可以纠正DNA复制或损伤过程中产生的突变,在维持基因组稳定性方面起着至关重要的作用[2]。在OC中,MMR缺陷(MMR deficiency,dMMR)是继BRCA1和BRCA2突变后遗传性OC的最常见原因[3]。Polo样激酶1(Polo-like kinase 1,PLK1)是丝氨酸/苏氨酸激酶家族的一员,它在细胞分裂的不同阶段连接到有丝分裂纺锤体上,从而稳定着丝粒-微管的附着,并触发G2-M相变[4]。PLK1在多种肿癌中过度表达,如非小细胞肺癌、乳腺癌和黑色素瘤,并与肿瘤进展和预后不良相关,使得PLK1成为抗肿瘤治疗的一个有希望的靶点[5]。最近研究显示,PLK1抑制剂通过调节DNA修复蛋白增强非小细胞肺癌的放射增敏作用[6-7],表明PLK1在肿瘤MMR中起着潜在的调控作用。然而,关于PLK1在OC相关MMR中的分子机制还需要进一步研究。在本研究中,我们分析了PLK1在OC细胞和组织中的表达及与临床病理特征的关系,并探讨PLK1抑制对耐5-氟尿嘧啶(5-fluorouracil,5-FU)OC细胞活力和凋亡的影响,及其作用机制是否与MMR有关。
材料和方法
1 患者和标本
在2011年4月~2018年12月期间,126名OC患者纳入本研究。所有患者术前均出现高水平的糖类抗原125,术前未进行化疗或放疗。匹配的邻近正常卵巢组织距离肿瘤>2 cm。收集患者的临床病理特征,包括年龄、肿瘤类型、绝经期、FIGO分期和肿瘤分级。术后随访记录总生存时间,中位随访时间为39.7个月。使用针对MLH1、MSH2、MSH6和PMS2蛋白的抗体进行免疫组化,缺乏一个或多个这些蛋白的表达诊断为dMMR。本研究经本院伦理委员会批准同意,研究前从每位参与者获得书面知情同意书。
2 方法
2.1 临床病理学研究采用免疫组化法检测PLK1在OC组织及邻近正常卵巢组织中的表达水平。组织切片经加热、脱石蜡、复水、过氧化氢浸泡,抑制内源性过氧化物酶活性。在100℃下使用柠檬酸钠缓冲液(pH 6.0)进行抗原修复5 min。然后,用兔多克隆PLK1抗体(Abcam)(稀释1∶200)在4℃下孵育过夜。用PBS清洗切片,并在37℃下与生物素标记的Ⅱ级抗一起孵育30 min。最后,切片用二氨基联苯胺(DAB)和苏木精染色染色。免疫组化法评分由两名病理学家根据染色强度和阳性细胞百分比独立分析。染色强度分别为0(阴性)、1(阳性1+)、2(阳性2+)、3(阳性3+)。细胞百分比分别为1(1%~25%)、2(26%~50%)、3(51%~75%)和4(76%~100%)。染色强度得分乘以阳性细胞百分率(0~12)计算最终染色得分。评分≥6分为PLK1高表达,评分<6分为PLK1低表达。
2.2 细胞系与细胞培养人OC细胞系(OVCAR3、SKOV3、ES2和MCAS)、正常卵巢上皮细胞株HOSEPIC及293T细胞均取自中国科学院典型培养物保藏委员会细胞库。所有细胞系均在含有10%胎牛血清(fetal bovine serum,FBS;GIBCO)、1×105U/L青霉素和100 mg/L链霉素(GIBCO)的RPMI-1640培养液中培养。OVCAR3和SKOV3细胞系均通过5-FU的逐步递增处理,形成耐5-FU的OC细胞系(OVCAR3-5FUres和SKOV3-FUres)。5-FU(Sigma-Aldrich)溶解于二甲基亚砜(Sigma-Aldrich)中,并在实验前储存在避光的密闭容器中。将亲代细胞系OVCAR3和SKOV3暴露于5-FU浓度逐渐增加(1~100μmol/L)的环境中。将5-FU(1μmol/L)加入OVCAR3-5FUres和SKOV3-FUres的培养液中,以维持耐药性。实验前至少2周将细胞保存在无5-FU的培养液中。使用Lipofectamine 2000(Invitrogen)将PLK1重组质粒(Addgene)、PLK1-shRNA慢病毒(sh-PLK1,上海吉玛基因有限公司)转染到OVCAR3、SKOV3、OVCAR3-5FUres和SKOV3-5FUres细胞中。
2.3 细胞活力检测采用CCK-8(Dojindo)测量细胞活力。为了分析PLK1对5-FU治疗的影响,分别将转染PLK1重组质粒、sh-PLK1或阴性对照的细胞用0、2、4、8、16、32、64和128μmol/L 5-FU处理48 h。将CCK-8溶液添加到培养液中,并在37℃和5%CO2下培养1小时。使用微板阅读器(Thermo Fisher)获得样品在450 nm处吸光度(A)值。
2.4 建立稳定表达PLK1的细胞将S-FLAG-streptavidin-binding protein(SFB)三重标记的PLK1表达载体转染293T细胞,在含2 mg/L嘌呤霉素的培养液中培养7 d。然后选择对嘌呤霉素有抗性的无性系进行扩增。Western blot证实SFB-PLK1的表达。
2.5 串联亲和纯化收集50个10 cm2培养皿中稳定表达SFB标记的PLK1的293T细胞,用NETN300缓冲液(50 mmol/L Tris-HCl,pH 8.0,300 mmol/L NaCl,0.5 mmol/L EDTA,0.5%Nonidet P-40)在冰上裂解20 min。用等量的ddH2O稀释上清液,用链霉亲和素偶联珠在4℃孵育2 h。用饱和生物素(Sigma)在NETN100缓冲液中洗脱30 min。洗脱液与s蛋白琼脂糖珠(Millipore)在4℃下孵育2 h,用NETN100缓冲液洗涤3次。与s蛋白琼脂糖珠结合的蛋白用SDS上样缓冲液洗脱,并进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳。切除整个蛋白条带(小于1 cm)并上质谱分析。
2.6 质谱分析将凝胶条带切成1 mm×1 mm×1 mm的小片,凝胶用胰酶消化过夜。用乙腈提取肽段,真空干燥。样品在高效液相色谱溶剂A(2.5%乙腈和0.1%甲酸)中溶解后,装载到Proxeon EASYnLCII液相色谱泵(Thermo Fisher)上。通过增加流动相A的浓度(97.5%乙腈,0.1%甲酸),在30 min内用乙腈梯度(6%~30%)洗脱样品。洗脱后直接通过Orbitrap Elite MS(Thermo Fisher)检测。通过串联质谱对每个肽产生的特定片段离子进行检测、分离和碎片化。使用SEQUEST将蛋白质数据库与获得的片段模式匹配,对质谱进行分析。对半胱氨酸的羧基氨基甲基修饰和蛋氨酸残基的氧化修饰分别为静态修饰和可变修饰。构建目标-诱饵库筛选出的肽段的假发现率(false discovery rate,FDR)<1%。
2.7 免疫共沉淀和Western blot法收集细胞,用NETN300缓冲液在冰上裂解10 min。用相同体积的ddH2O稀释上清液,并在4℃下用链霉亲和素结合珠、2μg指示抗体和40μL蛋白A琼脂糖微球孵育2 h。结合蛋白用SDS负载缓冲液洗脱,经SDS-PAGE分离。所有Western blot实验均按标准程序进行。使用的主要抗体有:人MutS蛋白同系物2(human mutShomolog 2,hMSH2;Abcam)、PLK1和GAPDH(Sigma)。
2.8 Annexin V-FITC/PI凋亡检测在细胞凋亡检测中,将稳定转染PLK1抑制剂、阴性对照或hMSH2 siRNA的OVCAR3-5FUres细胞置于10 cm培养皿中,用5-FU(10μmol/L)处理48 h。然后将细胞胰蛋白酶化并收集到离心管中,以800×g离心3 min,用冷PBS洗涤2次。采用Annexin V-FITC/PI凋亡检测试剂盒(Invitrogen)检测细胞凋亡。处理后取细胞,用冷PBS冲洗。将1×105个细胞重新悬浮在100μL 1×结合缓冲液中,然后添加5μL Annexin V-FITC和1 μL PI工作液。室温孵育15 min后,加入400μL膜联蛋白结合缓冲液并混合,然后使用FACSCalibur流式细胞仪(BDBiosciences)测量细胞凋亡率。
3 统计学处理
采用SPSS 22.0进行统计分析。连续变量表示为均数±标准差(mean±SD),分类变量表示为频率。双尾Studentt检验确定体外实验中各组间的显著性。采用χ2检验分析PLK1与临床病理特征的关系。用Kaplan-Meier法计算生存率和对数秩检验生存曲线之间的差异。采用Spearman秩相关分析评价OVCAR3、SKOV3、OVCAR3-5FUres和SKOV3-5FUres细胞中PLK1表达与IC50的关系。以P<0.05为差异有统计学意义。
结 果
1 PLK1在OC中高表达及其与临床病理特征的关系
与HOSEP1C细胞相比,在OC细胞系中,PLK1水平显著上调(P<0.01),见图1A。在大多数OC组织中,PLK1表达较癌旁组织显著上调(P<0.05),见图1B。图1C显示了免疫组化分析PLK1在OC组织中低表达和高表达的典型图片。Kaplan-Meier分析显示,PLK1高表达OC患者的平均存活时间显著低于PLK1低表达OC患者(P<0.01),见图1D。OC中PLK1水平的升高与FIGO分期、肿瘤分级、dMMR等临床病理特征显著正相关(P<0.05),见表1。
2 PLK1在5-FU耐药OC细胞系中上调,并降低对5-FU的敏感性
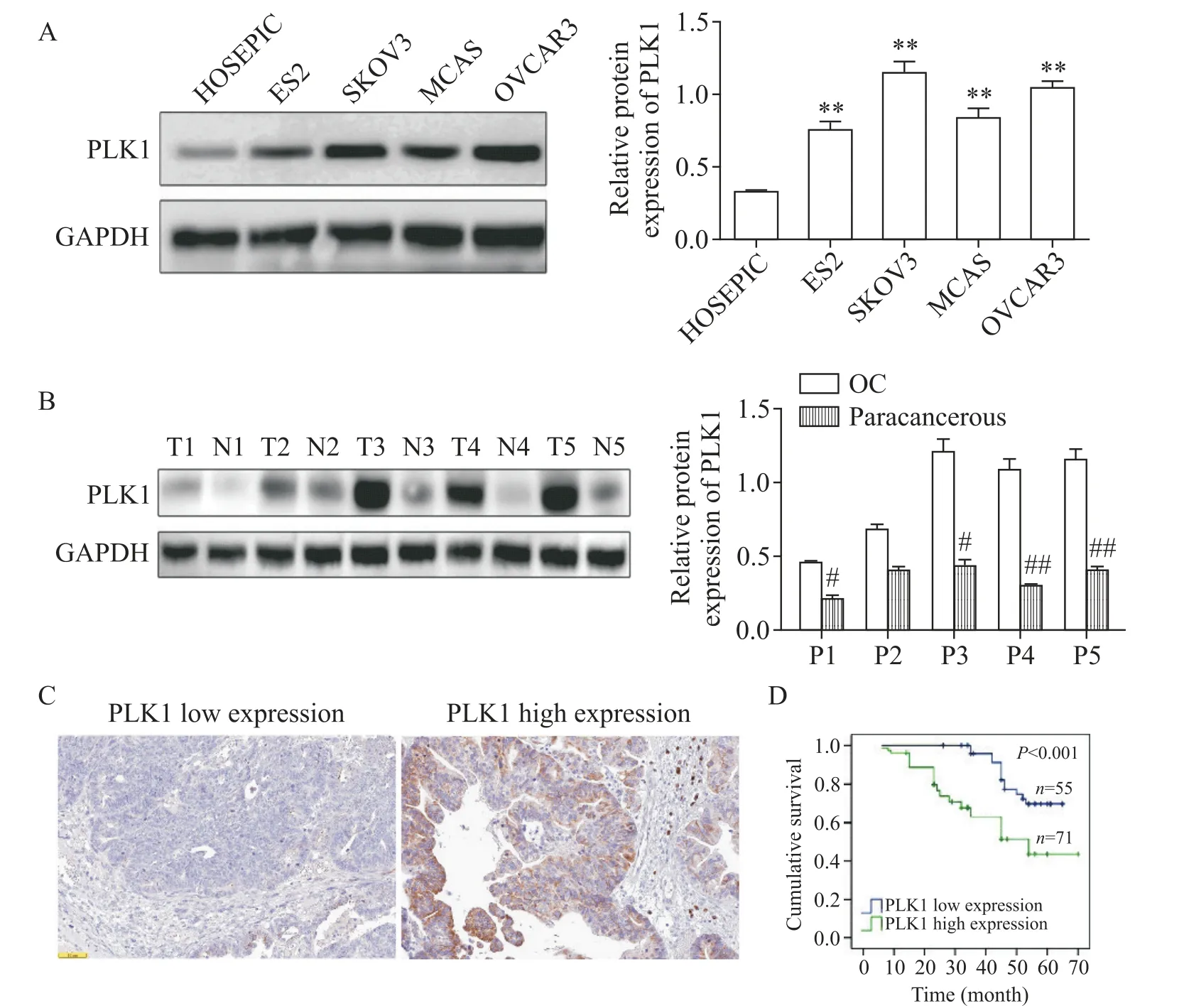
Figure 1.The expression of PLK1 is up-regulated in OCcells and tissues,which is related to the overall survival rate of OCpatients.A:Western blot was used to detect PLK1 protein expression in human OC cell lines(ES2,SKOV3,MCAS,OVCAR3)and normal ovarian epithelial cell line HOSEPIC(n=3).B:Western blot was used to detect the expression of PLK1 in OC tissue and paracancerous tissue.T:tumor tissue;N:paracancerous tissue;P:paired tissue(n=5).C:the typical pictures of low and high expression of PLK1 in OCtissues were analyzed by immunohistochemistry(n=126).D:Kaplan-Meier survival analysis of OC patients with high or low PLK1 expression(n=126).Scale bar=50μm.Mean±SD.**P<0.01 vs HOSEPICgroup;#P<0.05,##P<0.01 vs OCgroup.图1 PLK1在OC细胞和组织中的表达上调,与OC患者的总体生存率相关
与正常OVCAR3和SKOV3细胞相比,OVCAR3-5FUres和SKOV3-5FUres细胞中PLK1表达均显著上调(P<0.01),见图2。为了探讨PLK1在OC细胞5-FU耐药中的生物学作用,采用CCK-8法计算5-FU的IC50值(5-FU降低细胞活力50%的浓度),其中5-FU对SKOV3细胞的IC50为(10.45±0.61)μmol/L,对SKOV3-5FUres细 胞 为(39.89±1.89)μmol/L,对OVCAR3细胞为(7.34±0.36)μmol/L,对OVCAR3-5FUres细胞为(48.45±2.88)μmol/L。各细胞系中PLK1的表达与5-FU的IC50值呈正相关(r=0.997,P=0.008),见图3A。为了证实5-FU耐药与PLK1表达之间的关系,将OVCAR3-5FUres和SKOV3-5FUres转染sh-PLK1或阴性对照(sh-NC),然后用浓度增加的5-FU(0、2、4、8、16、32、64和128μmol/L)处理细胞48 h。CCK-8结果显示,与阴性对照细胞相比,转染sh-PLK1的细胞活力显著降低(P<0.05),见图3B、C。相比之下,转染PLK1重组质粒的OVCAR3和SKOV3细胞的活力显著高于对照细胞(P<0.05),见图3D、E。
3 PLK 1与hMSH2相互作用
为了深入了解PLK1在OC细胞中的作用,我们建立了稳定表达SFB标记PLK1的293T细胞,并进行了串联亲和纯化和质谱分析,其中hMSH2是鉴定的最丰富的蛋白质之一(图4A及表2),表明PLK1可能与癌细胞中的hMSH2有功能联系。我们用外显亲和力检测了串联蛋白的相互作用,可见SFB标记的PLK1与HA标记的hMSH2相互作用(图4B)。共聚焦显微镜分析还显示,SFB标记的PLK1与HA标记的hMSH2共定位(图4C)。
4 PLK1通过靶向hMSH2促进细胞凋亡
所有的细胞均用10μmol/L 5-FU或相同体积的DMSO作为对照,孵育48 h。结果显示,转染sh-PLK1的OVCAR3-5FUres细胞的凋亡率显著高于相应的阴性对照(sh-NC)细胞(P<0.01);在不同处理组中,转染sh-PLK1和5-FU处理的OVCAR3-5FUres细胞凋亡率最高;此外,hMSH2基因敲除使sh-PLK1转染的OVCAR3-5FUres细胞的凋亡率降低(P<0.01),见图5。
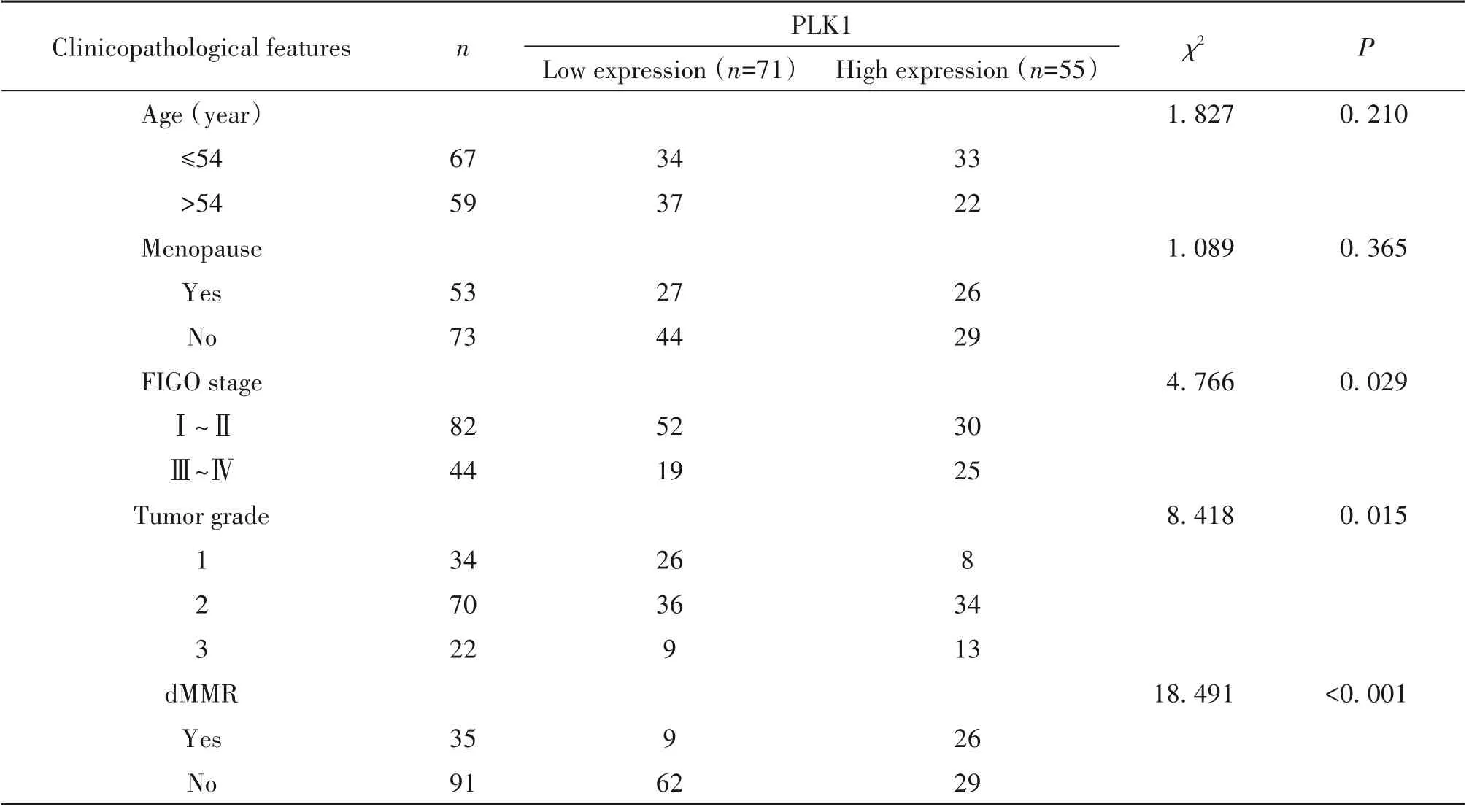
表1 PLK 1蛋白表达水平与临床病理特征相关Table 1.Correlation between PLK1 protein expression and clinicopathological features
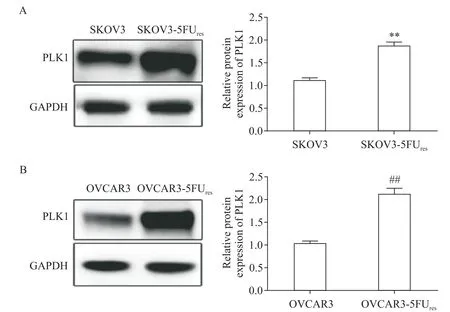
Figure 2.The relative expression of PLK1 in 5-FU-sensitive and-resistant SKOV3 cells(A)and OVCAR3 cells(B)was detected by Western blot.Mean±SD.n=3.**P<0.01 vs SKOV3 group;##P<0.01 vs OVCAR3 group.图2 Western blot检测PLK 1在5-FU敏感和耐药的SKOV3细胞、OVCAR3细胞中的相对表达
讨 论
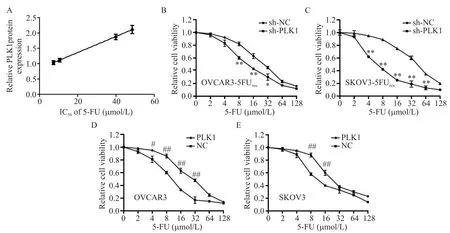
Figure 3.PLK1 reduces the sensitivity of OCcells to 5-FU.A:Spearman rank correlation analysis was used to evaluate the relationship between PLK1 expression and IC50 of 5-FU in OVCAR3,SKOV3,OVCAR3-5FUres and SKOV3-5FUres cells;B and C:CCK-8 assay was used to detect the activity of 5-Fu-resistant OCcells transfected with sh-PLK1 or negative control;D and E:CCK-8 assay was used to determine the viability of OCcells transfected with PLK1 or negative control.Mean±SD.n=3.*P<0.05,**P<0.01 vs sh-NCgroup;#P<0.05,##P<0.01 vs NCgroup.图3 PLK1降低OC细胞对5-FU的敏感性
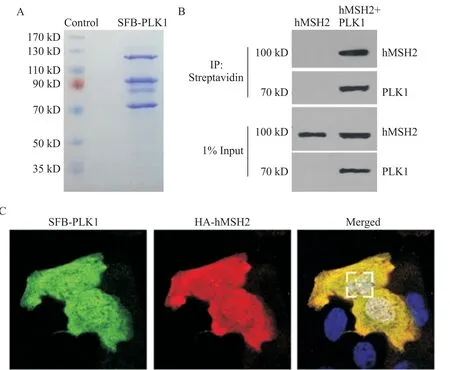
Figure 4.PLK1 interacted with hMSH2.A:293T cells stably expressing either the vector control or SFB-tagged PLK1 were used for tandem affinity purification;B:co-immunoprecipitation analysis of SFB-tagged PLK1 and HA-tagged hMSH2 in 293T cells;C:confocal microscopic analysis of SFB-tagged PLK1 and HA-tagged hMSH2 in 293Tcells.n=3.图4 PLK1与hMSH2相互作用
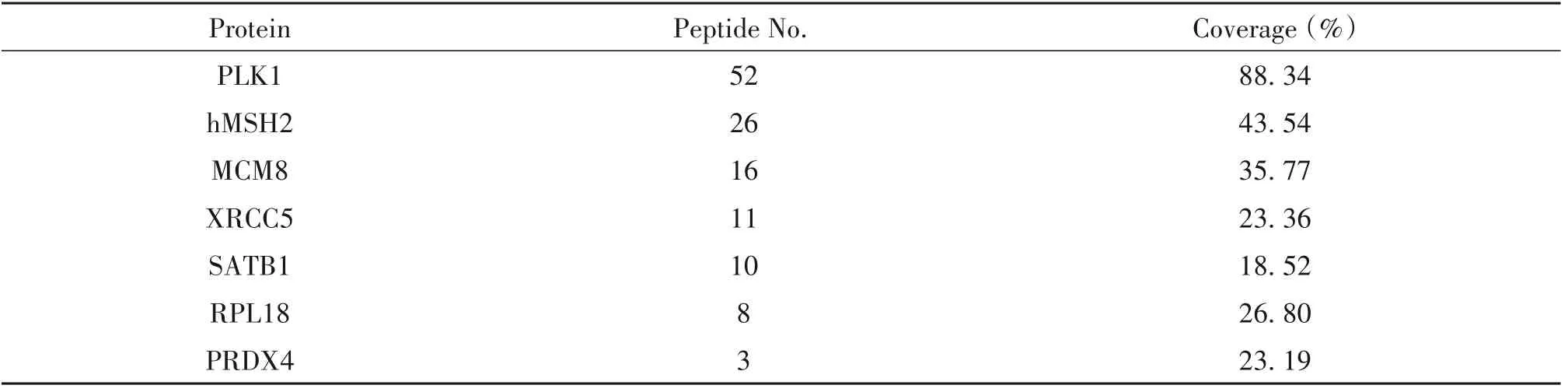
表2 质谱鉴定与PLK 1相互作用的蛋白Table 2.Identification of proteins interacting with PLK1 by mass spectrometry
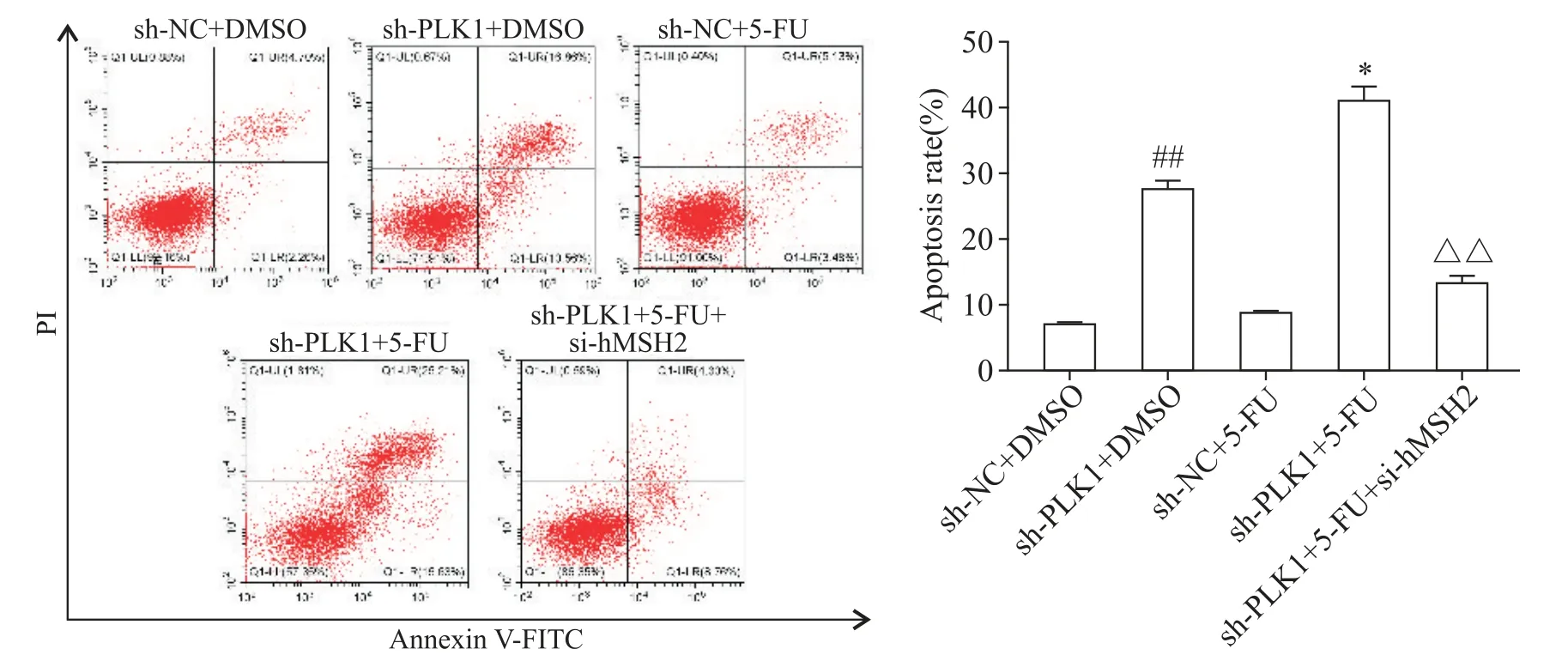
Figure 5.Down-regulation of PLK1 increased the sensitivity of OVCAR3-5FUres cells to 5-FU by targeting hMSH2.Mean±SD.n=3.##P<0.01 vs sh-NC+DMSOgroup;*P<0.05 vs sh-PLK1+DMSOgroup;△△P<0.01 vs sh-PLK1+5-FUgroup.图5 PLK1表达降低通过靶向hMSH2增加OVCAR3-5FUres细胞对5-FU的敏感性
已经证实PLK1在许多不同的肿瘤类型中过度表达,并且干扰PLK1的功能会导致细胞周期停滞和凋亡[8-9]。在这项研究中,我们检测PLK1在OC细胞和肿瘤组织中均上调,并且高水平的PLK1蛋白显著缩短了OC患者的总生存期。此外,降低PLK1表达通过直接靶向hMSH2,提高了体外OC细胞对5-FU治疗的敏感性。化疗耐药是OC患者预后不良的主要原因,尤其是对基于5-FU的辅助治疗反应微弱或完全不起作用的dMMR状态的OC患者。最近一些数据表明,MMR系统与化疗耐药相关;当MMR系统出现功能性错误或缺陷时,修复过程失败,未修复的突变分散在整个基因组中,导致肿瘤相关基因的突变,出现化疗耐药[7]。识别和修复DNA错配有利于改善OC患者的肿瘤预后。因此,我们认为PLK1是改善dMMR OC患者化疗耐药的一个有价值的靶点。先前的研究表明PLK1的异常表达参与了包括OC在内的一些肿瘤的恶性过程[10-13]。研究证实,PLK1在OC组织中显著上调,并通过激活Wnt途径和增加相关转录因子c-Myc和Nanog来影响OC细胞的重编程[14]。然而,PLK1与5-FU耐药之间的关联在OC中仍然是未知的。本研究显示PLK1在5-FU耐药的OC细胞系中上调。此外,我们检测PLK1与dMMR状态呈正相关。总的来说,这些数据表明PLK1在肿瘤MMR中起着潜在的调控作用。
多项的证据表明,表观遗传改变可能在OC化疗抵抗中起重要作用[15]。在哺乳动物中,MMR基因不仅在DNA复制和修复中起着关键作用,而且在DNA损伤信号和随后的细胞凋亡中也起着关键作用[3]。由于化疗是众多癌症治疗中DNA损伤的主要成分,MMR蛋白的丢失使细胞对DNA损伤因子产生抵抗力[7]。Ding等[16]报告,MLH1过表达可以使OC细胞对顺铂诱导死亡敏感。Jia等[17]揭示了上皮性卵巢癌中PMS2的表达受到Akt的翻译后调控,进一步支持MMR系统对铂诱导的细胞凋亡至关重要。本研究借助串联亲和纯化和质谱分析支持了hMSH2是PLK1在OC细胞中的结合蛋白。hMSH2本身[18]或作为hMSH2-hMSH6复合物[3]可识别化疗药物引起的特定DNA损伤。此外,hMSH2可与ATR相互作用,并将其招募到DNA损伤部位,进一步激活一系列凋亡蛋白,导致细胞凋亡[19]。因此,hMSH2在OC的耐药中起重要作用。本研究显示,hMSH2基因敲除逆转了PLK1抑制剂的功能。这些结果表明PLK1通过下调hMSH2来增强OC细胞对5-FU的抗性。
综上所述,PLK1可能成为dMMR OC的一个有希望的治疗靶点,抑制PLK1表达通过靶向hMSH2提高了OC细胞对5-FU的敏感性。因此,PLK1抑制剂可能与化疗药物联合用于OC治疗。
- 中国病理生理杂志的其它文章
- ERK信号通路介导的EP300过表达在苯肾上腺素诱导小鼠心肌细胞肥大中的作用*
- 益肾通络方对大鼠勃起功能障碍及NO-cGMP通路的影响*
- 静脉注射SCAD重组腺病毒减轻自发性高血压大鼠心肌肥厚和纤维化*
- Thioredoxin-interacting protein contributesto cardiac fibrosisby elevating oxidative stress in cardiac fibroblasts*
- 延髓头端腹内侧部NADPH氧化酶2激活导致活性氧簇释放在皮肤/肌肉切开和牵拉引起的慢性术后疼痛中的作用*
- 干扰海马spastin表达通过抑制突触传递介导小鼠认知功能障碍*

