延髓头端腹内侧部NADPH氧化酶2激活导致活性氧簇释放在皮肤/肌肉切开和牵拉引起的慢性术后疼痛中的作用*
代娟丽,杨 涛,魏绪红
(1华中科技大学协和深圳医院神经内科,广东深圳518052;2中山大学生理教研室,疼痛研究中心,广东广州510080;3中山大学附属第二医院麻醉科,广东广州510120)
慢性术后疼痛(chronic postoperative pain,CPSP)是在临床中长期面临但一直没有引起人们重视和解决的问题之一。据报道,普通手术如甲状腺手术或开胸手术后,约10%~50%的患者会产生CPSP,即在手术过后2个月,在排除了慢性感染、慢性肿瘤复发等情况下,手术切口部位的持续性疼痛。CPSP持续时间可达数年,对身体健康及日常活动等具有显著有害的影响[1-2],因此预防或治疗CPSP非常有必要。虽然经过了广泛的研究,但CPSP的机制仍不清楚。据报道,由隐神经支配的大腿皮肤/肌肉切开和牵拉(skin/muscle incision and retraction,SMIR)在远离手术部位的后爪上产生了异常机械性疼痛[3];更重要的是,相应部位的隐神经并没有发生脱髓鞘,也没有神经纤维数目的减少[3-4],提示CPSP的发展涉及到更多相关原因。延髓头端腹内侧部(rostral ventromedial medulla,RVM)由中缝大核(nucleus raphe magnus,NRM)、网状巨细胞核(nucleus reticularis gigantocellularis,NGC)和网状巨细胞核α部(nucleus reticularis gigantocellularis pars alpha)组成,接受来自中脑导水管的信息输入,并下行传递至脊髓背角的痛觉传递神经元[5]。RVM是下行易化系统的一个重要核团。研究表明,在病理性疼痛状态下,RVM中的5-羟色胺(5-hydroxytryptamine,5-HT)神经元可被激活,然后释放5-HT到脊髓,从而参与中枢敏化的发展和维持[6-7]。阻断RVM的下行易化作用减轻了病理性疼痛。
活性氧簇(reactive oxygen species,ROS),如O2-和H2O2,可以与一氧化氮等形成过氧化亚硝酸盐,因而对蛋白和DNA具有过氧化作用。研究表明,ROS在神经病理性疼痛的产生中起着关键作用[8-9]。ROS水平在神经病理性疼痛时升高[10];系统给予ROS清除剂可以减轻脊神经结扎引起的痛过敏[11]并抑制NMDA受体亚基NR1的磷酸化[12]。NADPH氧化酶(NADPH oxidase,NOX)的催化亚基gp91phox(NOX2)和调节亚基p22phox在细胞膜上形成异二聚体,同时受到一些胞浆分子(p47phox、p67phox、p40phox及Rac蛋白)的调节。NOX是体内ROS的主要来源,也是体内唯一直接产生ROS的酶[13]。研究表明,在外周神经损伤或强直刺激后,脊髓背角NOX2在慢性疼痛的产生中起着关键作用[14-15],但RVM内NOX2-ROS在CPSP中的作用尚不清楚。因此,本研究拟观察SMIR导致的病理性疼痛大鼠RVM内NOX2及ROS生成的情况,并进一步观察抑制NOX2激活或清除ROS对SMIR诱导的痛觉过敏及对RVM和脊髓背角5-HT含量的影响,以此明确RVM内NOX2来源的ROS是否通过促进5-HT向脊髓的释放来参与CPSP的发生发展。
材料和方法
1 实验动物
成年雄性Sprague-Dawley(SD)大鼠,体质量220~250 g,由中山大学北校区实验动物中心(国家级动物实验中心)提供。于室温(22.0±0.5)℃、湿度55%±10%、12 h光照-黑暗循环、安静环境下单笼饲养,自由饮水摄食。随机进行如下分组:(1)假手术组及SMIR(1 d和7 d)组,进行行为学机械痛敏检测及NOX2和8-羟基脱氧鸟苷(8-hydroxyguanine,8-OHdG)免疫荧光染色半定量分析;假手术组、SMIR组、SMIR+术前RVM内注射NOX2阻断肽(gp91dstat)组、SMIR+术前RVM内注射无序肽(scrambled dstat)组、SMIR+术后RVM内注射gp91ds-tat组、SMIR+术后RVM内注射scrambled ds-tat组、SMIR+RVM注射ROS清除剂N-叔丁基-α-苯基硝酮(N-tert-butyl-αphenylnitrone,PBN)组和SMIR+RVM内注射生理盐水组,进行行为学测试及5-HT测定。每组各5只。
2 方法
2.1 SMIR模型手术根据以前的研究进行SMIR手 术[3-4]。简单地说,将动物用异氟烷(1.5%~2.5%)、30%N2O和70%O2的混合物麻醉后,在左侧后大腿内侧靠近隐静脉大约4mm处的皮肤表面做一个1.5~2.0 cm的切口,暴露出大腿肌肉。然后在大腿肌肉浅层做一个7~10 mm切口,插入微型解剖牵开器(Biomedical Research Instruments)。将大腿的皮肤和浅表肌肉牵拉2 cm并持续1 h。假手术组只进行皮肤切开但不牵拉。
2.2 50%机械刺激撤足阈值的测定按照魏绪红等[16]和汪小芳等[17]的方法进行手术同侧后肢(左侧)50%机械刺激撤足阈值的测定。实验前1周将动物放入若干有机玻璃箱内以熟悉测试环境,每天1次,每次20 min。该有机玻璃箱下方有一金属网,网格大小为0.8 cm×0.8 cm,用以将von Frey hair伸入其内测定动物撤足阈值。正式实验前先将动物放入玻璃箱内等待安静,待动物充分安静(洗脸、搔抓、直立、行走等活动完全停止)又不处于睡眠状态时,开始进行测定。实验采用Up-Down[4]的方法,选用8根强度呈对数递增的von Frey hair(0.41、0.70、1.20、2.04、3.63、5.50、8.51和15.14 g)垂直向上施加于动物后肢足心部进行机械性刺激,待纤毛弯曲,停留6~8 s,若动物出现撤足,则选择相邻递减的刺激强度给予刺激,若动物未撤足,则选择相邻递增的刺激强度给予刺激。每次刺激之间至少间隔5 min。按照所述方法依次使用不同强度的纤毛进行测试,待动物出现撤足反应后再连续进行5次刺激(一开始的撤足反应也算为1次)便终止测试。以第1个转折点的前一点为起始点,连续6次的刺激结果为最终的撤足反应模式,被认为是该动物的撤足反应模式。根据测试结果,通过计算公式可求出50%机械刺激撤足阈值。50%机械刺激撤足阈值(g)=10Xf+kδ/10 000。公式中Xf为最末次测试von Frey hair的对数值;K值可根据撤足反应模式查表得出[5];δ值为8根von Frey hair间对数差值的均值。
2.3 立体定位注射药物为了将药物显微注射入RVM,我们使用戊巴比妥钠麻醉大鼠,并将其置于大鼠脑立体定位仪上。在头皮正中沿矢状缝做一个2 cm的切口,用30%双氧水将下面的结缔组织腐蚀溶解,清晰暴露颅骨。再次确保颅骨表面水平。接下来,用定位仪在目标核团的颅骨表面投影处进行标记,再任选该点周围任意3点处进行标记,用钻孔仪对这标记的4点分别进行开钻,将骨质钻开,目的核团投影点的钻孔深度以露出颅骨下方的硬脑膜为准,而其余3点不宜钻穿,用螺丝刀将3个螺丝钉固定于该3点内防止后续风干的牙托水与颅骨表面分离,只留下目的核团投影点用于导管的插入。此时,用定位仪小心将导管垂直插入颅骨下方目标核团内,注意应提前确保坐标无误(RVM坐标为:前囟向后-10.5 mm,中线旁开0 mm,脑表面腹侧-8.5 mm)。插入后维持导管不动,将牙托水和牙托粉以适当比例混合后均匀浇入导管和螺丝四周,待其风干后缓慢旋开导管帽以确保导管帽未与导管粘连,便于后续旋开给药。术后3 d内每天1次为大鼠肌注青霉素以防颅内感染。手术后允许动物恢复7 d。用连接至30号规格注射器的汉密尔顿注射器进行药物注射操作。在2 min内将1μL药物注入RVM。将注射针(比导管突出1 mm)保持在位60 s以使药物从尖端完全扩散。行为学实验结束后,行冰冻切片(50μm)在显微镜下进行注射位点的观察。
2.4 动物灌注及标本处理使用乌拉坦(1.5 g/kg,ip)麻醉大鼠后固定于水槽上方的板上,剪开胸腔,经主动脉快速灌注常温(25℃)的肝素化生理盐水300 mL,随后灌注4%的4℃多聚甲醛300 mL,前5 min快速灌注,后30 min慢速滴注。灌注完毕后解剖动物,取出整个大脑组织(包括大脑、小脑和脑干)后,放入4%的多聚甲醛中后固定3 h,随后转入30%蔗糖中脱水3 d。经蔗糖脱水后的标本取出进行冰冻横向切片(LEICA CM1900),厚度为40μm,收集于装有0.01 mol/L PBS的24孔板内,4℃短暂保存。
2.5 免疫荧光组织化学染色收集脑冰冻切片,6孔板装0.01 mol/L PBS洗片5 min×3次,室温(25℃)下封闭液封闭1 h。封闭后弃去封闭液,加入含有待检测蛋白抗体的Ⅰ抗稀释液(NOX2,1∶100,Affinity Biosciences;8-OHdG,1∶200,Abcam),置于4℃摇床过夜(>12 h)。吸去Ⅰ抗,使用0.01 mol/L PBS洗片10 min×3次,随后加入针对Ⅰ抗来源的荧光Ⅱ抗,室温(25℃)下避光摇床上慢摇1 h。弃去Ⅱ抗,0.01 mol/L PBS洗片10 min×3次。使用的Ⅰ抗为抗神经元特异性核蛋白(neuron-specific nuclear protein,NeuN;神经元标志物)抗体(1∶300;Chemicon,MAB377)、抗胶质细胞原纤维酸性蛋白(glial fibrillary acidic protein,GFAP;星型胶质细胞标志物)抗体(1∶500;Chemicon,MAB360)、抗离子钙结合衔接分子1(ionized calcium-binding adapter molecule 1,Iba1;小胶质细胞标志物)抗体(1∶500;Abcam,aa221790)和抗OX-42(小胶质细胞标志物)抗体(1∶200;Chemicon,CBL1512)。随机挑选处理好的切片贴于载玻片上,使用抗荧光淬灭剂封片后立即于荧光显微镜(LEICA DFC350 FX Camera)下观察并拍照保存。采用ImageJ计算荧光光密度。
2.6 ELISA迅速提取脊髓背角L3处和脑组织RVM部分,在1 mL 1×PBS中均匀化并在-20℃下储存过夜。在进行2次冻融循环以破坏细胞膜后,将匀浆物在5 000×g,4℃离心5 min。首先用BCA法检测样品上清液蛋白浓度。再使用竞争性抑制ELISA方案,用购买的5-HTELISA试剂盒进行样品中5-HT浓度测定(Cat#CSB-E08364r,CUSABIO)。具体为将酶标板设1个空白对照孔、不加任何液体;每个标准点依次各设2孔,每孔加入相应标准品50μL;其余每个检测孔直接加待测标本50μL。检测操作严格按照试剂盒使用说明书进行。用酶标仪在450 nm波长依序测量各孔的吸光度(A值),使用Curve Expert软件制作标准曲线以确定样品中5-HT的浓度,用测得上述5-HT浓度除以样品的蛋白浓度进行归一化处理。
3 统计学处理
使用SPSS 16.0软件进行统计分析。实验结果以均数±标准误(mean±SEM)表示。所有行为学测试结果均采用非参数检验进行分析。同一组大鼠不同测试时间点的数据先用Friedman方差分析(Friedman ANOVA)检验差异,然后再用配对的秩和检验(Wilcoxon matched pairs test)进行分析。两个不同实验组某个时间点的数据比较采用Mann-WhitneyU检验。免疫荧光光密度和ELISA测得的5-HT浓度先用单因素方差分析(one-way ANOVA)处理数据,然后用Tukey法进行多重比较。以P<0.05为差异有统计学意义。
结 果
1 SMIR引起长时间的机械痛敏
行为学测试发现,分别与手术前基础值或假手术组比较,SMIR后大鼠同侧后肢50%机械刺激撤足阈值于手术后1 d显著下降(P<0.01),7 d降至最低点(P<0.01),显著性差异一直保持至术后3周左右,术后32 d已恢复至基础水平,见图1。
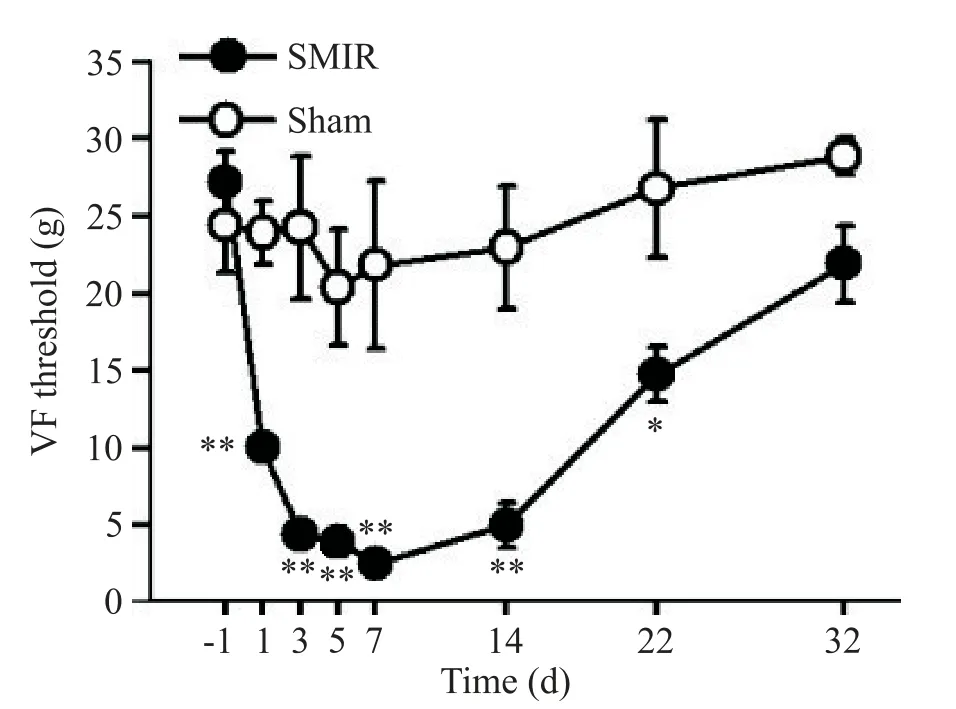
Figure 1.The effect of skin/muscle incision and retraction(SMIR)on the 50%paw withdrawal threshold[von Frey(VF)hair test].Compared with-1 d(1 d before surgery),the 50%paw withdrawal threshold was significantly decreased for 22 d in SMIR rats but not in sham rats.Mean±SEM.n=5.*P<0.05,**P<0.01 vs-1 d.图1 皮肤/肌肉切开和牵拉1 h对大鼠50%机械刺激撤足阈值的影响
2 SMIR引起RVM内NOX2表达上调
免疫组化染色结果显示,SMIR可引起RVM内NOX2的表达上调。如图2所示,与假手术组相比,SMIR术后1 d时NOX2的表达已显著上调,7 d时进一步上调。免疫荧光双染结果显示,上调的NOX2(7 d时)主要位于NeuN标记的神经元(图3A~C),但也部分存在于Iba1标记的小胶质细胞(图3D~F)及GFAP标记的星形胶质细胞(图3G~I)内。
3 预先RVM内给予NOX2阻断肽可防止SMIR引起机械痛敏,术后给药则无效
为了研究NOX2表达上调与疼痛的产生及维持之间的关系,我们在RVM内微量注射(注射位点见图4C)NOX2阻断肽gp91ds-tat(50μmol/L,共1μL,SMIR术前30 min开始,每天1次,共3次),结果发现gp91ds-tat可阻断SMIR引起的机械痛敏,而给予相同剂量的scrambled ds-tat则无作用(图4A)。在另外5只大鼠,SMIR后7 d开始于RVM内微量注射gp91ds-tat(每天1次,共3次),但对已经降低的机械痛阈无显著影响(图4B)。ELISA实验进一步发现,SMIR后7 d RVM和脊髓背角内5-HT的含量显著增加,术前给予gp91ds-tat显著降低了RVM和脊髓背角内5-HT的含量,而术后给予gp91ds-tat对RVM和脊髓背角内5-HT的释放均无显著影响,见图5。无论是术前还是术后给予scrambled ds-tat对SMIR引起的5-HT释放增加均无显著影响,见图5。这些结果提示SMIR后RVM内NOX2的激活可能通过引起脊髓内5-HT释放增多进而引起慢性疼痛。
4 RVM内给予gp91ds-tat可抑制SMIR引起RVM内8-OHd G生成增多
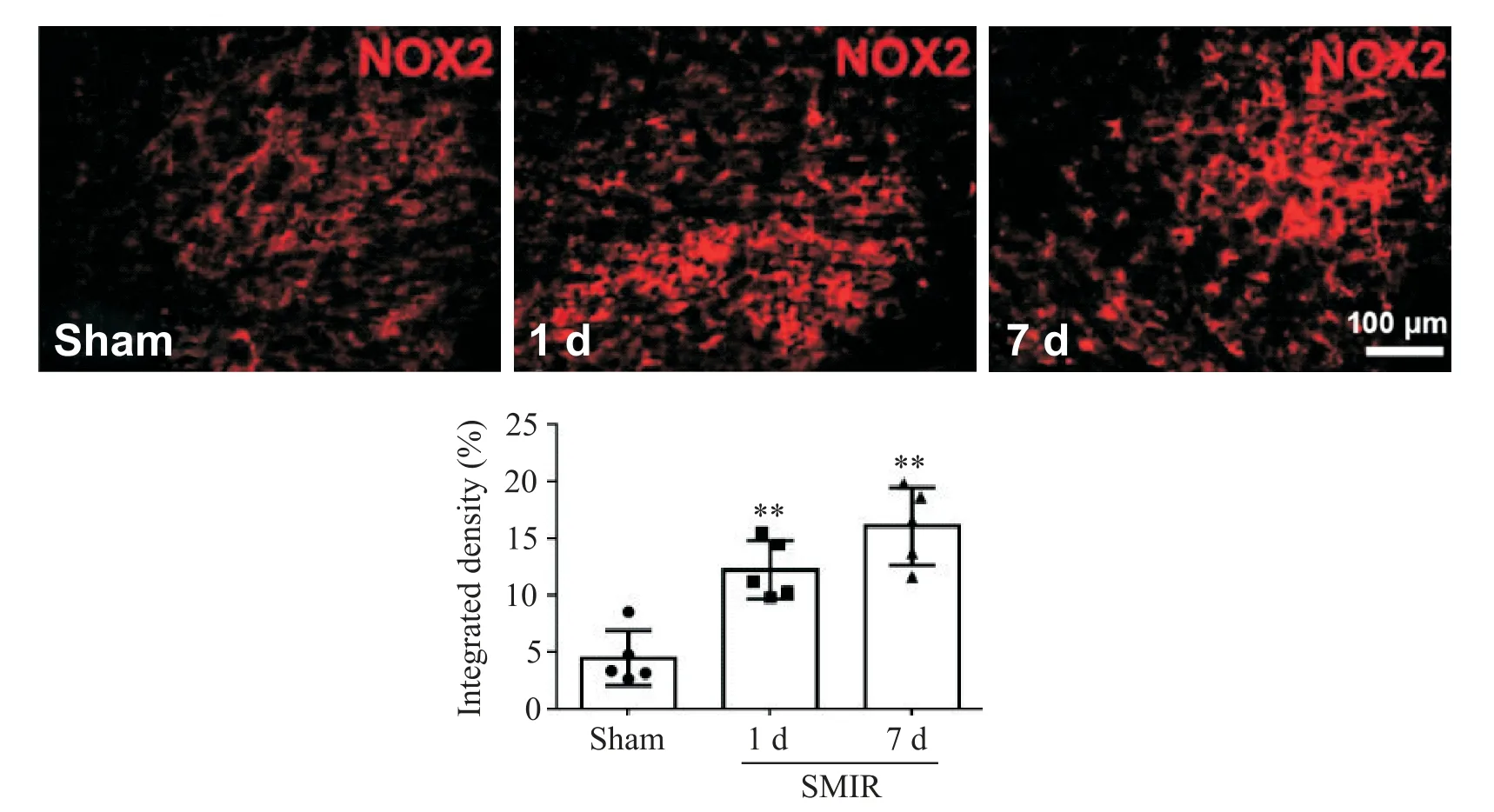
图2 皮肤/肌肉切开牵拉对RVM内NOX2表达的影响
8-OHdG是ROS攻击DNA分子中的鸟嘌呤碱基第8位碳原子而产生的一种氧化性加合物。我们进一步观察了SMIR后不同时点8-OHdG的水平以反映RVM内ROS的生成情况。结果显示,与sham组(图6A)相比,8-OHdG在SMIR术后1 d即显著增加(图6B、D),7 d时进一步增加(图6C、D)。免疫荧光双染实验发现,SMIR 7 d时,8-OHdG在神经元和星形胶质细胞上大量存在(图6E、F),但小胶质细胞与8-OHdG共染的比例较少(图6G)。与scrambled ds-tat组相比,RVM内预先给予gp91ds-tat(SMIR术前30 min开始,每天1次,共3次)可显著降低SMIR后7 d时RVM内8-OHdG的水平(图6I~K)。
5 SMIR术后RVM内注射ROS清除剂可短暂抑制机械痛敏
SMIR术后7 d RVM内注射一次ROS清除剂PBN可以短暂翻转已经产生的机械痛敏。如图7所示,与术前相比,SMIR大鼠的50%机械刺激撤足阈值在术后7 d时已显著下降,提示产生了机械痛敏;此时给予PBN(100 mmol/L,1μL)可使大鼠的50%机械刺激撤足阈值在给药后8 h及12 h显著升高,提示RVM内ROS的持续产生是维持SMIR后慢性疼痛的关键因素。
讨 论
有研究显示CPSP主要由手术期间外周神经的损伤产生[2]。然而,近期研究表明,SMIR模型在没有神经损伤的情况产生了CPSP[3]。我们之前的研究也表明,SMIR模型并没有导致隐神经的退行性变,也没有引起L3背根神经节神经元的损伤,相反的,SMIR引起的脊髓背角小胶质细胞及星型胶质细胞的激活,并参与CPSP的产生[4],提示中枢神经系统的改变也参与CPSP的产生。本研究发现SMIR可引起RVM内神经元及小胶质细胞内NOX2表达上调,阻断NOX2的表达可防止SMIR引起的机械痛敏并可减少RVM及脊髓背角内下行性易化递质5-HT的含量,SMIR后已经引起机械痛敏的情况下再阻断NOX2的作用则无效。其次,该研究进一步证实SMIR可导致RVM内ROS释放增多,术后7 d于RVM内注射ROS清除剂PBN可减轻已经产生的机械痛敏。
RVM的下行易化已被认为在维持神经病理性疼痛[18-19]中起重要作用。研究显示,RVM的5-HT能神经元特异性地投射到脊髓背角的浅层[20]。众所周知,脊髓背角浅层神经元接受外周伤害性刺激信息,并将信号整合后进一步上传给丘脑,因此RVM内5-HT具有下行性调制痛觉信号上传的作用是有解剖学基础的。5-HT最初被认为具有抑制疼痛的作用,是痛觉下行抑制系统释放的重要递质之一[21],然而后来逐渐发现在外周神经损伤后其具有易化疼痛的作用[22]。相同部位释放的同一递质为何能产生不同的作用呢?这可能是因为病理性疼痛状态时脊髓背角痛觉传递神经元5-HT受体亚型的表达发生了变化,从而导致神经元的高兴奋性。在正常情况下,5-HT1A受体在中缝核和脊髓等区域高表达,RVM释放的5-HT主要发挥了突触前抑制的作用,即通过与脊髓背角内痛觉初级传入纤维末梢上的5-HT1A受体结合,抑制了初级传入纤维末梢向脊髓释放谷氨酸,从而抑制了痛觉信号从脊髓向丘脑的传递。而在病理性情况下,由于脊髓非选择性配体门控通道5-HT3受体表达上调[23],5-HT与5-HT3受体结合,对钠、钾和钙离子通透性增加,并最终导致神经元的高兴奋性并诱导痛觉过敏[23-24]。本研究进一步发现SMIR导致脊髓背角5-HT含量增多。本实验采用细胞裂解后测定细胞匀浆中的5-HT,测定的5-HT既包含了细胞内合成的,也包含了释放到细胞外的。研究发现,脊髓所有的5-HT能传入都来自于脊髓以上结构。虽然中缝核的一小部分5-HT能神经元(其主要支配丘脑、背侧海马、纹状体和皮层)会发出侧枝到脊髓。但脊髓主要的5-HT传入来源于RVM[25]。因此我们认为脊髓的5-HT主要是RVM内5-HT能神经元的轴突末梢所释放。由此推测由RVM起源的5-HT介导的下行性易化作用在SMIR后可能增强了,并进一步作用于5-HT3受体参与了异常性机械疼痛的发生发展。
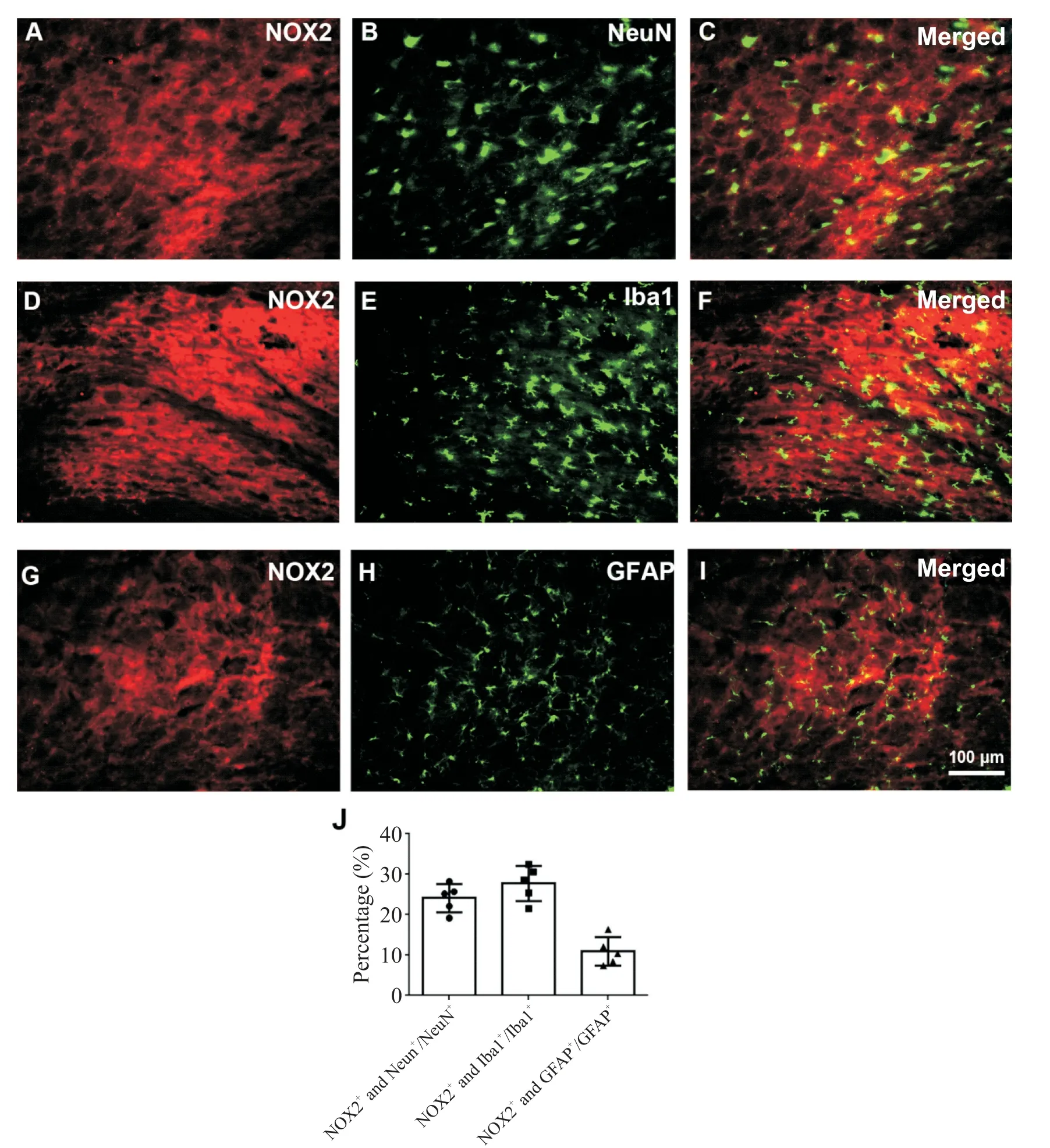
Figure 3.The cell types expressing NOX2 at 7 d after SMIR.Mean±SEM.n=3.图3 SMIR后RVM内表达NOX2的细胞类型
研究表明RVM内给予Tph-2-shRNA以特异性地耗竭内源性5-HT可以防止动物在神经损伤后出现慢性疼痛[6],而鞘内注射选择性5-HT3受体激动剂SR57227可以诱导痛超敏反应[26],这些结果与我们的结果相互印证。也有研究表明,尽管脊神经结扎后5-HT能神经元的数量减少,但剩余的5-HT能神经元可能介导下行易化作用[27]。因此,可以推断来自RVM的5-HT可能通过作用于脊髓的5-HT3受体加剧疼痛超敏反应。
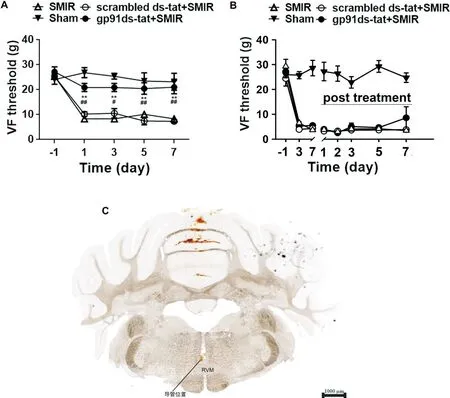
Figure 4.The effect of NOX2 blocking peptide gp91ds-tat on mechanical allodynia.A:microinjection of gp91ds-tat(50μmol/L in 1 μL,started 30 min before SMIR,once daily for 3 times)prevented the development of mechanical allodynia following SMIR,whereas the same dose of scrambled ds-tat had no effect;B:microinjection of gp91ds-tat(50μmol/L in 1μL,started at day 7 after SMIR,once daily for totally 3 days)had no obvious effect on the already decreased 50%paw withdrawal threshold;C:the location of the guide cannula(the black line indicated the tip of the guide cannula;the red circle indicated the RVM,where drug diffused into,as the injection needle was 1 mm longer than the guide cannula).Mean±SEM.n=5.**P<0.01 vs-1 d;#P<0.05,##P<0.01 vs scrambled ds-tat+SMIRgroup.图4 RVM内注射NOX2阻断肽gp91ds-tat对SMIR引起的机械痛敏的影响
尽管RVM释放的5-HT在慢性疼痛中的作用已得到很好的阐明,但5-HT释放增加的机制仍不清楚。在本研究中,我们发现SMIR后NOX2在RVM中上调,RVM内预防性给予NOX2阻断肽可缓解机械痛敏并降低RVM和脊髓背角中的5-HT水平;其次,SMIR可导致细胞内核酸氧化产物8-OHdG表达明显增多,而给予NOX2阻断肽可降低RVM内8-OHdG水平。ROS生成增多可对蛋白和DNA产生过氧化作用,并可诱导TNFα/BDNF等炎症介质释放。RVM的神经元可以分成两种类型,一类具有较宽的动作电位,较负的静息膜电位且对μ受体激动剂不敏感,另外一类具有较窄的动作电位,可能伴有自发的放电,细胞膜上表达MOR且对μ阿片受体激动剂产生超级化反应[28]。在正常情况下,阿片类物质部分地通过减少RVM神经元的GABA信息传递,激活下行抑制系统而产生抑制疼痛的作用,然而在炎症状态下,无论是GABA的输入活动还是GABAA受体的性质都会发生改变,引起GABA能抑制性突触传递功能减弱(去抑制),由此可能导致MOR阳性神经元被特异性的激活(即兴奋性增高),并向脊髓释放5-HT,因而导致下行性易化作用[29]。而炎症可通过抑制RVM内GAD67的转录导致神经元的兴奋性过高[30]。因此我们推测在CPSP产生过程中,NOX2激活所释放的ROS可能通过引起RVM内MOR阳性神经元的GABA抑制性突触传递功能减弱,进而导致MOR阳性神经元兴奋性增高,最终易化脊髓的疼痛信息传递,导致CPSP的产生。我们的研究显示,NOX2及ROS的核酸氧化产物8-OHdG不仅存在于RVM的神经元内,也存在于星形胶质细胞及小胶质细胞内。越来越多的证据表明,外周神经损伤[31-32]后激活的神经胶质细胞可以调节神经元的功能。一旦被激活,胶质细胞可以释放一系列促炎介质,包括细胞因子、NO、COX-2等,这将改变神经元的生存环境。因此,虽然下行易化作用是由神经元释放的神经递质所介导的,但SMIR后RVM中胶质细胞的激活可以改变神经元的生存环境,进而导致其释放5-HT增多。预防性阻断NOX2的激活可能通过抑制RVM的ROS生成而显著减轻CPSP的产生,术后阻断NOX2的激活对已经产生的机械痛敏已经没有作用,这时候虽然抑制NOX2不再产生更多的ROS,但已经产生的ROS不能被清除,并且这些已经产生的ROS可以与NOX1、NOX4等产生正反馈,从而继续产生更多的ROS。因此抑制NOX2虽然可能减少ROS的产生,但并不能消除ROS已经产生的作用。而ROS清除剂则可以更彻底地清除ROS并阻断其作用,因而具有一定的止痛作用,但其效果非常短暂,说明之前ROS的累积作用很难被消除。
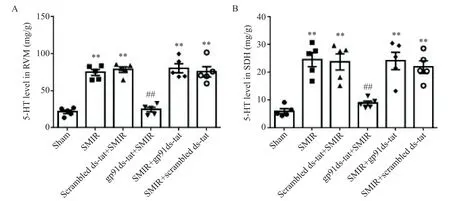
Figure 5.Preemptive but not postoperative application of gp91ds-tat decreased the level of 5-HT in RVM and spinal dorsal horn(SDH)following SMIR.Mean±SEM.n=5.**P<0.01 vs shamgroup;##P<0.01 vs scrambled ds-tat+SMIRgroup.图5 术前或术后给予gp91ds-tat对RVM和脊髓背角内神经递质5-HT含量的影响
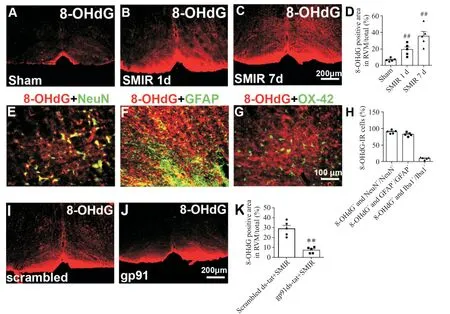
Figure 6.The expression of 8-hydroxyguanine(8-OHdG)in RVM after SMIRand the effect of gp91ds-tat microinjection into RVM on 8-OHdG expression.Compared with sham group(A),8-OHdG was increased at 1 d(B)and 7 d(C)after SMIR.The quantification of 8-OHdG positive area in the 3 groups was shown(D).The 8-OHdG was located in NeuN-labeled neurons(E)and GFAP-labeled astrocytes(F),and to a less extent in OX-42-labeled microglia(G)at 7 d after SMIR.The percentages of 8-OHdG positive cells in neurons,microglia and astrocytes were shown(H).Compared with scrambled-tat+SMIR group(I),preemptive treatment with gp91ds-tat(J)significantly decreased the expression of 8-OHdGin RVM at 7 d after SMIR.The quantification of 8-OHdGpositive area in gp91ds-tat-and scrambled ds-tat-treated SMIRrats was shown(K).Mean±SEM.n=3-5.##P<0.01 vs sham group;**P<0.01 vs scrambled ds-tat+SMIR group.图6 SMIR后8-OHd G在RVM的表达情况及RVM内给予gp91ds-tat对8-OHdG表达的影响
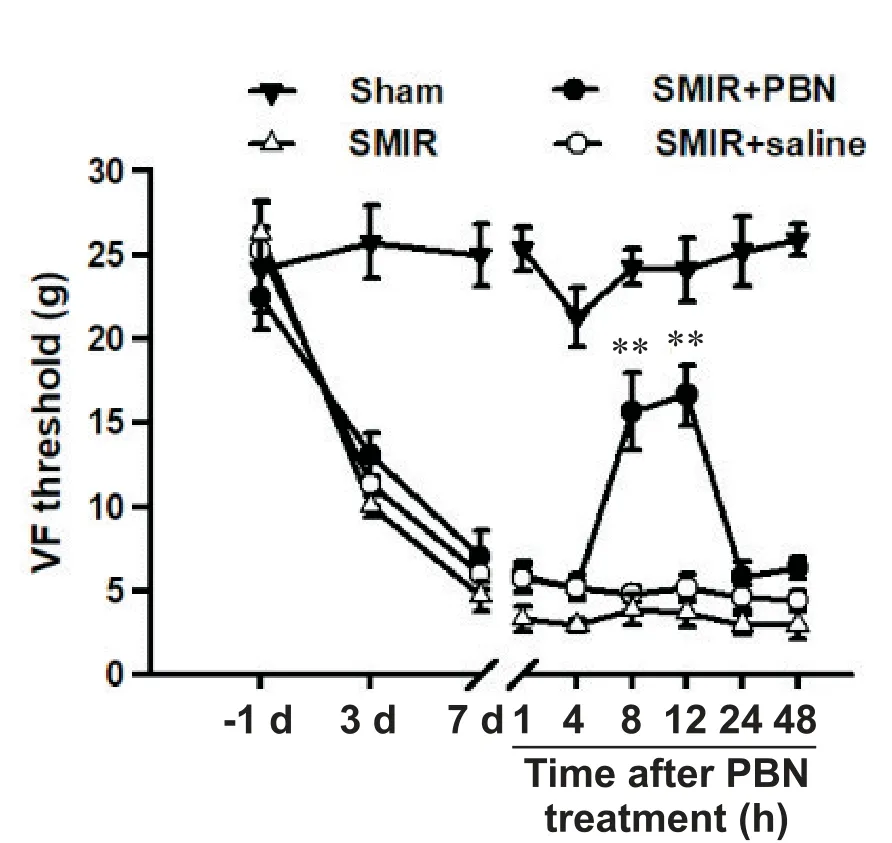
Figure 7.Microinjection of phenyl-N-tert-butylnitrone(PBN)into RVM transiently depressed the already established mechanical allodynia[von Frey(VF)hair test].Mean±SEM.n=6.**P<0.01 vs saline+SMIR group.图7 SMIR后7 d RVM内注射ROS清除剂PBN可短暂减轻已经产生的机械痛敏
综上所述,以RVM内NOX2-ROS途径为靶点的干预措施可能会成为预防CPSP的重要方法。

