静脉注射SCAD重组腺病毒减轻自发性高血压大鼠心肌肥厚和纤维化*
冯静韵,廖英勤,钟小艺,苏永少,马智超,秦 学,潘雪刁,刘培庆,路 静,周四桂△
(1广东药科大学药学院临床药学系,广东广州510006;2中山大学药学院药理与毒理学实验室,广东广州510006)
心脏是长期高血压主要损伤的靶器官之一,主要表现为左心室结构改变和重构,最终导致心力衰竭的发生[1-2]。心肌肥厚和纤维化是心脏重构的重要病理变化[3]。心脏重构代偿期的主要特点是心肌细胞增大,蛋白质合成增强,细胞外基质积累,胎儿心脏基因程序激活[4-5]。临床上主要使用血管紧张素转换酶抑制剂、血管紧张素受体拮抗剂、β受体阻断剂、钙通道阻断剂和降低钠负荷等方法进行降血压治疗,虽然在一定程度上延缓了高血压心肌肥厚和纤维化的发生发展,但并未明显延缓心力衰竭进程[6]。因此,寻找抑制心肌肥厚和纤维化发生发展的药物,从而防治心力衰竭具有十分重要的意义和价值。
短链脂酰辅酶A脱氢酶(short-chain acly-coenzyme A dehydrogenase,SCAD)是脂酰辅酶A脱氢酶家族中一员,可特异性分解短链脂酰辅酶A,是脂肪酸β氧化的第1个限速酶[7-8]。我们首次发现SCAD的表达在自发性高血压大鼠(spontaneously hypertensive rats,SHR)肥厚和纤维化的心肌中明显下调[9]。利用小干扰RNA(small interfering RNA,siRNA)技术敲减原代心肌细胞及心肌成纤维细胞SCAD表达,均可引起心肌细胞病理性肥大、心肌成纤维细胞增殖及胶原合成显著增加,表明SCAD对心肌肥厚和纤维化具有负性调控作用[10-11]。本课题组前期研究表明尾静脉注射SCAD重组腺病毒(SCAD recombinant adenovirus,Ad-SCAD)能逆转SHR高血压血管重构[12]。黄素腺嘌吟二核苷酸(SCAD的辅酶)通过激活SCAD从而有效减轻SHR心肌肥厚和纤维化[13]。然而Ad-SCAD对SHR心肌肥厚和纤维化是否具有治疗作用尚不清楚。本研究以SHR作为高血压心肌肥厚和纤维化模型,采用尾静脉注射Ad-SCAD的方式,探讨SCAD过表达对SHR心脏功能和线粒体能量代谢的影响。
材料和方法
1 动物
18只雄性Wistar大鼠,12周龄,购自南方医科大学动物中心,许可证号为SYXK(粤)2016-0041;18只雄性SHR,12周龄,购自北京维通利华实验动物技术有限公司,许可证号为SCXK(京)2016-0006。
2 主要试剂
Ad-SCAD和GFP载体腺病毒(Ad-GFP)购自汉恒生物技术(上海)有限公司;SYBR Green Real-time PCR Master Mix(DRR420S)购自TaKaRa;兔抗SCAD单克隆抗体(Abcam;1∶1 000);鼠抗GAPDH单克隆抗体(ProteinTech;1∶10 000);兔Ⅱ抗/鼠Ⅱ抗(Sigma;1∶10 000);SCAD酶活性试剂盒购自上海杰美基因医药科技有限公司;羟脯氨酸测定试剂盒购自南京建成生物工程研究所;ATP检测试剂盒购自碧云天生物技术有限公司;大鼠游离脂肪酸ELISA检测试剂盒购自上海酶联生物科技有限公司。所用引物由上海生工生物工程股份有限公司根据设计合成,见表1。
3 主要方法
3.1 实验分组按随机数字表法将动物分为4组(n=9):正常GFP阴性对照(Wistar+Ad-GFP)组、心肌肥厚和纤维化模型GFP阴性对照(SHR+Ad-GFP)组、正常Ad-SCAD给药(Wistar+Ad-SCAD)组及心肌肥厚和纤维化模型Ad-SCAD给药(SHR+Ad-SCAD)组。Ad-SCAD和Ad-GFP给药剂量均为5×1013viral particles·L-1·d-1,持续8周。
3.2 超声心动图以异氟烷麻醉各组大鼠,采用Vevo 2100超高分辨率小动物彩色超声多普勒成像系统实时监测大鼠心功能变化,记录大鼠心脏实时图。取乳头肌切面,探头频率为40 MHz。在二维超声引导下取M超曲线,测定以下指标:舒张末期左室前壁厚度(left ventricular anterior wall thickness at end-diastole,LVAWd)、收缩末期左室前壁厚度(left ventricular anterior wall thickness at end-systole,LVAWs)、舒张末期左室后壁厚度(left ventricular posterior wall thickness at end-diastole,LVPWd)、收缩末期左室后壁厚度(left ventricular posterior wall thickness at end-systole,LVAWs)、左室舒张末期容积(left ventricular end-diastolic volume,LVEDV)、左室收缩末期容积(left ventricular end-systolic volume,LVESV)、左心室舒张末期内径(left ventricular internal dimension at end-diastole,LVIDd)、左心室收缩末期内径(left ventricular internal dimension at end-systole,LVIDs)、左心室射血分数(ejection fraction,EF)和左心室缩短率(fractional shortening,FS)。

表1 引物序列Table 1.The sequences of the primers for RT-qPCR
3.3 动物取材异氟烷麻醉各组大鼠,腹主动脉取血,静置分离血清,液氮处理后-80℃保存。心脏主动脉灌注后取出心脏。部分心脏经4%多聚甲醛固定进行石蜡包埋切片,部分心脏组织分装、液氮处理后-80℃保存为进行后续实验。
3.4 大鼠收缩压及左室重量指数的测定采用无创血压仪(CA-DA Monitor,KENT)测定各组大鼠尾动脉收缩压,Ad-SCAD尾静脉给药前测量1次,之后每2周测量1次,直至第8周结束。取出心脏后,纵切,去除心房及心脏附件,滤纸吸干表面PBS,精密称取心脏重量,左室重量(left ventricular weight,LVW)与体重(body weight,BW)的比值作为左室重量指数。
3.5 心肌组织的形态学检测取出心脏后,心尖与左心耳中点连线纵切,滤纸吸干表面水分,心脏正面观部分用4%多聚甲醛固定后石蜡包埋切片,进行SCAD荧光单标染色、HE染色、麦胚凝集素(wheat germ agglutinin,WGA)染色和天狼星红染色。天狼星红染色后心肌纤维呈淡黄色,胶原纤维呈红色,用于判断大鼠心脏是否出现心肌纤维化及心肌纤维化的程度。
3.6 SCAD酶活性的检测取材后液氮速冻后-80℃保存,第2天进行检查。采用酶标仪测定法检测SCAD酶活性。实验具体步骤严格依据SCAD酶活性检测试剂盒说明书。
3.7 羟脯氨酸含量的测定采用经典酸水解法测定羟脯氨酸含量。实验具体步骤严格依据羟脯氨酸测定试剂盒说明书。
3.8 ATP含量的测定根据萤光酶素催化萤光素发光需要ATP提供能量的原理,检测心脏组织匀浆液的ATP浓度。实验具体步骤严格依据ATP检测试剂盒说明书。
3.9 游离脂肪酸含量的检测利用双抗体夹心法测定大鼠心肌组织和血清的游离脂肪酸含量。实验具体步骤严格依据试剂盒说明书。
3.10 Western blot分析根据组织大小加入适量裂解液,使570 nm下总蛋白吸光度在1.0左右,定量60~80μg,配制10%SDS-PAGE凝胶。电泳,转膜,封闭90 min,Ⅰ抗4℃孵育过夜,Ⅱ抗室温孵育1 h,采用化学发光成像仪进行显影。
3.11 RT-qPCR利用Trizol裂解法提取心肌中总RNA,通过紫外吸收测定法测定RNA在波长260 nm和280 nm的吸收值,获得RNA的浓度并通过A260/A280及A260/A230值判断RNA的纯度。采用RT-PCR试剂盒(TaKaRa)去除gDNA后逆转录合成cDNA。根据SYBR Green试剂盒说明书配制反应体系,进行cDNA的扩增和检测。
4 统计学处理
数据的统计和分析均使用SPSS 21.0统计分析软件。数据均采用均数±标准差(mean±SD)表示。多组间比较采用单因素方差分析及Tukey′st检验进行两两比较。以P<0.05为差异有统计学意义。
结 果
1 各组大鼠心肌SCAD蛋白和mRNA表达水平及酶活性的变化
如图1所示,与Wistar+Ad-GFP组相比,SHR+Ad-GFP组SCAD蛋白和mRNA表达水平及酶活性显著降低(P<0.01),SCAD免疫荧光强度显著减弱(P<0.01),Wistar+Ad-SCAD组SCAD蛋白和mRNA表达水平及酶活性显著升高(P<0.01);与SHR+Ad-GFP组相比,SHR+Ad-SCAD组SCAD蛋白和mRNA表达水平和酶活性显著升高(P<0.01),SCAD免疫荧光强度显著增强(P<0.01)。这表明Ad-SCAD尾静脉注射8周,SCAD基因成功转染进入大鼠心脏并出现过表达。
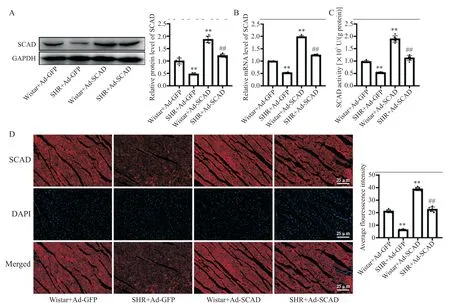
Figure 1.Comparison of SCAD expression and activity in the rats with different treatments.A:the protein expression of SCAD;B:the mRNA expression of SCAD;C:SCAD activity;D:left ventricular SCAD expression measured by immunofluorescence staining.Mean±SD.n=9.**P<0.01 vs Wistar+Ad-GFPgroup;##P<0.01 vs SHR+Ad-GFPgroup.图1 各组大鼠心肌SCAD含量与酶活性的变化
2 各组大鼠收缩压及左室重量指数的比较
研究表明12周龄的SHR大鼠已经出现心肌肥厚和纤维化,可作为心肌肥厚和纤维化疾病模型[13-14]。如图2A所示,与12周龄的Wistar+Ad-GFP组大鼠比较,同周龄的SHR+Ad-GFP组大鼠收缩压显著升高;连续给药8周后,与SHR+Ad-GFP组相比,SHR+Ad-SCAD组收缩压持续降低(P<0.01)。慢性压力过载导致的心肌肥厚以左心室肥厚为主,左心室重量增加是其主要表现,因此,采用左室重量指数(LVW/BW)来评价心肌肥厚情况。如图2B所示,与Wistar+Ad-GFP组相比,SHR+Ad-GFP组左室重量指数显著升高(P<0.01);与SHR+Ad-GFP组相比,SHR+Ad-SCAD组左室重量指数显著降低(P<0.01),表明Ad-SCAD能显著减轻SHR心肌肥厚。
3 各组大鼠超声心动图的比较
如图3所示,与Wistar+Ad-GFP组比较,SHR+Ad-GFP组LVAWd、LVAWs、LVPWd、LVPWs、EF和FS均显著增大(P<0.01),LVEDV、LVSDV、LVIDd和LVIDs均显著减小(P<0.01),即左心室前、后壁出现明显肥厚,左心室内径显著减小,表明20周龄的SHR出现了明显的向心性肥厚;与SHR+Ad-GFP组相比,SHR+Ad-SCAD组LVAWd、LVAWs、LVPWd、LVPWs、EF和FS均显 著 减小,LVEDV、LVSDV、LVIDd和LVIDs均显著增加(P<0.01)。以上结果表明,Ad-SCAD通过上调心肌SCAD表达,显著减轻了SHR心肌肥厚,改善了心脏舒张功能。
4 各组大鼠心脏HE和WGA染色及心肌肥厚标志物mRNA表达水平的比较
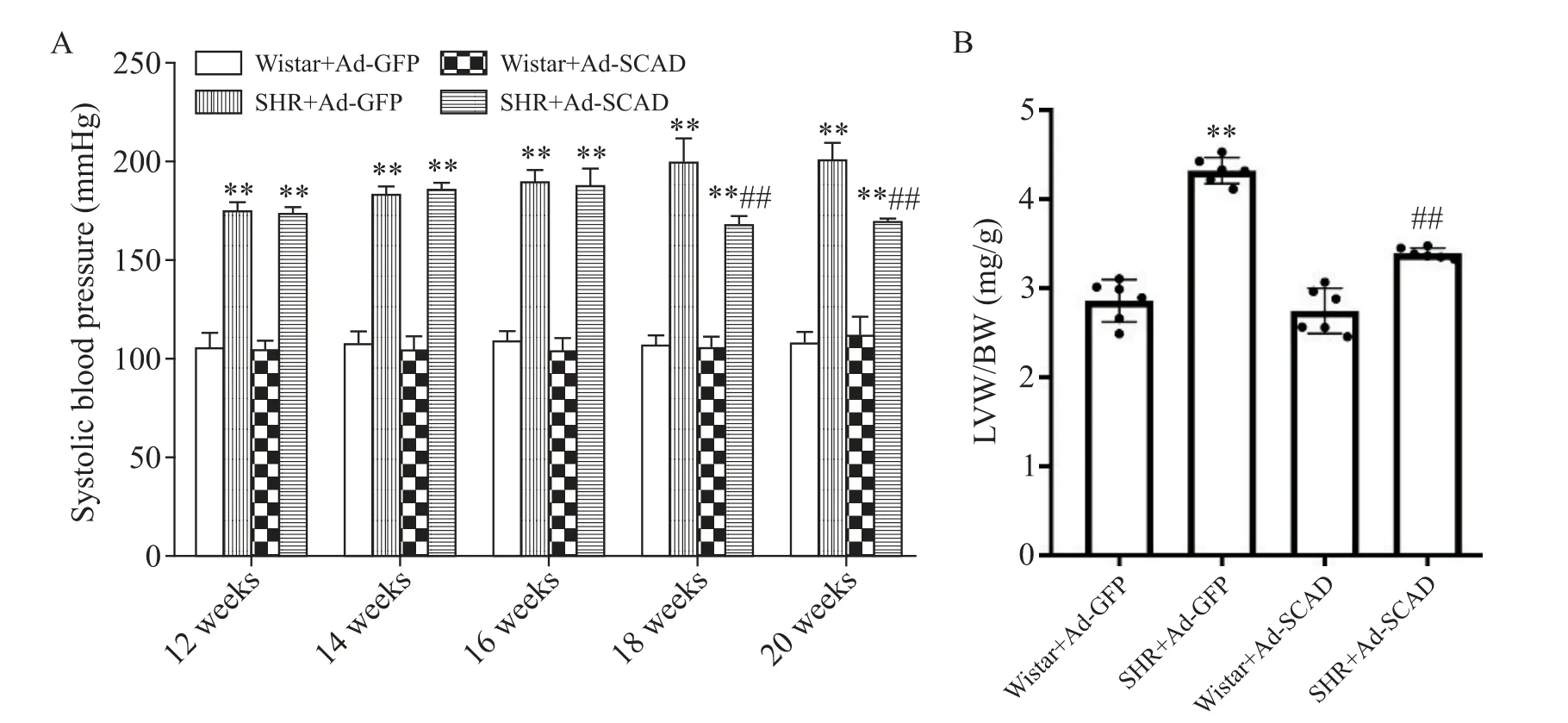
Figure 2.Comparison of systolic blood pressure(A)and left ventricular mass index(B)of the rats in each group.Mean±SD.n=9.**P<0.01 vs Wistar+Ad-GFPgroup;##P<0.01 vs SHR+Ad-GFPgroup.图2 各组大鼠收缩压及左室重量指数的比较
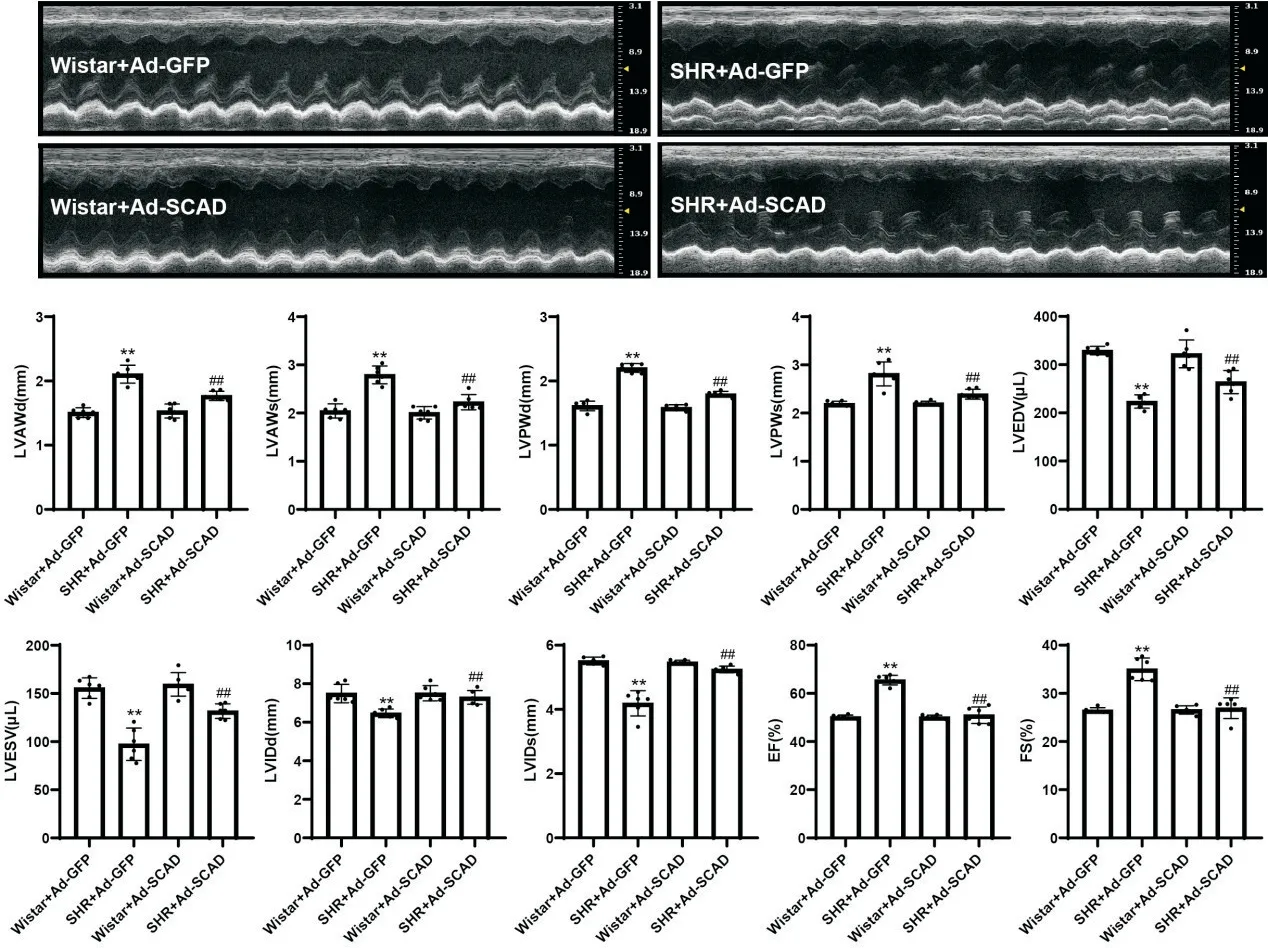
Figure 3.Echocardiographic changes of the rats in each group.Mean±SD.n=9.**P<0.01 vs Wistar+Ad-GFP group;##P<0.01 vs SHR+Ad-GFPgroup.图3 各组大鼠超声心动图的比较
为了进一步观察大鼠左室心肌形态学改变,我们采用HE染色和WGA染色观察大鼠左心室肥厚情况。如图4所示,与Wistar+Ad-GFP组相比,SHR+Ad-GFP组发生了明显的心肌肥厚,心室壁明显增厚,心室腔显著缩小,心肌细胞明显增大,横截面积显著增加(P<0.01),心肌肥厚标志物心房钠尿因子(atrial natriuretic factor,ANF)、脑钠肽(brain natriuretic peptide,BNP)和β-肌球蛋白重链(β-myosin heavy chain,β-MHC)的mRNA表达水平均显著增加(P<0.01);Ad-SCAD治疗8周后,ANF、BNP和β-MHC的mRNA表达水平显著下降(P<0.01),心肌肥厚明显减轻。
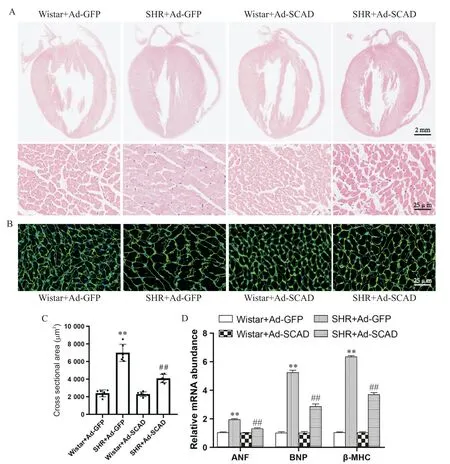
Figure 4.Hematoxylin-eosin(HE)staining(A),wheat germ agglutinin(WGA)staining(B and C)and mRNA levels of myocardial hypertrophy markers(D)of the rats in each group.Mean±SD.n=9.**P<0.01 vs Wistar+Ad-GFP group;##P<0.01 vs SHR+Ad-GFPgroup.图4 各组大鼠心脏HE和WGA染色及心肌肥厚标志物mRNA表达水平的比较
5 各组大鼠心脏天狼星红染色、心肌羟脯氨酸含量及心肌纤维化标志物mRNA表达水平的比较
如图5所示,与Wistar+Ad-GFP组相比,SHR+Ad-GFP组心肌组织胶原纤维大量沉积(P<0.01),羟脯氨酸含量显著增加(P<0.01),心肌纤维化标志物I型胶原(collagen type I,Col I)、III型胶原(collagen type III,Col III)和α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)的mRNA表达水平均显著增加(P<0.01);Ad-SCAD显著减少了SHR心肌组织胶原纤维和羟脯氨酸含量(P<0.01),下调了Col I、Col III和α-SMA的mRNA表达水平(P<0.01)。这表明Ad-SCAD显著抑制SHR心肌纤维化。
6 各组大鼠ATP及游离脂肪酸含量的比较
如图6所示,与Wistar+Ad-GFP组相比,SHR+Ad-GFP组ATP含量显著降低,心肌组织与血清游离脂肪酸含量均显著升高(P<0.01);与SHR+Ad-GFP组相比,SHR+Ad-SCAD组ATP含量显著升高,游离脂肪酸含量均显著降低(P<0.01)。这表明Ad-SCAD显著增强心肌脂肪酸β氧化,增加心脏能量供应,减少游离脂肪酸堆积。
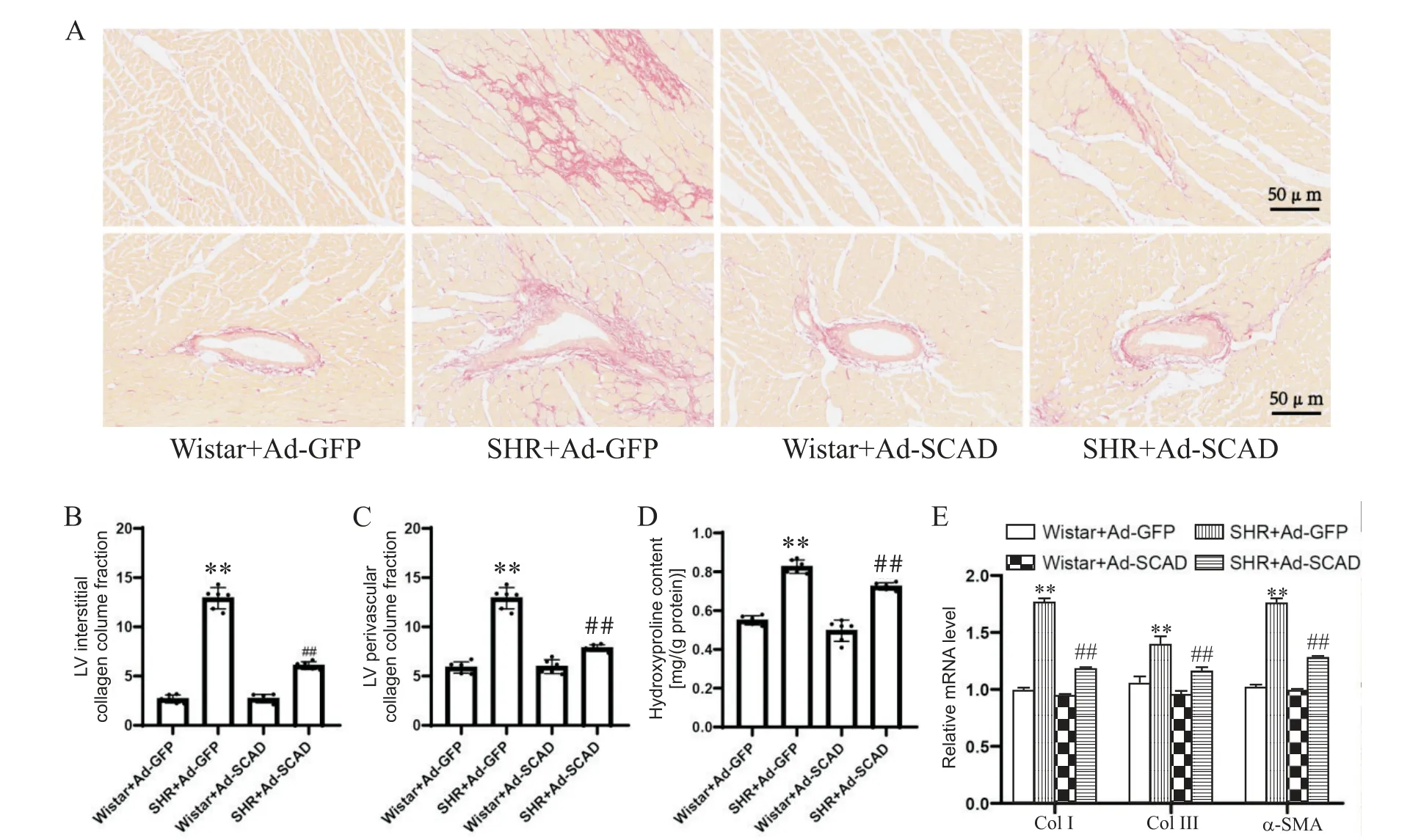
Figure 5.Sirius red staining(A,B and C),cardiac hydroxyproline content(D)and mRNA levels of myocardial fibrosis markers(E)of the rats in each group.Mean±SD.n=9.**P<0.01 vs Wistar+Ad-GFPgroup;##P<0.01 vs SHR+Ad-GFPgroup.图5 各组大鼠心脏天狼星红染色、心肌羟脯氨酸含量及心肌纤维化标志物mRNA表达水平的比较
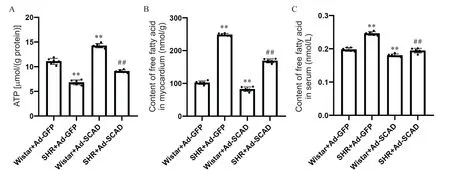
Figure 6.Comparison of ATPand free fatty acid content of the rats in each group.A:ATPcontent;B:free fatty acid content in myocardium;C:free fatty acid content in serum.Mean±SD.n=9.**P<0.01 vs Wistar+Ad-GFPgroup;##P<0.01 vs SHR+Ad-GFPgroup.图6 各组大鼠ATP含量和游离脂肪酸含量的比较
讨 论
研究表明,病理性心肌肥厚是多种心血管疾病发生率和死亡率增加的独立危险因素[15]。长期高血压引起心脏慢性压力过载,导致心脏发生适应性重构,进而发展为病理性心肌肥厚,最终导致心力衰竭发生[2]。心肌纤维化是高血压心肌肥厚由代偿期向失代偿期转变的重要病理过程,是引发心力衰竭的核心环节。
SHR具有高血压遗传背景,高血压自发率为100%,与人类原发性高血压疾病发展进程一致,伴随大鼠周龄增加,其血压不断升高最终维持在200 mmHg以上。长期心脏压力超负荷导致心脏结构蛋白合成增多,左心室质量增加、室壁增厚,进而发生心肌肥厚,病理性心肌肥厚的发生发展往往伴随着心肌纤维化[16-17]。因此,本研究采用SHR作为慢性压力过载导致心肌肥厚和纤维化的动物模型。
大量证据表明,当病理因素导致心肌肥厚时,心肌能源供给由脂肪酸的β氧化转变为以葡萄糖酵解为主,即心肌能量代谢的“胚胎型再演”[18-20]。我们前期研究显示,脂肪酸β氧化酶SCAD表达下调与心肌肥厚和纤维化发展密切相关[10,21-22]。此外,研究表明,自发性高血压大鼠心脏的代谢变化先于心脏功能障碍和左心室肥大,2月龄SHR的心脏代谢产物分析显示丙酮酸,脂肪酰基和支链氨基酸衍生的肉碱含量升高,氧化应激和炎症明显[23]。
腺病毒尾静脉注射是可靠的心脏疾病研究基因给药方式。有报道指出,使用腺相关病毒尾静脉注射实现Ogdhl基因心脏过表达,从而改善心脏功能障碍[24]。通过尾静脉注射腺相关病毒载体在心脏中过表达FGF23显著加剧血管紧张素II诱导的心脏重塑[25]。腺相关病毒介导的心脏AldoA体内敲除挽救了异丙肾上腺素诱导的心脏肥大[26]。为进一步明确SCAD在心肌肥厚和纤维化中的作用,本研究采用Ad-SCAD尾静脉注射给药方式,观察SCAD过表达对SHR心肌肥厚和纤维化的影响。
本研究发现,SHR作为自发性心肌肥厚和纤维化的动物模型,采用Ad-SCAD尾静脉注射治疗8周,实现心肌SCAD过表达,能显著降低SHR血压与左心室重量指数,明显减轻高血压引起的心脏适应性重构、心肌细胞肥大与纤维化,减少胶原沉积。
心肌肥厚是对血流动力学压力或心肌损伤的适应性反应,可使心脏满足对氧的需求增加。心肌肥厚起初是有益的,但最终可导致心肌间质纤维化增加和心室功能下降。代谢变化已成为病理性心肌重塑发展和进展的关键机制。由于心肌是高度氧化的组织,线粒体在维持心脏的最佳性能中起着核心作用[27]。SCAD作为线粒体脂肪酸β氧化第一步反应的限速酶,对线粒体作用,心脏脂肪酸代谢和能量供应起着重要作用。SHR经尾静脉注射Ad-SCAD后,SCAD酶活性显著增加,ATP含量增高,游离脂肪酸含量减少,表明SCAD过表达促进了线粒体脂肪酸β氧化反应。以上结果提示,Ad-SCAD减缓慢性压力过载引起的心肌肥厚与纤维化发展进程,可能与SCAD对心脏能量代谢的积极调节作用和降低氧化应激,进而抑制心肌细胞适应性肥大及胶原产生和沉积的作用密切相关。
综上所述,Ad-SCAD在心肌肥厚和纤维化治疗中可能发挥了至关重要的作用,为心肌肥厚和纤维化治疗提供了一种新的治疗策略。然而,SCAD过表达抑制心肌肥厚和纤维化的作用机制还有待进一步深入研究。
- 中国病理生理杂志的其它文章
- 内皮微粒对血管内皮细胞衰老的影响及机制研究*
- 益肾通络方对大鼠勃起功能障碍及NO-cGMP通路的影响*
- ERK信号通路介导的EP300过表达在苯肾上腺素诱导小鼠心肌细胞肥大中的作用*
- Thioredoxin-interacting protein contributesto cardiac fibrosisby elevating oxidative stress in cardiac fibroblasts*
- 延髓头端腹内侧部NADPH氧化酶2激活导致活性氧簇释放在皮肤/肌肉切开和牵拉引起的慢性术后疼痛中的作用*
- 干扰海马spastin表达通过抑制突触传递介导小鼠认知功能障碍*

