棕榈酰转移酶ZDHHC3对脑缺血-再灌注损伤的影响*
王 萱,陈 莎,邓 玲,刘京东,赵虹霞,刘胜伟,董 志
(重庆医科大学药理学教研室,重庆市生物化学与分子药理学重点实验室,重庆400016)
脑卒中是常见的脑血管疾病,具有高发病率、高致残率和高死亡率的特点,其中缺血性脑卒中约占所有脑卒中的70%~80%[1-2]。尽管卒中后可通过快速溶栓或机械取栓及时恢复缺血区的血氧供应,但该治疗存在明确的时间窗限制,且可能会同时触发一系列复杂的病理机制,对缺血区组织功能产生更有害的影响,即脑缺血-再灌注损伤(cerebral ischemia-reperfusion injury,CIRI)[3-4]。
棕榈酰化是一种可逆的蛋白质翻译后脂质修饰,通过调节神经功能参与多种神经系统疾病的发生和发展[5-6]。棕榈酰转移酶(palmitoyltransferases)或相关底物蛋白酶活性的改变在神经系统疾病的病理生理过程中发挥着重要作用,与人类多种神经精神系统疾病的发病机制有关。多种DHHC酶的棕榈酰化与多巴胺转运体的功能和稳定性[7]、癫痫[8]、亨廷顿蛋白的功能和转运[9]、阿尔茨海默病[10]及在神经系统发育过程中促进端脑神经干细胞增殖密切相关[11]。
棕榈酰转移酶是在蛋白S-酰基转移酶(proteinS-acyltransferases,PATs)家族的富含半胱氨酸结构域(cysteine-rich domain,CRD)中嵌入了一个含天冬氨酸-组氨酸-组氨酸-半胱氨酸(Asp-His-His-Cys)的锌指(zinc finger)结构域,因此也被称作ZDHHC蛋白家族,其中大多数DHHC蛋白具有酰基转移酶活性,可介导蛋白发生棕榈酰化[12]。ZDHHC3,也称高尔基体特异性DHHC型锌指蛋白(Golgi-specific DHHC type zinc finger protein,GODZ)。研究发现,ZDHHC3可通过棕榈酰化调节肿瘤细胞的凋亡、氧化应激和衰老[12];过表达ZDHHC3也可影响人类生长激素的正常分泌[13];ZDHHC3可通过介导GABAA受体的棕榈酰化而抑制突触的正常形态和功能,在抑制性和兴奋性突触及其转运中发挥作用[14]。但ZDHHC3在CIRI中的作用未见报道。
CIRI与许多病理生理机制有关,包括炎症反应、离子通道功能障碍、突触可塑性受损和神经元凋亡等[15]。研究发现,CIRI后缺血脑区神经元的可塑性或重塑受损,大多数中风患者都有神经功能障碍,减轻脑缺血所致突触结构和功能损伤,是改善CIRI后神经损伤的重要途径[16]。突触后致密蛋白95(postsynaptic density protein 95,PSD95)广泛分布于脑组织中,参与突触连接的形成和维持,在调节突触后谷氨酸能神经传递中发挥重要作用,且与损伤后神经修复密切相关[17]。文献报道,PSD95氨基端的3位和5位半胱氨酸末端均可通过可逆的巯酯键被棕榈酰化[18],PSD95棕榈酰化是其稳定聚集于突触后致密物及与其他蛋白相互作用调节突触可塑性变化的重要机制[19]。α-氨基-3-羟基-5-甲基-4-异恶唑丙酸(αamino-3-hydroxy-5-methyl-4-isoxazole propionic acid,AMPA)受体(AMPA receptor,AMPAR)是调节突触可塑性和学习记忆的关键调节因子,在调节突触功能和神经退行性疾病中发挥关键作用。研究报道,AMPAR的GluA1和GluA2亚基自身有2个棕榈酰化位点,可通过调节其棕榈酰化和去棕榈酰化的稳态水平从而调控突触可塑性[20]。因此,本研究拟通过TTC染色、RT-qPCR、HE染色、Western blot和流式细胞术等实验方法,探讨ZDHHC3与CIRI的关系及其可能作用机制。
材料和方法
1 试剂及实验仪器
抗ZDHHC3抗体购自Santa Cruz;抗AMPAR2抗体购自Abcam;抗PSD95、β-actin、Bax和Bcl-2抗体,anti-rabbit IgG(H+L),anti-mouse IgG(H+L),以及荧光Ⅱ抗购自Proteintech;逆转录试剂购自Monad;2×SYBR Green qPCR Master Mix购自Bimake;GP-transfect-Mate转染试剂和pcDNA3.1-ZDHHC3过表达质粒购自吉玛公司。成像仪(Bio-Rad);正置和倒置荧光显微镜(Nikon);高速低温离心机(Thermo);酶标仪(BioTek)。
2 实验方法
2.1 大鼠脑缺血-再灌注模型的建立53只雄性Sprague-Dawley(SD)大鼠,体重260~280 g,6~7周龄,购自重庆医科大学实验动物中心,许可证号为SCXK(渝)2018-0003,随机分为假手术(sham)组和大脑中动脉闭塞(middle cerebral atery occlusion,MCAO)模型组(MCAO组)。采用线栓法建立大鼠右侧MCAO模型。实验遵循重庆医科大学动物伦理委员会的规定。大鼠腹腔注射戊巴比妥钠(40 mg/kg)深度麻醉后,仰卧位固定,钝性分离暴露右侧颈总动脉(common carotid artery,CCA)、颈外动脉(external carotid artery,ECA)和颈内动脉(inernal carotid artery,ICA)。用手术线结扎颈外动脉和颈总动脉远心端后,在颈总动脉近心端处剪一切口,将线栓自颈总动脉插入颈内动脉,有阻力感即停止,固定线栓。缺血造模后90 min,拔栓,结扎血管,恢复血流,缝合皮肤,再灌注24 h进行后续实验。假手术组同样操作,但不插入线栓。动物苏醒后根据改良Longa评分法观察动物的行为表现并进行行为学评分,评分在1~3分纳入后续实验。
2.2 脑梗死体积测定大鼠造模再灌注24 h后,采用4%水合氯醛麻醉处死,冰上断头取脑,-20℃放置1 h,连续冠状切片。加入2%的TTC染液,37℃水浴避光正、反面分别染色15 min,4%多聚甲醛固定,拍照,使用Image-Pro Plus软件计算脑梗死体积。
2.3 HE染色法脑组织经心脏灌注后用4%多聚甲醛固定、脱水、浸蜡、包埋和切片,常规HE染色后,中性树脂封片,正置显微镜下观察脑组织的病理形态结构改变。
2.4 RT-qPCR采用Trizol试剂,从大鼠大脑皮层、海马和PC12细胞中提取总RNA,测定浓度后反转录为cDNA。以β-actin为内参照,在荧光定量PCR仪进行定量PCR。引物由上海生工公司合成,序列见表1。
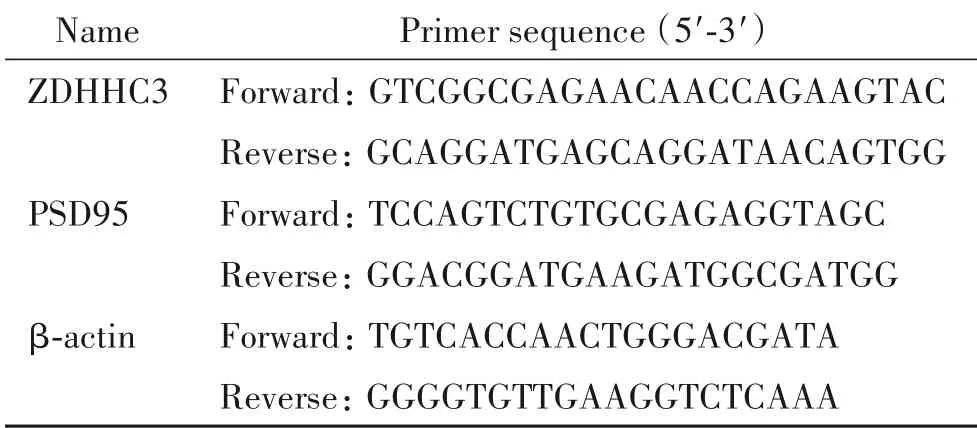
表1 RT-qPCR引物序列Table 1.The primer sequences for RT-qPCR
2.5 免疫荧光双标实验石蜡切片在室温下干燥10 min,4%多聚甲醛浸泡15 min,PBS洗涤后,37℃、0.3%Triton X-100通透30 min。PBS洗涤,山羊血清37℃封闭1 h。加入鼠抗ZDHHC3抗体(1∶500稀释)、兔抗NeuN抗体(1∶100稀释)和兔抗胶质细胞原纤维酸性蛋白(glial fibrillary acidic protein,GFAP)抗体(1∶500稀释),4℃过夜,PBS洗涤。37℃在混合异硫氰酸荧光素标记的IgG中(1∶500稀释)避光孵育60 min。PBS洗涤,甘油固定切片,倒置荧光显微镜观察荧光图像。
2.6 Western blot实验样品加入RIPA裂解液,同时按比例加入蛋白酶抑制剂和磷酸酶抑制剂(RIPA∶PMSF∶磷酸酶抑制剂=100∶1∶2),冰上充分匀浆裂解。静置30 min,4℃、12 000 r/min离心15 min,取上清液,再加入上样缓冲液。经10%SDS-PAGE分离后,转移到PVDF膜。5%脱脂奶粉封闭2 h,加入Ⅰ抗(1∶1 000稀释)4℃孵育过夜。TBST溶液洗膜7 min×3次,加入辣根过氧化物酶标记的Ⅱ抗(1∶4 000稀释),室温孵育2 h。用ECL发光液在化学发光凝胶成像系统(Bio-Rad)上显影,运用Image Lab软件进行图像采集分析。
2.7 细胞氧糖剥夺/复氧(oxygen-glucose deprivation/reoxygenation,OGD/R)及细胞转染PC12细胞传代培养密度至80%~90%时,弃去培养液,PBS清洗2次,更换无糖DMEM培养基后,放入三气细胞培养箱(94%N2、5%CO2、1%O2、37℃)2 h后取出,换为含5%FBS、10%马血清、5%双抗的DMEM培养基,并转移至普通细胞培养箱中,孵育12 h和24 h后收集细胞检测mRNA和蛋白表达。细胞传代培养密度达到60%~80%时,胰酶消化收集细胞并铺至6孔板中,待完全贴壁后按照转染试剂说明书转染ZDHHC3过表达质粒,转染6~12 h后更换无糖培养基进行OGD,复氧24 h后收集细胞检测mRNA和蛋白表达。
2.8 MTT法检测细胞活力将培养的PC12细胞接种于96孔培养板(每孔5×103个),细胞OGD/R造模24 h后,避光,每孔加入5 g/L MTT(20μL)孵育4 h;弃去孔内液体,每孔加入200μL DMSO,摇床振荡15 min溶解底部结晶,酶标仪检测570 nm波长处吸光度,计算细胞活力。
2.9 流式细胞术检测细胞凋亡用不含EDTA的0.25%胰酶消化各组细胞,1 000 r/min离心5 min,弃去上清,用预冷的PBS洗涤细胞2次,1 000 r/min离心5 min,弃掉PBS,加入适量PBS重悬。参照试剂盒,用流式细胞仪检测细胞凋亡率。
3 统计学处理
使用GraphPad Prism 5.0进行统计分析。实验数据以均数±标准误(mean±SEM)表示。两组比较采用t检验;多重比较采用单因素方差分析后行Tukey检验。以P<0.05为差异有统计学意义。
结 果
1 MCAO模型建立情况
采用MCAO法建立脑缺血-再灌注模型,与sham组相比,MCAO组大鼠脑梗死体积增加,神经行为学评分增加,肉眼观察出现脑水肿(图1A、B)。HE染色后镜下可见sham组大鼠大脑皮层和海马CA2区组织结构清晰完整,神经细胞胞浆丰富无红染,胞核居中,核仁清楚,细胞周围间隙致密无水肿;MCAO组中细胞排列稀疏,间质疏松水肿,细胞胞浆浓缩红染,胞核皱缩,部分出现空泡(图1C、D)。这些结果表示成功建立脑缺血-再灌注模型,且MCAO大鼠会出现严重的神经功能缺损和细胞死亡的病理现象。
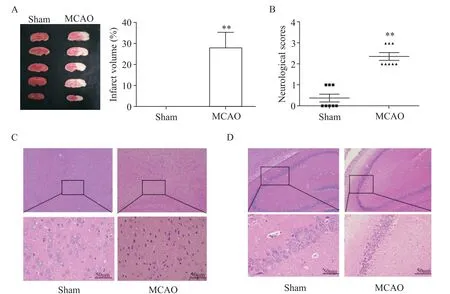
Figure 1.TTCstaining and HE staining were used to detect the pathological changes of MCAOrats.A:representative images of TTC staining of brain sections and quantification of infarct size(n=5);B:neurological score were estimated after 24 h of reperfusion(n=8);C:representative images of histopathological assay of rats in cortex(n=3,×100,×400);D:representative images of histopathological assay of rats in hippocampal CA2 region(n=3,×100,×400).Mean±SEM.**P<0.01 vs sham group.图1 TTC和HE染色检测大脑中动脉闭塞大鼠的病理改变
2 ZDHHC3蛋白在大鼠脑组织中的定位
免疫荧光双标实验结果显示,在正常大鼠脑组织皮层(图2A)和海马CA2区(图2B),绿色荧光蛋白GFP-ZDHHC3在神经元细胞膜和细胞质中均有表达。ZDHHC3与红色NeuN(成熟神经元的标记物)细胞核内重合,而与红色GFAP(星形胶质细胞标记物)不重合。
3 ZDHHC3和PSD95在MCAO大鼠模型中的mRNA和蛋白表达下降
RT-qPCR结果(图3A)显示,与sham组相比,MCAO大鼠大脑皮层和海马组织中ZDHHC3和PSD95的mRNA表达水平均显著降低(P<0.05或P<0.01)。Western blot结果(图3B)显示,与sham组相比,MCAO大鼠大脑皮层和海马组织中ZDHHC3和PSD95的蛋白表达水平显著降低(P<0.05或P<0.01)。这些结果说明,在MCAO大鼠中ZDHHC3和相关底物PSD95的mRNA和蛋白表达均较sham组显著下降。
4 ZDHHC3和PSD95在PC12细胞OGD/R损伤后mRNA和蛋白表达下降
RT-qPCR结果(图4A)显示,与对照组相比,在PC12细胞中,ZDHHC3和PSD95的mRNA表达水平在复氧12 h和24 h后呈下降趋势(P<0.05),且复氧24 h后下降更为明显(P<0.01);Western blot结果(图4B)显示,ZDHHC3和PSD95的蛋白表达水平在复氧24 h后降低更为明显(P<0.01),同时AMPAR2的蛋白水平也下降(P<0.05或P<0.01)。
5 转染ZDHHC3过表达质粒可增加PC12细胞的活力
MTT实验结果表明,OGD复氧24 h后,细胞受到损伤,活力下降(P<0.01);过表达ZDHHC3后,相对OGD/R 24 h,细胞活性有所增加(P<0.01),见图5。
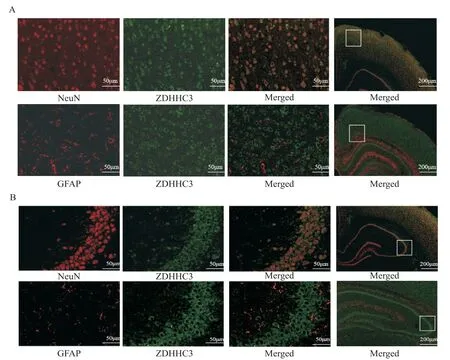
Figure 2.Double-labeled immunofluorescence of ZDHHC3 in the cortex(A)and hippocampal CA2 region(B)of the rats.ZDHHC3 colocalized with NeuN,but did not colocalize with GFAP.图2 免疫荧光双标检测ZDHHC3在大鼠脑组织中的表达位置
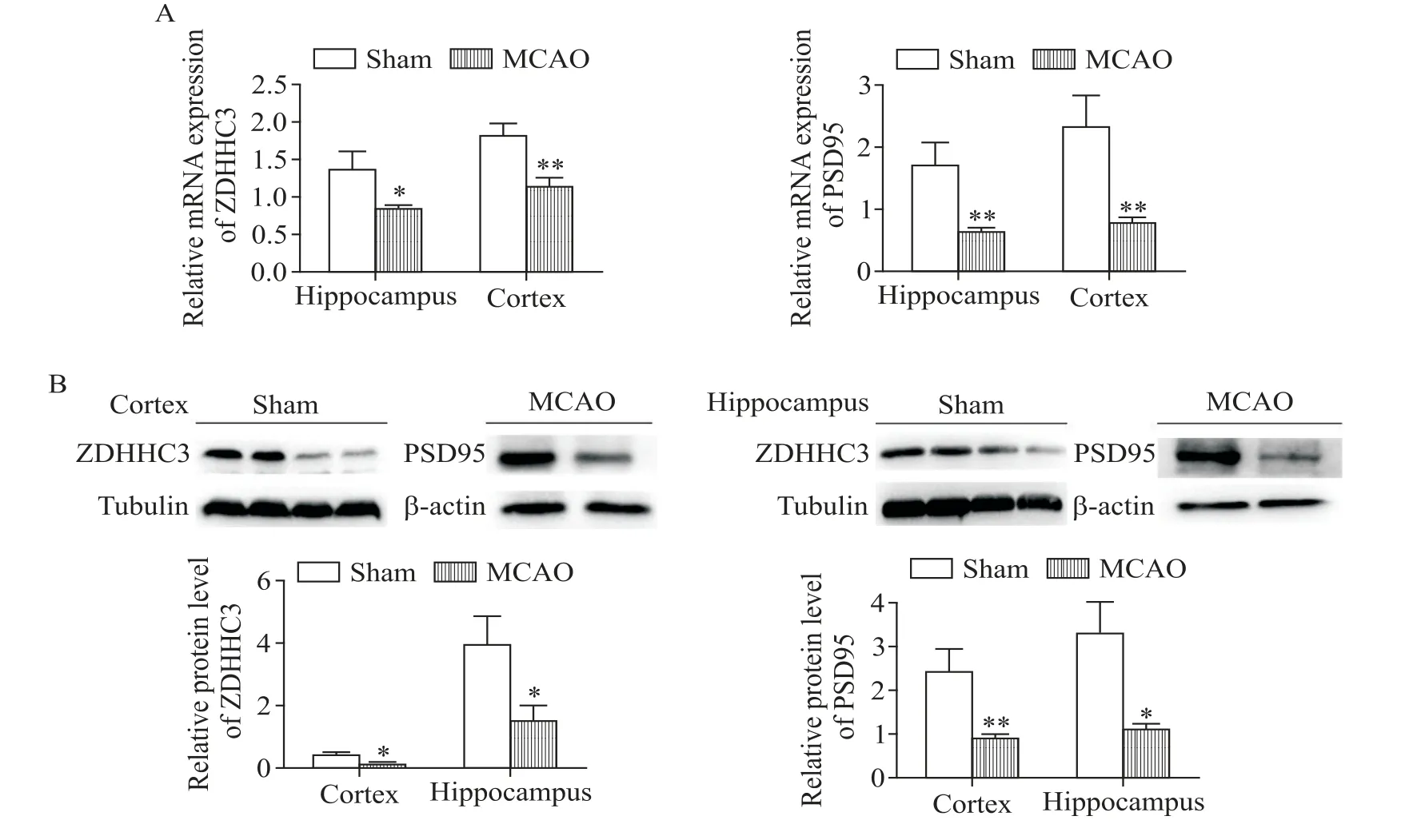
Figure 3.The mRNA and protein levels of ZDHHC3 and PSD95 in the cortex and hippocampus of MCAOrats.A:the mRNA levels of ZDHHC3 and PSD95 in the cortex and hippocampus of MCAO rats were decreased compared with sham group;B:the protein levels of ZDHHC3 and PSD95 were decreased in the cortex and hippocampus of MCAO rats compared with sham group.Mean±SEM.n=3.*P<0.05,**P<0.01 vs shamgroup.图3 RT-qPCR和Western blot检测ZDHHC3和PSD95在大鼠脑组织中的表达
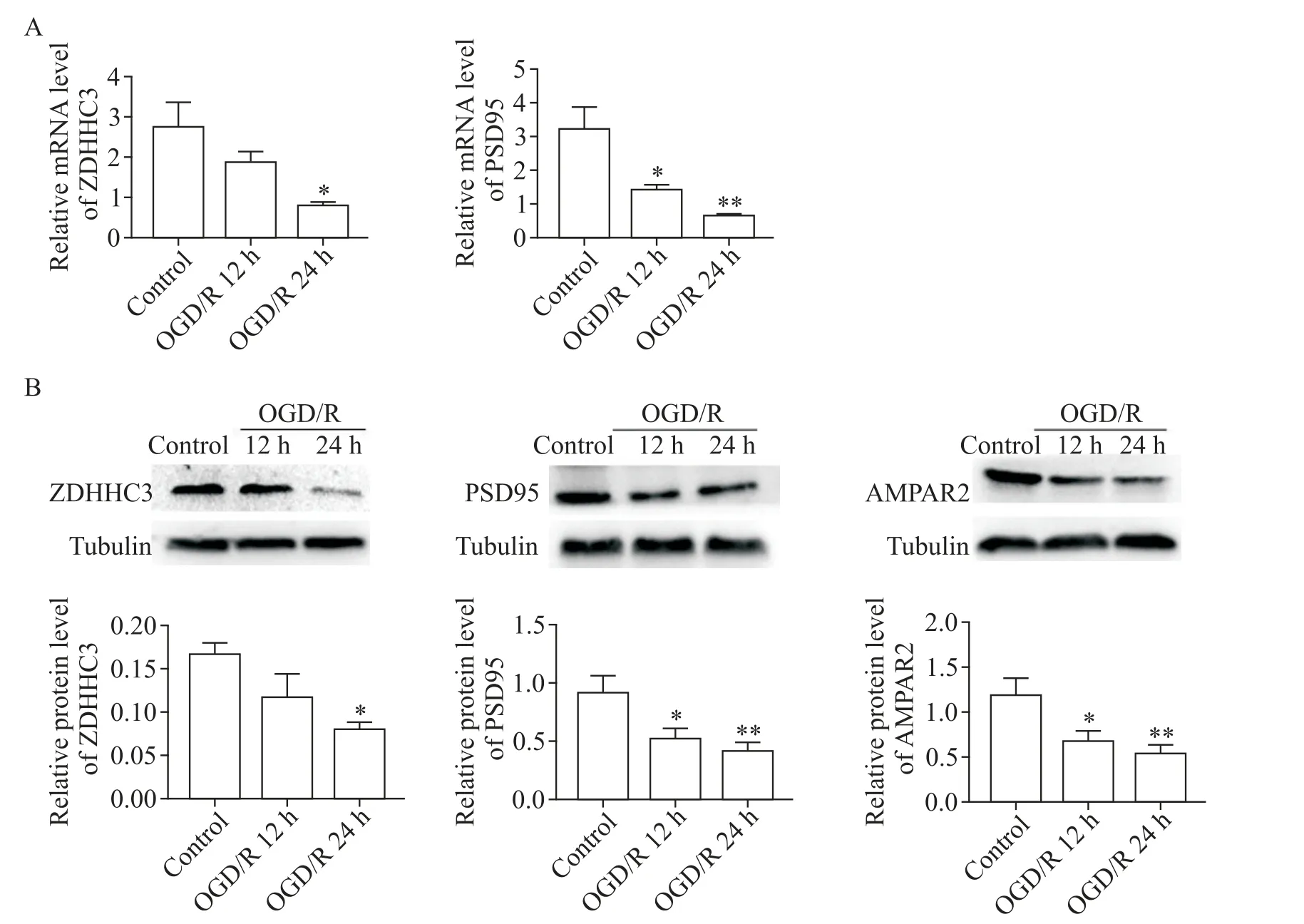
Figure 4.The mRNA and protein levels of ZDHHC3 and PSD95 in the PC12 cells exposed to OGD/R.A:the mRNA levels of ZDHHC3 and PSD95 in the PC12 cells exposed to OGD/R for 12 h and 24 h were decreased compared with control group;B:the protein levels of ZDHHC3,PSD95 and AMPAR2 were decreased in the PC12 cells exposed to OGD/R for 12 h and 24 h compared with control group.Mean±SEM.n=3.*P<0.05,**P<0.01 vs control group.图4 RT-qPCR和Western blot检测ZDHHC3、PSD95和AMPAR2在PC12细胞中的表达
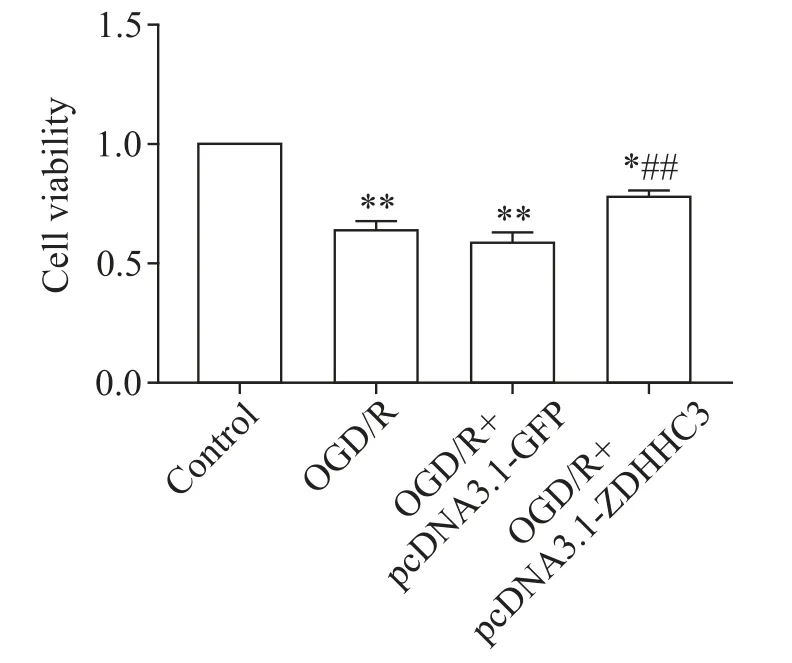
Figure 5.Effects of ZDHHC3 over-expression on the viability of PC12 cells exposed to OGD/R.Compared with OGD/Rgroup and pcDNA3.1-GFPgroup,improved viability of the PC12 cells in pcDNA3.1-ZDHHC3 group was observed.Mean±SEM.n=3.*P<0.05,**P<0.01 vs control group;##P<0.01 vs OGD/Rgroup.图5 MTT检测过表达ZDHHC3对PC12细胞活力的影响
6 转染ZDHHC3过表达质粒可增加PC12细胞PSD95和AMPAR2的蛋白水平
转染ZDHHC3过表达质粒后,PC12细胞中PSD95和AMPAR2的蛋白表达水平相比OGD/R组有所增加(P<0.05),提示上调ZDHHC3的表达可影响PC12细胞突触相关蛋白PSD95和AMPAR2的表达,见图6。
7 转染ZDHHC3过表达质粒可减少PC12细胞凋亡
转染ZDHHC3过表达质粒后,抑凋亡蛋白Bcl2的蛋白表达水平相比OGD/R组有所增加(P<0.05),Bax的蛋白表达水平相比OGD/R组有所减少(P<0.05),见图7。
应用流式细胞术分析过表达ZDHHC3后细胞凋亡的变化,结果显示,ZDHHC3过表达组凋亡细胞的比例显著低于OGD/R组(P<0.01),见图8。
讨 论
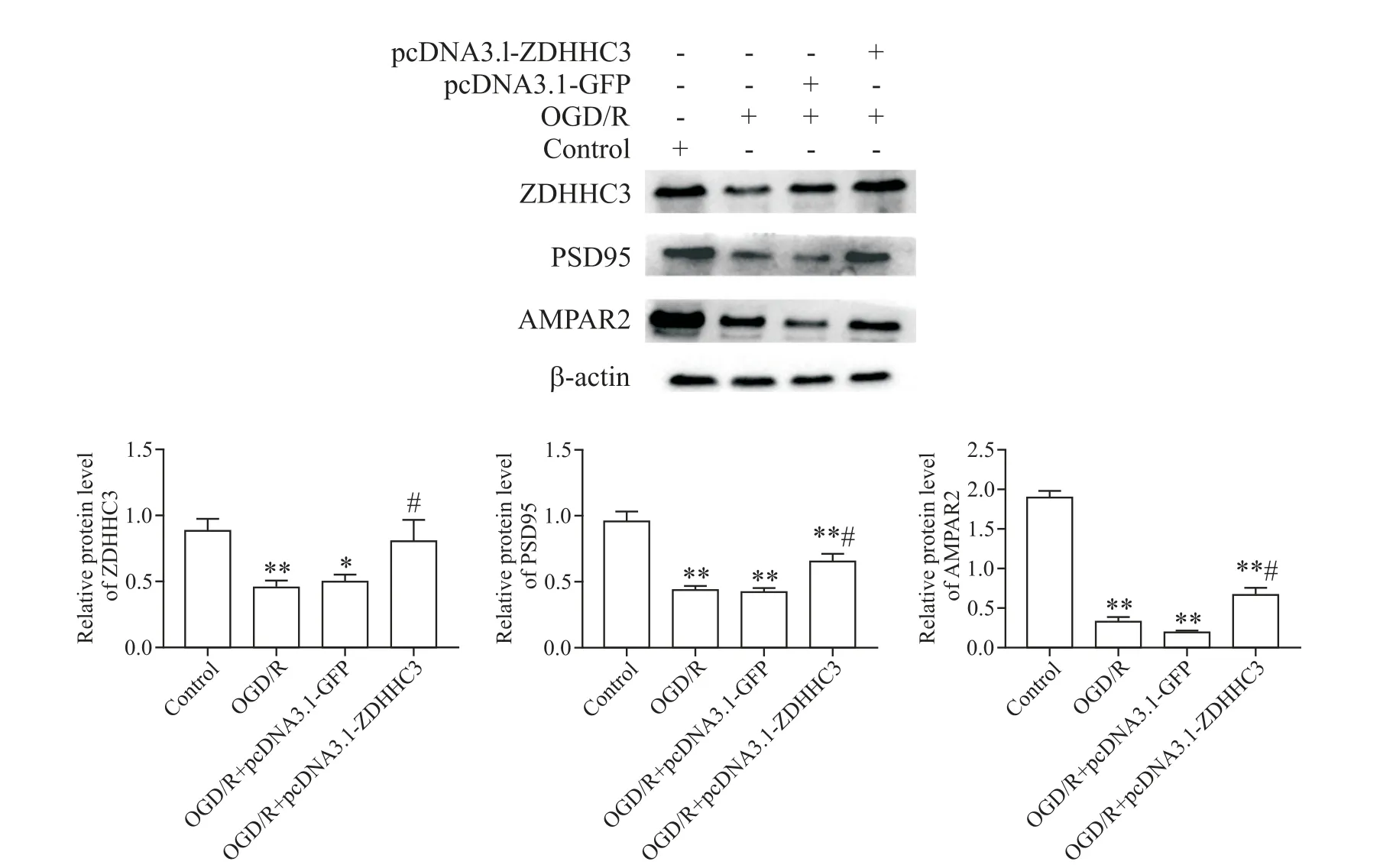
Figure 6.Effects of ZDHHC3 over-expression on the protein level of PSD95 and AMPAR2 in the PC12 cells exposed to OGD/R.The protein levels of ZDHHC3,PSD95 and AMPAR2 were determined by Western blot.Mean±SEM.n=3.*P<0.05,**P<0.01 vs control group;#P<0.05 vs OGD/Rgroup.图6 过表达ZDHHC3对OGD/R诱导的PC12细胞PSD95和AMPAR2蛋白表达的影响
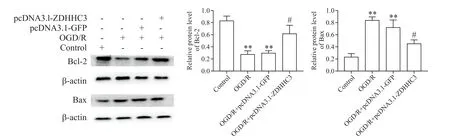
Figure 7.Effects of ZDHHC3 over-expression on apoptosis of PC12 cells exposed to OGD/R.The protein levels of Bcl-2 and Bax were determined by Western blot.Mean±SEM.n=3.**P<0.01 vs control group;#P<0.05 vs OGD/Rgroup.图7 过表达ZDHHC3对OGD/R诱导的PC12细胞凋亡的影响
ZDHHC3属于DHHC蛋白家族,有研究报道,ZDHHC3导致AMPAR亚单位GluA1棕榈酰化,阻碍其转运到质膜,而沉默ZDHHC3,可改善高脂饮食小鼠的突触可塑性和记忆能力[21]。CIRI后,神经元突触的结构、功能及受体转运也相应受到损伤[22],结合DHHC酶可在多种神经系统疾病中发挥作用,推测ZDHHC3很可能在CIRI中发挥作用。本实验结果发现,与sham组相比,MCAO大鼠大脑皮层和海马组织中,以及OGD/R后PC12细胞中ZDHHC3的mRNA和蛋白水平均显著降低。免疫荧光双标实验结果显示,ZDHHC3在大鼠神经元中表达,但在星形胶质细胞中不表达,表明ZDHHC3可能主要作用于神经元从而参与调控CIRI的发生发展。
CIRI会导致大量神经元损伤,调节突触结构改变和功能障碍使突触恢复原有的转运和神经交流功能,是改善CIRI后神经损伤的关键[16]。AMPAR是兴奋性氨基酸的特异性受体,AMPAR2亚基是其中重要组成部分,与Ca2+通透性有关,且对突触传递、突触可塑性有重要作用。PSD95为AMPAR在突触后膜转运的关键蛋白[23],其表达增强是神经功能恢复的一种标志[17]。有研究发现,PSD95和AMPAR都可不同程度地发生棕榈酰化,可介导突触调控AMPAR的运输和功能[24-25],且都为ZDHHC3的底物蛋白[26-27]。因此推测在CIRI后,ZDHHC3可能与PSD95转运AMPAR有关。本实验结果发现,PSD95的mRNA和蛋白在体内、外都呈下降趋势,MCAO大鼠神经功能学评分增加,OGD/R诱导的PC12细胞神经元功能受损,伴随着大量细胞死亡,提示CIRI后神经元受到损伤。进一步构建ZDHHC3过表达的PC12细胞,发现PSD95和AMPAR2的蛋白表达相对损伤组有所增加。上述实验结果提示ZDHHC3可能通过增加突触相关蛋白PSD95和AMPAR2表达并促进突触转运而减轻CIRI。
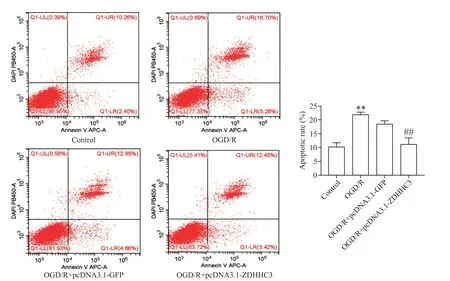
Figure 8.The effect of ZDHHC3 over-expression on the apoptotic rate of PC12 cells.The apoptotic rate in ZDHHC3 over-expression group was higher than that in OGD/Rgroup.Mean±SEM.n=3.**P<0.01 vs control group;##P<0.01 vs OGD/Rgroup.图8 流式细胞术检测过表达ZDHHC3对PC12细胞凋亡率的影响
CIRI后,由细胞凋亡引起的半暗区细胞损伤是治疗重点,所以抑制细胞凋亡是卒中治疗中的神经保护策略之一[28-29]。我们进一步研究ZDHHC3的生物功能发现,过表达ZDHHC3可使促凋亡蛋白Bax表达减少,抑凋亡蛋白Bcl-2表达增加;流式细胞术结果发现,ZDHHC3的过表达使凋亡程度有所减轻;MTT实验发现,ZDHHC3的增加可一定程度上挽救细胞,增强细胞活力。上述结果表明,过表达ZDHHC3确实可减少缺血-再灌注损伤后的细胞凋亡。
综上所述,ZDHHC3可能通过增加PSD95的表达,参与AMPAR的转运,改善神经功能,从而对OGD/R诱导的PC12细胞起保护作用。ZDHHC3可能是CIRI中的潜在治疗靶点,这为蛋白质翻译后修饰可能是新的缺血性脑卒中治疗靶点提供参考。但ZDHHC3在CIRI中的确切病理生理作用及机制仍需要进一步研究。

