环状RNA circTMBIM 1在肝细胞癌中的表达和功能研究①
陆滢雪 罗新华 程明亮 彭 虹 (贵州医科大学附属医院感染科,贵阳550004)
近年来,环状RNA(circRNA)的功能备受关注,如调节亲本基因表达、发挥miRNA海绵体等作用[1-3]。研究表明,circRNA参与肿瘤发生发展[4-5]。原发性肝细胞癌(hepatocellular carcinoma,HCC)是全球恶性肿瘤相关死亡的常见原因,预后差、复发率高,其发病机制受到高度关注[6-7]。最新研究表明,大量circRNA在HCC组织和正常肝组织中存在差异表达,与HCC发生发展和预后密切相关,但具体作用机制尚未明确[8-10]。本文就circRNA在HCC中的异常表达进行分析,探讨其在HCC中的作用和潜在机制。高通量测序发现,circTMBIM1在HCC组织中表达上调,因此,课题组对Hsa-circTMBIM1在HCC细胞系中的表达进行RT-PCR定量分析,并设计合成靶向Hsa-circTMBIM1的小干扰RNA(siRNA),将其转染至Huh7细胞,研究Hsa-circTMBIM1与Huh7细胞增殖和迁移的关系。
1 材料与方法
1.1 材料
1.1.1 细胞系 人HCC细胞株HepG2、Hep3B、Huh7、Sk-hep-1、HCCLM3、SMMC-7721购自上海生命科学院所;慢病毒稳转细胞株由南京科佰生物科技有限公司提供;引物由北京擎科生物有限公司合成;靶向circTMBIM1的siRNA序列委托广州锐博生物公司设计合成;
1.1.2 主要试剂与仪器 DMEM细胞培养基(美国Hyclone公司);胎牛血清(美国Gibco公司);青-链霉素(武汉苑陵生物科技有限公司);miR-24-3p模拟物(上海吉玛生物有限公司);miR-24-3p抑制剂和阴性对照(上海生工生物公司);CCK-8试剂盒(日本Dojindo公司);结晶紫染色液(碧云天公司);碘化丙啶、Lipofectamine 3000转染试剂盒、荧光素酶报告基因质粒(美国Sigma公司);Transwell小室(美国Coster公司);Trizol试剂(美国Invitrogen公司);酶标仪(美国Thermo公司);Muse智能触控细胞分析仪(美国默克密理博公司);荧光定量PCR仪(美国ABI公司);双荧光素酶报告基因测定系统(Promega,Madison,WI,USA)。
1.2 方法
1.2.1 细胞培养及转染 HCC细胞系HepG2、Hep3B、Huh7、Sk-hep-1、HCCLM3和SMMC-7721均采用DMEM培养基培养,添加10%胎牛血清(FBS)+100 U/ml青霉素+100μg/ml链霉素,37℃、5%CO2、95%相对湿度下培养。根据Lipofectamine3000转染试剂盒说明书转染circTMBIM1-siRNA,培养48 h后进行细胞功能实验。
1.2.2 RT-PCR 采用Trizol试剂从新鲜冷冻组织和培养细胞中分离总RNA,反应体系10μl,反应条件:25℃5 min,42℃60 min,70℃5 min,12℃ 循环,合成cDNA。扩增体系20μl,反应条件:95℃5 min,95℃5 s,60℃60 s,共40个循环。circTMBM1引物序列为:F:5′-GGCTATGATGGGGAGGAGAGAGC-3′,R:5′-GGCGCTGGGGTTGGACATGG-3′;miR-24-3p引物序列为:5′-TGCGGTGGCTCAGTTCAGCAG‐GAAC-3′;GAPDH引物序列为:F:5′-GGAGCGAGATCCCTCCAAAAT-3′,R:5′-GGCTGTTGTCATACTTCTCATGG-3′。2-ΔΔCt法计算基因相对表达。比较circTMBIM1在HCC细胞中的表达,所有试验重复3次,取平均值。
1.2.3 细胞功能实验
1.2.3.1 细胞增殖及活性检测 100μ/l孔向96孔反应板中注入细胞悬浮液,置于培养箱中培养,10μ/l孔添加CCK-8溶液进行孵育,酶标仪测定样品450 nm处吸光度。取对数生长期细胞,4×103~1×105个/孔接种于96孔板,培养至正常生长阶段,采用细胞培养基按1 000:1比例稀释EdU溶液(试剂A),制备50μmo/lL EdU培养基,固定细胞后用Apollo试剂染色,拍照并分析图像。向6孔板中注入100个细胞,接种于培养液中并置于培养箱中培养,当培养皿中出现肉眼可见的克隆时终止培养,固定细胞,加入适量结晶紫染色,流动水冲洗,空气干燥后拍照。所有试验重复3次,取平均值。
1.2.3.2 细胞创伤愈合实验 将24孔细胞培养板的细胞培养24 h至70%~80%融合度,200μl移液枪垂直划痕,冲洗脱落细胞,添加新鲜培养基培养细胞48 h,PBS清洗2次,固定细胞并测距。所有试验重复3次,取平均值。
1.2.3.3 Transwell实验 调整细胞浓度至2×105个/ml,吸取100μl无血清细胞培养基加入Transwell上室,37℃培养48 h,按照操作规范进行实验,显微镜明亮视野下观察阳性细胞,所有试验重复3次,取平均值。
1.2.3.4 流式细胞周期检测 转染24 h后弃培养基,PBS冲洗2次,加入1 ml不含EDTA的胰酶,待细胞成片脱落后,加入2 ml培养基终止消化,转移至无菌离心管,1 000/rmin离心5 min,弃上清,PBS洗涤并离心3次,预冷70%乙醇固定,4℃孵育过夜,PBS离心洗涤细胞3次,去固定液,加入缓冲液,加入0.5μg/ml PI染色液染色30 min,流式细胞术检测细胞周期,FlowJo7.6软件分析各期细胞含量。
1.2.4 慢病毒稳转细胞株构建和细胞转染 将过表达circTMBIM1的细胞(circTMBIM1 OE)、circTM‐BIM1-敲除细胞(sh-circTMBIM1)和阴性对照细胞(NC)进行慢病毒包装,构建稳转细胞株。Huh7细胞接种于6孔板,第2天采用Lipofectamine 3000转染48 h后收集细胞,qRT-PCR验证转染效率。
1.2.5 双荧光素酶报告基因试验 TargetScan和miRanda预测circRNA-miRNA的相互作用,生物信息学预测circTMBIM1与底物miR-24-3p相结合,构建psiCHECK-circTMBIM1-WT/-Mut质粒,采用Li‐pofectamine 3000将psiCHECK-circTMBIM1-WT或psiCHECK-circTMBIM1-Mut和miR-519a-5p模拟物或miR-NC共转染至293T细胞,双荧光素酶报告基因测定系统测定转染48 h后的荧光素酶活性。
1.3 统计学分析 采用SPSS17.0软件进行统计学分析,GraphPad Prism7软件绘图,两组间比较采用t检验,多组均数比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 circTMBIM1在HCC细胞系中的表达及敲减效率 circTMBIM1在Huh7细胞系中表达最高,其次分别为HepG2,Hep3B,Sk-hep-1,HCCLM3,SMMC-7721(图1A),选用Huh7细胞系进行后续实验。qRTPCR实验检测显示,与对照组相比,siRNA干扰后,circTMBIM1表达显著降低(P<0.001,图1B)。
2.2 下调circTMBIM1对Huh7细胞增殖的影响 CCK-8实验结果显示,与对照组相比,下调circTMBIM1表达明显降低Huh7细胞增殖活力(P<0.01,图2A)。集落形成实验研究结果显示,将circTMBIM1 siRNA转染至Huh7细胞2周后,与对照组相比,Huh7细胞集落数明显减少(图2B)。进一步采用EdU实验检测沉默circTMBIM1后Huh7增殖活力的变化,结果显示,与对照组比,沉默circTM‐BIM1可降低Huh7细胞增殖活力(图2C)。
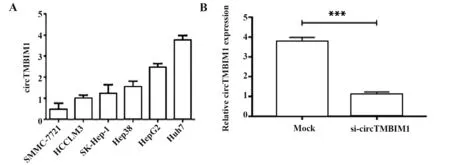
图1 circTMBIM 1在HCC细胞系中的表达及敲减效率Fig.1 Expression and knock down efficiency of circTM⁃BIM 1 in HCC cell lines
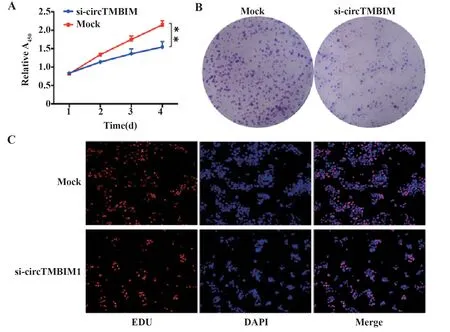
图2 下调circTMBIM 1对Huh7细胞增殖的影响Fig.2 Effect of down-regulation of circTMBIM 1 on pro⁃liferation of Huh7 cell
2.3 下调circTMBIM1表达对Huh7细胞迁移的影响 细胞创伤愈合实验结果显示,划痕48 h后,与对照组相比,下调circTMBIM1表达显著抑制细胞创伤愈合(图3A)。Transwell细胞迁移实验结果显示,与对照组相比,下调circTMBIM1表达后Huh7细胞迁移能力减弱(图3B)。
2.4 下调circTMBIM1表达对Huh7细胞细胞周期的影响 流式细胞术检测下调circTMBIM1表达对Huh7细胞细胞周期的影响,结果显示,与对照组相比,敲低circTMBIM1表达,Huh7细胞S期占比显著降低(P<0.05,图4)。
2.5 双荧光素酶活性检测实验证实TMBIM1与miR-24-3p结合 根据NCBI数据库(https://www.ncbi.nlm.nih.gov/)查询分析,预测TMBIM1与miR-24-3p存在结合位点(图5A)。共转染circTM‐BIM1-WT和miR-24-3p模拟物后荧光素酶相对活性降低,miR-24-3p表达显著降低。转染circTMBIM1 OE后,miR-24-3p表达下降,转染sh-circTMBIM1后miRNA表达升高(P<0.01,P<0.001,图5B)。提示circTMBIM1可能直接与miR-24-3p结合而抑制miR-24-3P活性。

图3 下调circTMBIM 1表达对Huh7细胞迁移的影响Fig.3 Effect of down-regulation of circTMBIM 1 on mi⁃gration of Huh7 cell
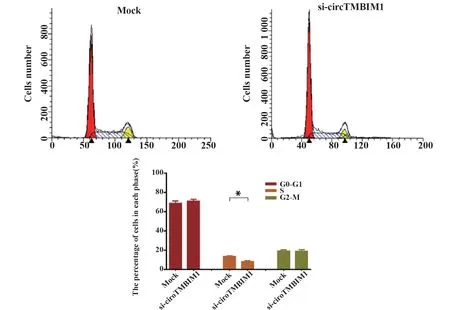
图4 下调circTMBIM 1表达对Huh7细胞细胞周期的影响Fig.4 Effect of down-regulation of circTMBIM 1 on cell cycle of Huh7 cell

图5 双荧光素酶活性检测实验证实TMBIM 1与miR-24-3p结合Fig.5 Double luciferase activity test confirmed combina⁃tion of TMBIM 1 and miR-24-3p
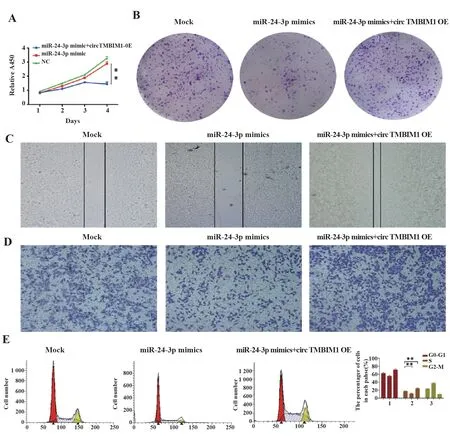
图6 过表达circTMBIM 1可逆转miR-24-3p mimics对Huh7细胞增殖、迁移、细胞周期的影响Fig.6 Overexpression of circTMBIM 1 can reverse effects of miR-24-3p mimics on proliferation,migration and cell cycle of Huh7 cells
2.6 过表达circ TMBIM1可逆转miR-24-3p mimics对Huh7细胞增殖、迁移、细胞周期的影响 采用CCK-8法测定共转染miR-24-3p mimics和circTM‐BIM1 OE后Huh7细胞增殖情况,结果显示,miR-24-3p mimics可抑制Huh7细胞增殖,而过表达circTM‐BIM1可逆转miR-24-3p mimics对Huh7细胞增殖的抑制作用(图6A),集落形成实验结论相同(图6B)。细胞创伤愈合实验、Transwell实验共转染miR-24-3p mimics和circTMBIM1 OE后Huh7细胞迁移结果显示,miR-24-3p mimics可抑制Huh7细胞迁移,而过表达circTMBIM1可逆转miR-24-3p mimics对Huh7细胞迁移的抑制作用(图6C、D)。流式细胞术实验结果显示,与对照组相比,下调circTMBIM1表达细胞S期占比降低,共转染circTMBIM1 OE结论相反(图6E)。
3 讨论
HCC是一种死亡率较高的恶性肿瘤,预后差、恶性程度高、复发率高,对多种化疗药物耐药,若发生恶性转移控制较难[11-12]。进一步筛选潜在诊断、预后生物标志物和治疗靶点,深入研究可能的分子机制对HCC治疗至关重要。近年非编码RNA(ncRNA)已成为HCC研究重点。多项研究表明,肿瘤特异性ncRNA可用于生存预测和治疗干预[13-15]。HCC相关ncRNA中,circRNA在HCC发生发展中具有重要作用[16]。circRNA/miRNA轴在转录和转录后水平调节基因表达[17]。研究表明,circRNA可与多种miRNA结合起miRNA“海绵体”作用,影响其他基因转录和翻译,调控肿瘤恶性进展,如circ‐MTO1和cSMARCA5已被认为是致癌miRNA海绵,在HCC进展过程中发挥重要作用,可能成为HCC治疗的潜在靶点[18-20]。
本研究发现circTMBIM1在HCC细胞中表达显著上调,敲低circTMBIM1可使HCC细胞增殖及迁移能力减弱。生物信息学数据库分析显示circTM‐BIM1与miR-24-3p存在结合位点,荧光素酶报告基因实验验证结合位点的结合能力。circTMBIM1/miR-24-3p信号轴的潜在下游基因主要参与细胞代谢过程,与HCC细胞代谢失调相关。circTMBIM1可能通过影响Huh7细胞代谢调控miR-24-3p的下游基因,从而促进Huh7细胞增殖、迁移。因此circTM‐BIM1可能是HCC的潜在治疗靶点。本研究仍存在一定局限性,样本量较小,需要招募更多患者进一步阐明circTMBIM1的临床意义,且未涉及miR-24-3p的下游基因。circTMBIM1在体内的致癌作用及合成和降解机制有待进一步研究。
综上所述,本研究首次探讨了circTMBIM1在人HCC细胞中的生物学功能,证明circTMBIM1在HCC发生发展中起重要作用。此外,circTMBIM1的致癌作用可能与miR-24-3p的抑制有关,circTMBIM1可能成为HCC治疗的有效靶点。

