姜黄素通过激活AMPK信号通路介导的自噬抑制大鼠蛛网膜下腔出血后神经元凋亡①
罗 焱 张 平 (南华大学附属南华医院神经内科,衡阳421002)
蛛网膜下腔出血(subarachnoid hemorrhage,SAH)是一种由多原因所致脑表面或底部脑血管破裂后血液流入蛛网膜下腔而引起的中枢神经系统疾病。SAH后可出现多种严重并发症,如早期脑损伤(early brain injury,EBI)、急性脑血管痉挛、血脑屏障、迟发性脑缺血等,且还具有较高的发病率、致残率和致死率[1-2]。既往研究认为,EBI是导致SAH患者死亡和不良预后的重要原因,而神经元凋亡则被认为是引起EBI的重要病理机制[3-5]。此外,作为真核生物中高度保守的一类生物学途径,自噬可通过降解细胞内组分维持细胞稳态,在感染、癌症、神经退行性变、衰老和代谢紊乱相关的多种疾病中起着关键作用。既往研究表明,SAH后的自噬激活对EBI具有神经元保护作用[6-7]。姜黄素(curcumin,Cur)是一种从姜黄中分离出的天然二酮类化合物,具有降血脂、抗肿瘤、抗炎、抗氧化等多重药理学作用。多项研究表明,Cur是一种天然的自噬调节剂,能够通过激活自噬抑制细胞凋亡[8-9]。同时,已证实Cur对SAH后脑血管痉挛、EBI、血脑屏障等具有神经保护作用[10-12]。然而,Cur是否通过激活自噬发挥SAH后神经保护作用,目前鲜有报道。因此,本研究拟采用血管内穿刺法建立大鼠SAH模型,探究Cur对SAH后神经元凋亡及自噬的影响,并初步阐明其机制,旨在为临床中药防治SAH后神经损伤提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 清洁级健康雄性Sprague-Dawley(SD)大鼠60只,鼠龄7~8周,体重250~300 g,由长沙市天勤生物技术有限公司提供,动物饲养合格证号:SCXK(湘)2014-0011。
1.1.2 主要试剂 姜黄素(纯度99%)购自河南科锐化工有限公司;AMPK抑制剂Dorsomorphin购自美国Med Chem Express公司;TUNEL染色试剂盒购自上海碧云天生物工程有限公司;兔抗cleaved-cas‐pase-3多克隆抗体、兔抗Beclin-1单克隆抗体、小鼠抗LC3-Ⅱ多克隆抗体、兔抗Phospho-AMPKα(Thr 172)单克隆抗体、兔抗AMPKα单克隆抗体、兔抗Phospho-mTOR(Ser2448)单克隆抗体、兔抗mTOR多克隆抗体、兔抗GAPDH单克隆抗体、荧光二抗Goat Anti-Mouse IgG H&L(Alexa Fluor®488)以及Goat Anti-Rabbit IgGH&L(Alexa Fluor®594)均购自美国Cell Signaling Technology公司;兔抗NeuN荧光单克隆抗体(Alexa Fluor®594 Conjugate)购自美国Abcam公司;辣根过氧化物酶(HRP)标记的山羊抗兔、小鼠IgG二抗购自武汉博士德生物工程有限公司。
1.2 方法
1.2.1 动物分组及模型构建 将60只SD雄性大鼠随机分成5组,假手术组(Sham)、模型组(SAH),Cur低剂量干预组(50 mg/kg,Cur-L)、Cur高剂量干预组(200 mg/kg,Cur-H)和高剂量Cur联合AMPK抑制剂Dorsomorphin干预组(200 mg/kg Cur+25 mg/kg Dorsomorphin,Cur-H+Dor),每组12只。采用血管内穿刺法建立大鼠SAH模型,以穿刺后有明确无脑实质损害的SAH或血凝块作为模型制备成功标准[13]。其中Sham组不刺破血管壁,其余操作均一致。术后Cur干预组立即给予侧脑室注射给药,Cur-H+Dor组在Cur给药结束后给予侧脑室注射25 mg/kg Dorsomorphin,Sham与SAH组给予注射等量生理盐水,1次/d,连续3 d。
1.2.2 大鼠神经功能缺损评分及脑含水量检测 给药治疗3 d后,参考YAMAGUCHI等[14]方法对各组大鼠进行神经损伤缺损评分,总分24分,神经功能缺失越严重得分就越低,具体评分项目包括:①自主运动;②肢体本能反应;③触须反应;④前爪的伸展性;⑤攀爬运动能力;⑥四肢运动的平衡性。各组随机抽取5只大鼠,断头处死后取脑组织,使用滤纸将缺血侧脑组织表面水分小心擦拭,称其湿重后将其置于100℃烘箱内烘烤至恒重,然后称其干重,计算各组大鼠脑组织含水量。脑组织含水量(%)=(湿重-干重)/湿重×100%。
1.2.3 TUNEL法检测海马组织神经元凋亡情况取各组1.2.2后剩余大鼠,于术后3 d断头取脑并分离海马组织,取部分海马组织经4%多聚甲醛固定过夜,石蜡包埋后切片、脱蜡,滴加不含DNase的蛋白酶K在37℃条件下孵育15 min,用PBS洗涤3次,再滴加3%过氧化氢溶液室温孵育10 min,用PBS洗涤3次,按要求滴加生物素标记液,37℃孵育60 min,PBS洗涤1次终止反应,最后滴加DAB显色液室温孵育20 min,苏木精染色,二甲苯透明,中性树胶封片,显微镜观察。细胞核中有棕黄色颗粒者即为凋亡细胞。每张切片选择6个高倍镜视野计数600个细胞,凋亡率以600个细胞中阳性细胞百分比表示。
1.2.4 免疫荧光染色观察LC3-Ⅱ在神经元中的分布及表达 取部分已采用4%多聚甲醛固定的海马组织,放入20%蔗糖溶液中至组织沉到瓶底,包埋后切片,每连续5片取1片用于组织免疫荧光染色。取出切片,采用10%山羊血清室温封闭1 h,分别加入兔抗LC3-Ⅱ抗体(1:100)和小鼠抗NeuN抗体(1:50),4℃孵育过夜。PBS洗涤3次,分别加入二抗Goat Anti-Mouse IgGH&L(Alexa Fluor®488)和Goat Anti-Rabbit IgGH&L(Alexa Fluor®594)室温避光孵育1 h,PBS洗涤3次,加入防淬灭剂后甘油封片,荧光显微镜下观察,以LC3-Ⅱ蛋白平均荧光强度表示LC3-Ⅱ蛋白颗粒形成水平。
1.2.5 Western blot检测大鼠脑组织中相关蛋白表达水平 取大鼠部分冻存海马组织,加入RIPA裂解液,冰上充分研磨20 min,4℃条件下12 000/rmin离心20 min,留取上清液,使用BCA法进行蛋白定量。取30μg蛋白上样,进行SDS-PAGE凝胶电泳分离蛋白,并将蛋白转移至PVDF膜,5%脱脂奶粉室温封闭1 h,PBST洗涤3次,分别加入cleaved-cas‐pase-3抗体、Beclin-1抗体、LC3-Ⅱ抗体、p-AMPKα抗体、AMPKα抗体、p-mTOR抗体、mTOR抗体和GAPDH抗体,4℃孵育过夜,PBST洗涤3次,加入HRP标记的山羊抗兔或小鼠IgG,室温孵育30 min,PBST洗涤3次,滴加ECL发光显影。采用Image J测定蛋白条带的光密度并进行定量分析。
1.3 统计学分析 采用SPSS22.0统计软件进行统计分析,计量资料用±s表示,多组间比较用One Way ANOVA方法,两组间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 Cur对SAH大鼠神经功能及脑组织水肿的影响 与Sham组比较,SAH组大鼠神经功能评分显著降 低(P<0.001),脑 组 织 含 水 量 显 著 增 加(P<0.001);与SAH组比较,Cur-H组大鼠神经功能评分显著增加(P<0.001),脑组织含水量显著降低(P<0.001),而Cur-L组与SAH组比较无显著性差异(P>0.05);与Cur-H组比较,Cur-H+Dor组大鼠神经功能评分显著降低(P<0.001),脑组织含水量显著增加(P<0.05),如图1所示。
2.2 Cur对SAH大鼠海马组织神经元凋亡的影响 与Sham组比较,SAH组大鼠海马神经元凋亡率以及海马组织中cleaved-caspase-3蛋白表达水平均显著增加(P<0.001);与SAH组比较,Cur-H组大鼠海马神经元凋亡率以及cleaved-caspase-3蛋白表达水平均显著降低(P<0.001),Cur-L组无显著性差异(P>0.05);与Cur-H组比较,Cur-H+Dor组大鼠海马神经元凋亡率和cleaved-caspase-3蛋白表达水平显著增加(P<0.001),如图2、3所示。
2.3 Cur对SAH大鼠海马组织自噬水平的影响与Sham组比较,SAH组大鼠海马区LC3-Ⅱ蛋白荧光信号减弱(P<0.001),Beclin-1和LC3-Ⅱ蛋白表达显著下调(P<0.05);与SAH组比较,Cur-H组大鼠海马区LC3-Ⅱ蛋白荧光信号增强(P<0.001),Beclin-1和LC3-Ⅱ蛋白表达显著上调(P<0.001),而Cur-L组无显著性变化(P>0.05);与Cur-H组比较,Cur-H+Dor组大鼠海马区LC3-Ⅱ蛋白荧光信号减弱,Be‐clin-1和LC3-Ⅱ蛋白表达显著下调(P<0.05),如图4、图5所示。

图1 各组大鼠神经功能评分和脑组织含水量比较Fig.1 Comparison of neurological score and brain water content of rats in each groups
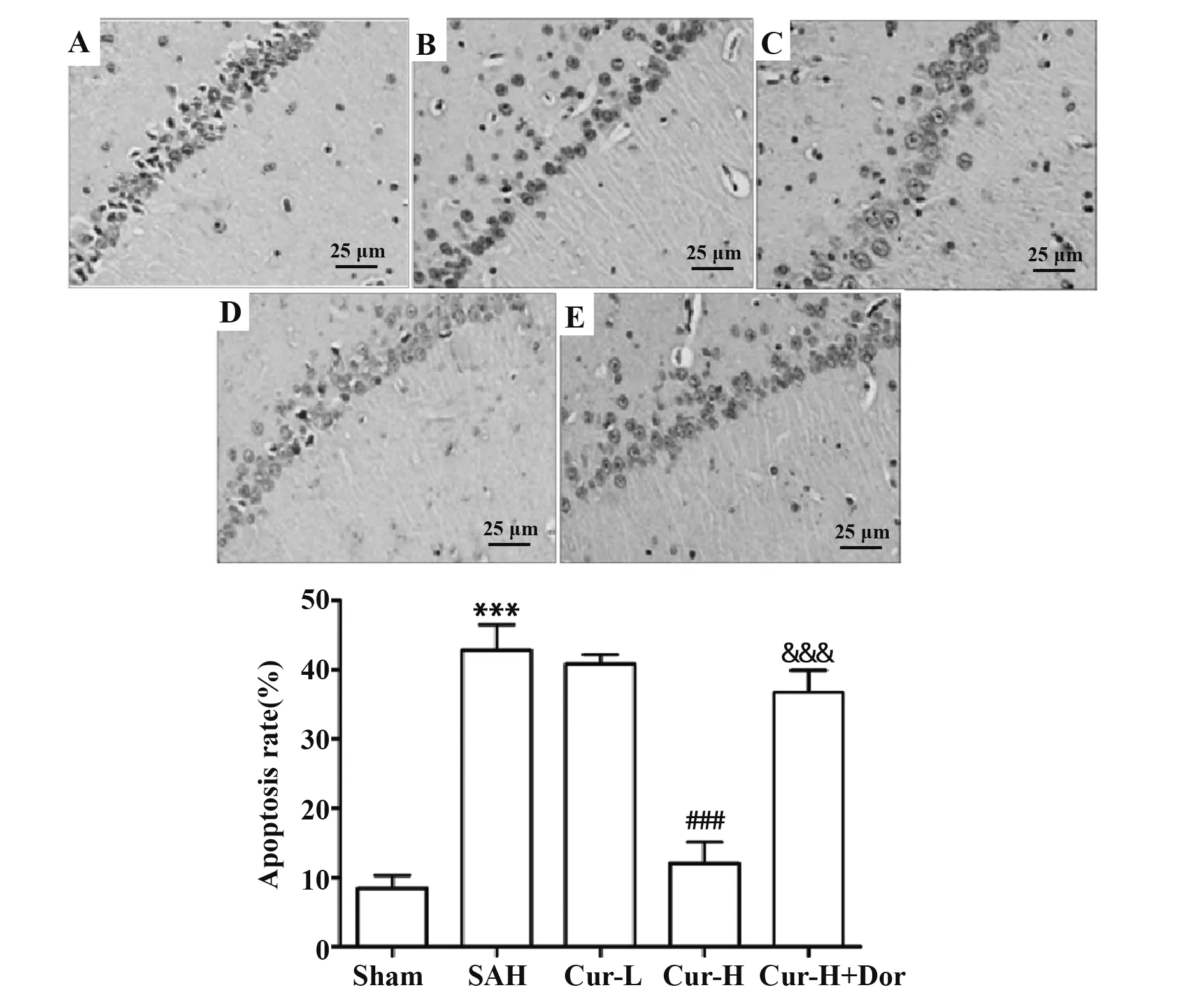
图2 TUNEL染色(×400)Fig.2 TUNEL staining(×400)

图3 各组大鼠海马组织中Cleaved-caspase-3表达水平Fig.3 Expressions level of Cleaved-caspase-3 in hippo⁃campal tissues of rats in each group

图4 各组大鼠海马组织LC3-Ⅱ蛋白免疫荧光染色(×400)Fig.4 Immunofluorescence staining of LC3-Ⅱprotein in hippocampal tissues of rats in each group(×400)
2.4 Cur对SAH大鼠海马组织AMPK信号通路相关蛋白表达的影响 与Sham组比较,SAH组大鼠海马组织p-AMPKα表达水平显著降低(P<0.05),pmTOR表达水平显著升高(P<0.05),与SAH组比较,Cur-H组大鼠海马组织p-AMPKα表达水平显著升高(P<0.05),而p-mTOR表达水平显著降低(P<0.05),而Cur-L组无显著性变化(P>0.05);与Cur-H组比较,Cur-H+Dor组大鼠海马组织p-AMPKα表达水平显著降低(P<0.05),同时p-mTOR表达水平显著升高(P<0.05)。而各组总AMPKα和mTOR蛋白水平无显著性变化(P>0.05),如图6所示。

图5 各组大鼠海马组织自噬相关蛋白表达Fig.5 Expression level of autophagy related-proteins in hippocampal tissues of rats in each group
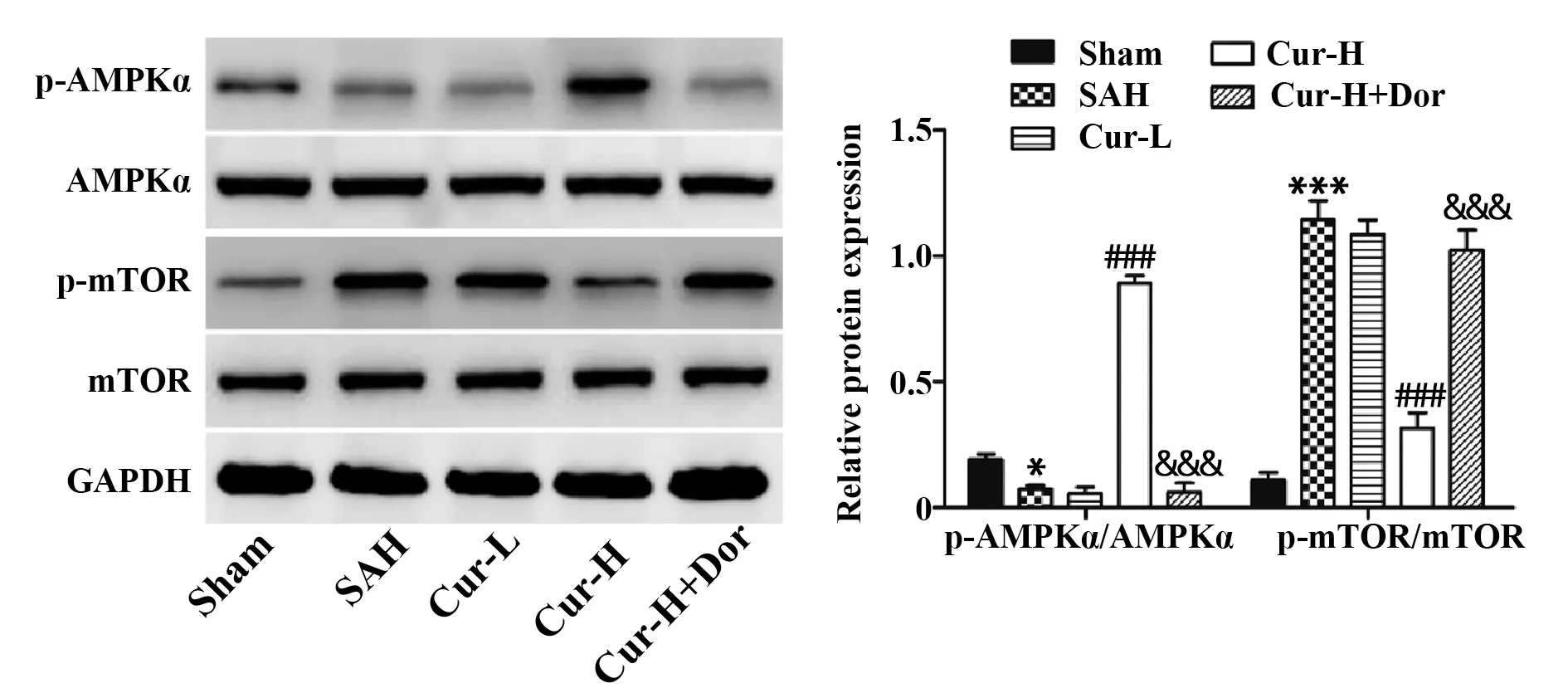
图6 各组大鼠海马组织中AMPK信号通路相关蛋白的表达Fig.6 Expression of AMPK signaling pathway related proteins in hippocampal tissues of rats in each group
3 讨论
自噬即自我吞噬作用,是真核生物特有的生命现象,机体主要通过自噬溶酶体来清除细胞内的毒性物质和受损的细胞器,执行生存或死亡的功能,以维持细胞内环境的稳定。自噬通路在神经退行性疾病、脑缺血再灌注损伤、创伤性脑损伤等多种中枢神经系统疾病中发挥重要作用[15-17]。既往研究表明[18],SAH后神经元自噬被激活以抑制神经元凋亡,然而这种自噬水平在24 h达到峰值,随后降低并在48 h恢复正常。自噬可以通过清除受损线粒体,抑制细胞色素
C等凋亡起始因子的释放,进而抑制细胞凋亡,是应激性细胞损伤的重要保护机制。因此,若适当激活神经元自噬极有可能对SAH后EBI相关神经元凋亡起到抑制作用。而本研究结果发现,Cur干预可显著提高SAH大鼠神经元自噬水平并抑制神经元凋亡,对SAH大鼠神经功能及脑组织水肿有显著的改善作用。表明,Cur可以通过增强自噬抑制SAH后早期神经元凋亡。
脑血管破裂后会引起脑血管血流的改变,造成供血区域出现缺血缺氧状态,进而诱导神经元凋亡,而神经元凋亡恰是导致SAH后EBI的重要病理机制。本研究采用血管内穿刺法建立SAH大鼠模型发现,SAH大鼠海马组织中神经元凋亡严重,cleaved-caspase-3表达水平显著上调,且神经缺失和脑组织水肿严重。而采用Cur干预后,SAH大鼠海马组织神经元凋亡率显著下降,海马组织cleavedcaspase-3表达水平显著降低,神经缺失和脑组织水肿改善明显。李霞等[11]研究显示,Cur可抑制SAH大鼠海马神经元凋亡,并改善SAH后EBI。说明,Cur能够抑制SAH后海马神经元凋亡,改善神经功能。然而,有关Cur抑制SAH后海马神经元凋亡的潜在机制尚不完善。
细胞凋亡与细胞自噬之间关系错综复杂,既相互相成,又相互制约。当细胞受环境压力较小时,细胞启动自噬机制克服应激损伤,避免细胞死亡;若环境压力较大或持续时间较长时,细胞自噬将过度消耗细胞内蛋白和细胞器而使细胞无法继续生产,继而启动凋亡程序并抑制自噬[19]。SAH后短时间内神经元自噬会被激活,适度自噬有利于毒性物质和受损细胞器的清除,能够促进神经元存活,抑制凋亡[6-7,18]。适度激活神经元自噬可抑制SAH后早期神经元凋亡,而Cur具有激活细胞自噬的作用,因此,Cur有可能通过调节自噬抑制SAH后早期神经元凋亡[8-9]。为了进一步证实,本研究对自噬标志分子LC3-Ⅱ蛋白及自噬启动因子Beclin-1蛋白进行了检测,结果显示Cur干预后能够显著提高SAH大鼠海马组织中Beclin-1。
mTOR是调控自噬的关键分子,其激活可抑制自噬,而作为mTOR负调控因子,AMPK的激活可促进自噬[20]。有报道称,AMPK信号通路参与了SAH后早期脑损伤中神经元自噬的激活[21]。同时也有研究显示,Cur可通过激活AMPK信号通路诱导细胞自噬[22]。因此,在SAH中Cur极可能通过调控AMPK/mTOR信号通路诱导海马神经元自噬。为此,本研究对该通路关键调控蛋白的磷酸化水平进行了检测,结果发现Cur可显著提高SAH大鼠海马组织中p-AMPK水平,降低p-mTOR水平,而对AMPK和mTOR蛋白表达水平无显著影响。说明,Cur是通过激活AMPK信号通路诱导海马神经元自噬。
综上所述,本研究发现Cur可通过激活AMPK通路诱导海马神经元自噬,进而抑制神经元凋亡,从而改善SAH大鼠神经损伤,为Cur防治SAH后神经损伤提供了新的实验依据。

