根皮素对脂多糖诱导的RAW264.7细胞的体外抗炎作用机制
李 潭 孙一涵 李国峰 (长春中医药大学,长春130117)
炎症是机体在受到各种炎症因子的刺激和损伤后产生的一种防御反应,能使这些炎症因子失活和清除,并为组织修复创造环境。但炎症也是许多疾病的症状或并发症。病毒、细菌为诱发炎症的主要介质,物理、化学、创伤及其他刺激亦会对其产生影响[1-2]。RAW264.7巨噬细胞是启动体内炎症介质产生的中枢细胞[3]。在调节炎症反应方面,其中心细胞是激活的巨噬细胞,也是许多炎症因子的主要来源[4]。大量研究表明,中药单体(天然化合物)对RAW264.7巨噬细胞具有较好的抑制作用[5]。以LPS诱导的RAW264.7巨噬细胞为靶点,通过中药单体(天然化合物)的抗炎及促炎机制,可进一步了解炎症反应的作用机制,找到有效的防治措施[6]。
根皮素是一种果皮的天然提取物,主要来源于梨皮,石榴皮等果皮,这些果皮本身就具有泻火燥湿、消肿的功效,现代药理研究证实根皮素具有抗癌、抗结核和抗菌活性,但其抗炎的具体机制尚不明确[7-10]。中药单体能通过多途径、多靶点整合起效防治炎症的进展。根皮素能否调控RAW264.7巨噬细胞表现出抗炎效果,国内外尚未见相关文献报道。本文以LPS诱导的RAW264.7巨噬细胞为研究靶点,运用ELISA、Western blot、实时荧光定量PCR、免疫荧光等方法观察根皮素对炎症的作用机制,为临床应用根皮素防治各种炎症性疾病提供科学依据。
1 材料与方法
1.1 材料 RAW264.7细胞购自美国克拉克生物科学公司,并稳定传代4次;根皮素(上海源叶生物科技有限公司,纯度≥98%);DMEM、胎牛血清(克拉克生物科学公司,美国);胰蛋白酶(eBioscience公司,美国);TRIzo(lInvitrogen公司,美国);DMSO(百灵威科技有限公司,中国北京);Taq酶逆转录试剂盒、BCA蛋白测定试剂盒、NP40蛋白裂解液、CCK-8检测试剂盒(碧云天生物技术有限公司,中国上海);Tween-20、聚乙二醇辛基苯基醚(Triton X-100)、HRP标记的二抗(碧云天);COX-2、iNOS、p-IκBα、IκBα、p-NF-κBP65、NF-κB P65、p-Akt、Akt、p-P38、P38、p-ERK1/2、ERK1/2、p-JNK1/2、JNK1/2、β-Tubulin一抗(圣克鲁斯生物技术公司,美国);ELISA试剂盒、ECL超敏发光液(阿普利根生物技术研究所,中国北京);免疫固定液、DAPI(北京生物技术公司,中国北京);山羊抗兔二抗(圣克鲁斯生物技术公司,美国);电泳仪(百晶生物技术有限公司,中国);酶标仪、实时荧光定量PCR仪(Bio-Rad,美国);CO2恒温培养箱(Thermo,美国);荧光显微镜(苏州曼威斯光学仪器有限公司,中国);高压灭菌锅(Systec公司,德国);低温离心机(Sigma公司,德国);实验用烘箱(普斯特检测设备公司,东莞);标准恒温摇床(丙林电子科技公司,上海);pH计(中仪物联技术公司,武汉)。
1.2 方法
1.2.1 药物制备 DMSO配制根皮素原液,浓度为12 mg/ml,加入培养基依次稀释至实验所需浓度,即分别取原液10μl,加5 990μl培养基,原液10μl,加3 990μl培养基,原液10μl,加2 990μl培养基,稀释至20、30和40μg/ml。药液中DMSO的总含量均不高于0.5%。
1.2.2 细胞培养 从液氮中取出RAW264.7巨噬细胞迅速复苏后,将其加入胎牛血清:DMEM=1:9的完全培养基中,并置于恒温CO2培养箱,待细胞完全贴壁且生长至80%时,胰酶消化,然后以1:3比例传代培养,待细胞完全贴壁且生长至80%时用于后续实验。
1.2.3 细胞分组及干预 将细胞分为正常组、模型组(LPS组)、根皮素低、中、高剂量组(根皮素20、30、40μg/ml组),除正常组外均构建炎症模型,即在含根皮素药物干预前,将完全培养基吸出,加入不含胎牛血清(非完全培养基)的培养基进行24 h的饥饿处理,之后每个皿加入2μl LPS,培养箱中孵育4 h,密切观察细胞形态。
1.2.4 CCK-8法检测RAW264.7的细胞活性 在CCK-8实验中,经3次传代,待细胞稳定后,将6×103个细胞用移液器加入96孔板(200μ/l孔),保证每孔细胞均匀,数量基本相同。将细胞恒温培养于CO2培养箱,当其增长到80%时,将完全培养基吸出,加入非完全培养基,200μ/l孔培养3 h,然后用不同浓度的根皮素(1、5、10、20、40、60、80、100μg/ml)处理细胞并孵育4 h,加入20μl CCK-8后置于培养箱中培养1 h,酶标仪测量450 nm处吸光度A。
1.2.5 ELISA测定细胞上清液中TNF-α、IL-6和IL-1β含量 分组同前,培养至细胞密度达80%后,吸出完全培养基,加入非完全培养基饥饿细胞,24 h后在根皮素低、中、高浓度组中分别加入相应浓度的根皮素药液,培养4 h后在除正常组之外的其余各组分别加入2μl 1μg/ml的LPS,置于培养箱中继续培养3 h,然后将培养皿中的上清液移入EP管中备用。将上清液分别加入96孔板中后检测相关基因表达。
1.2.6 RT-PCR检测RAW264.7细胞中COX-2、iN‐OS、TNF-α、IL-1β、IL-6等的表达 TRIzol试剂提取细胞总RNA,在primescript®第一链cDNA合成试剂盒的作用下,将总RNA反转录成cDNA,以β-actin为内参。在cfx96系统中,进行基因表达的PCR分析。95℃ 变性15 s,60℃ 退火40 s,72℃ 延伸15 s,扩增40个周期。采用2-ΔΔCt法分析。引物序列如表1。
1.2.7 Western blot测定根皮素作用于RAW264.7细胞后相关蛋白的表达 将RAW264.7巨噬细胞置于培养皿中培养2 d。当细胞增长至培养皿低壁80%时,用非完全培养基代替完全培养基,饥饿细胞24 h,加入相应浓度的根皮素,4 h后加入LPS,3 h后收集细胞,加入NP40裂解液,冰上裂解20 min,BCA试剂盒测蛋白浓度。将NP40、十二烷基硫酸钠(5×SDS)、蛋白样品按计算值加入EP管,沸水中煮5 min后,加入15μl样品于12%SDS-聚丙烯酰胺凝胶电泳中分离,转移至PVDF膜,室温下用5%脱脂乳TBST膜孵育2 h。将膜置于COX-2(1:1 000)、iNOS(1:1 000)、p-IκBα(1:2 000)、IκBα(1:2 000)、p-NF-κB P65(1:3 000)、NF-κB P65(1:2 000)、p-Akt(1:3 000)、Akt(1:3 000)、p-P38(1:1 000)、P38(1:1 000)、p-ERK1/2(1:2 000)、ERK1/2(1:2 000)、p-JNK1/2(1:1 500)、JNK1/2(1:1 500)和β-Tubulin(1:3 000)抗体中,4°C过夜,TBST中洗涤5次(10 min/次),然后在含山羊抗兔(1:3 000)或山羊抗鼠(1:3 000)二级抗体的5%的脱脂乳中孵育1 h,然后在TBST中再次洗涤5次,10 min/次,在暗室用ECL超敏发光液观察条带。
1.2.8 免疫荧光法检测NF-κB P65在RAW264.7细胞中的核移位 将玻片放入浓硫酸中浸泡24 h,取出后流水冲洗30次,放入无水乙醇中浸泡4 h,蒸馏水冲洗10次,烘干后高压灭菌,160℃烘箱3 h烤干,放入超净台备用。将玻片置于24孔板,事先准备好含有细胞悬液的培养基加入24孔板中爬片。待细胞完全贴壁且增长至40%~50%时吸出完全培养基,并加入非完全培养基饥饿细胞24 h,之后将除正常组外的每孔加入0.5μl的LPS继续培养4 h,低、中、高剂量组加入相应浓度的根皮素,培养3 h后,每孔加入500μl冷PBS清洗3次(不含钾),5 min/次。室温下每孔加入免疫固定液500μl固定15 min,无钾PBS清洗3次(5 min/次),擦干水痕,用含0.1%Triton X-100的PBS冲孔20 min(渗透)。再次用冷PBS清洗3次(不含钾)。将24孔板中的玻片取出置于载玻片,每个玻片上加入50μl 5%山羊血清孵育3 h,沿边缘擦干后,将200μl 5%山羊血清加入1μl NF-κBP65(1:200)抗体配成混合液,在每个玻片上加入混合液20μl孵育过夜。第2天室温复温30 min,清洗,擦干水痕,用山羊抗兔Ⅱ抗(1:2 000)放置1 h,在暗室操作。再次清洗后,DAPI固定细胞染色,静置并在荧光显微镜下观察。
1.3 统计学处理 采用SPSS17.0统计软件包分析实验数据。结果以±s表示,每组数据至少重复3次。对各组数据进行单因素方差分析(ANOVA),以P<0.05为差异有统计学意义。
2 结果
2.1 根皮素对RAW264.7巨噬细胞生长抑制作用的影响 CCK-8法观察细胞经不同浓度的根皮素药物处理后细胞增殖活性的变化,结果显示,与正常组相比,各剂量药物对RAW264.7巨噬细胞的增殖均无明显影响(P>0.05),表明在该浓度范围内,药物不影响细胞增殖,亦没有细胞毒性。见表2。
2.2 根皮素对RAW264.7巨噬细胞TNF-α、IL-6、IL-1β含量的影响 ELISA结果表明,与正常组相比,模型组上述炎症因子表达水平显著升高(P<0.001);与模型组相比,根皮素药物浓度各剂量干预后可明显下调细胞上清液中上述炎症因子表达(P<0.01或P<0.001)。见表3。
2.3 根皮素对RAW264.7巨噬细胞相关COX-2、iNOS、TNF-α、IL-6和IL-1β表达的影响 与正常组相比,模型组mRNA表达水平显著升高(P<0.01或P<0.001);与模型组相比,根皮素药物各剂量组干预后各指标mRNA表达明显降低(P<0.01或P<0.001)。见图1、表4。
2.4 Western blot检测根皮素对RAW264.7细胞的相关蛋白表达
2.4.1 根皮素对RAW264.7细胞MAPK信号通路的影响 与正常组相比,模型组MAPK信号通路的相关蛋白表达水平显著升高(P<0.01或P<0.001);与模型组相比,根皮素药物各剂量组干预后可明显降低LPS诱导RAW264.7巨噬细胞p-P38和p-ERK1/2的蛋白表达水平(P<0.01或P<0.001),但对p-JNK1/2蛋白表达无影响。见图2、表5。

表1 实时定量PCR引物Tab.1 Primers for real-time quantitative PCR
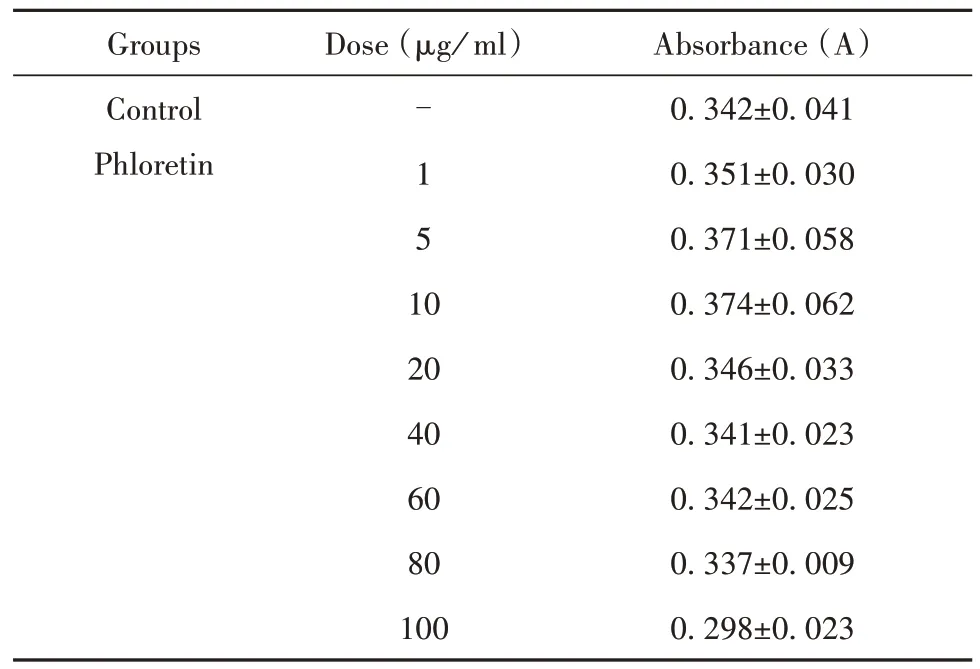
表2 不同浓度根皮素对RAW264.7巨噬细胞增殖的影响(xˉ ±s,n=5)Tab.2 Effect of phloretin at different concentrations on proliferation of RAW264.7 macrophages(xˉ ±s,n=5)

表3 含根皮素药物浓度对RAW264.7巨噬细胞TNF-α、IL-6和IL-1β的影响(xˉ±s,n=3)Tab.3 Effect of phloretin concentration on TNF-α,IL-6 and IL-1βin RAW264.7 macrophages(xˉ ±s,n=3)
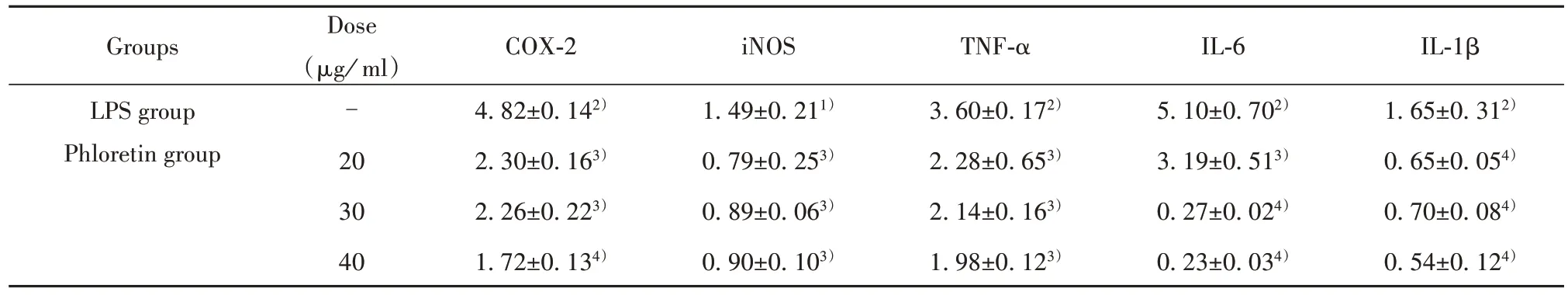
表4 根皮素药物各浓度对RAW264.7巨噬细胞相关mRNA表达的影响(xˉ±s,n=3)Tab.4 Effectsof different concentrationsof phloretin on expression of related mRNA in RAW264.7 macrophage(xˉ ±s,n=3)
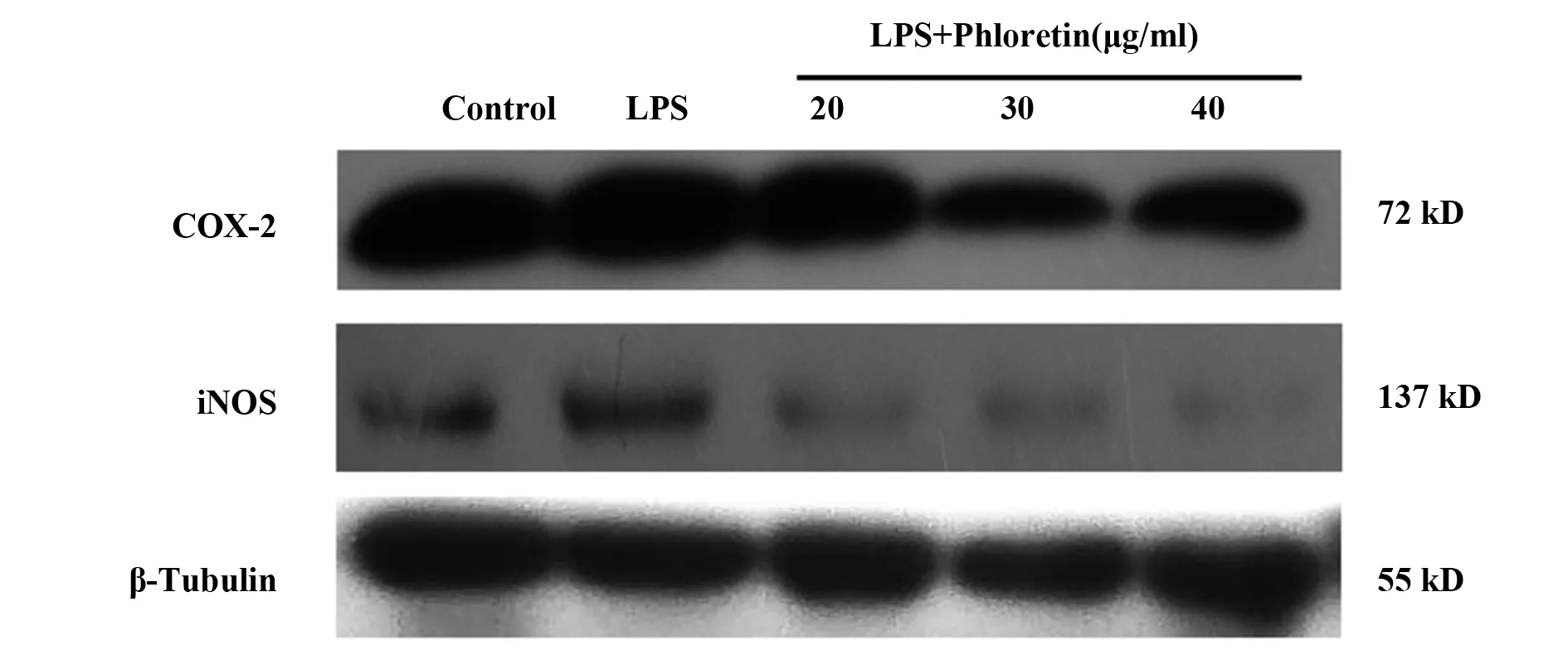
图1 RAW264.7巨噬细胞中COX-2和iNOS的蛋白表达Fig.1 Protein expression electrophoresis of COX-2 and iNOSin RAW264.7 macrophages

图2 RAW264.7巨噬细胞MAPK信号通路中P38、ERK 1/2、JNK1/2的蛋白表达电泳Fig.2 Protein expression electrophoresis of P38,ERK1/2,JNK 1/2 in MAPK signaling pathway of RAW264.7 macrophage

图3 RAW264.7巨噬细胞Akt/NF-κB信号通路中相关蛋白的表达电泳Fig.3 Expression and electrophoresis of related proteins in Akt/NF-κB signaling pathway of RAW264.7 mac⁃rophage
2.4.2 根皮素对RAW264.7巨噬细胞Akt和NF-κB信号通路的影响 与正常组相比,模型组Ak/t NF-κB信号通路的相关蛋白表达水平显著升高(P<0.01或P<0.001);与模型组相比,根皮素药物各剂量组干预后可明显降低LPS诱导RAW264.7巨噬细胞Akt、IκBα、NF-κB P65的蛋白表达水平(P<0.05、P<0.01或P<0.001)。见图3、表6。
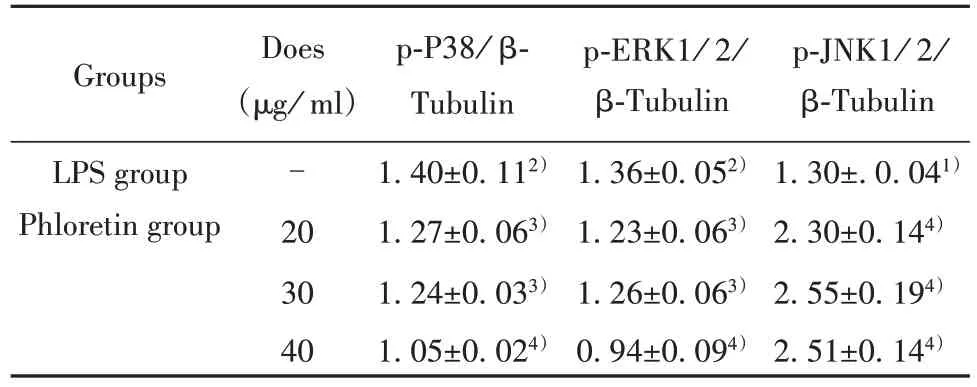
表5 根皮素药物各浓度组对RAW264.7巨噬细胞MAPK信号通路蛋白表达的影响(xˉ±s,n=3)Tab.5 Effects of different concentrations of phloretin on MAPK signal pathway protein expression in RAW264.7 macrophages(xˉ ±s,n=3)
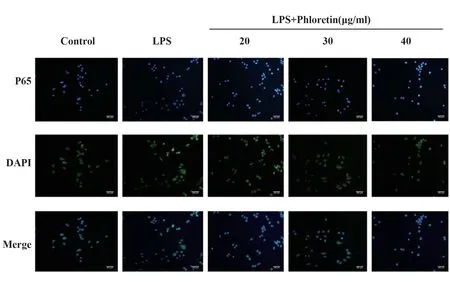
图4 显示了NF-κB P65核移位的代表性显微照片(×200)Fig.4 Representative micrographs showing nuclear translocation of NF-κB P65(×200)
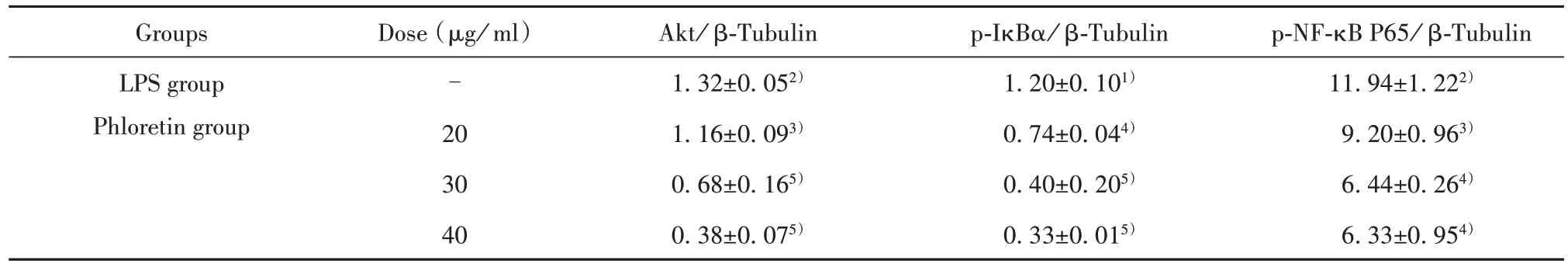
表6 根皮素药物各浓度组对RAW264.7巨噬细胞Akt/NF-κB信号通路蛋白表达的影响(xˉ±s,n=3)Tab.6 Effects of different concentrations of phloretin on Akt/NF-κB signaling protein expression in RAW264.7 macro⁃phages(xˉ ±s,n=3)
2.5 根皮素减弱LPS刺激的RAW264.7细胞NF-κB P65炎症信号通路 Western blot和免疫细胞化学方法研究根皮素对RAW264.7巨噬细胞NF-κB P65磷酸化和NF-κB P65核移位的影响。Western blot结果表明,根皮素抑制NF-κB P65的磷酸化(图3)。免疫细胞化学-免疫荧光(ICC-IF)结果表明,根皮素抑制NF-κBP65亚基向细胞核的转移(图4)。
3 讨论
LPS诱导RAW264.7巨噬细胞分泌相关炎症因子产生炎症反应,因此,本实验通过深入研究LPS诱导的RAW264.7巨噬细胞抗炎细胞因子的变化规律,进一步认识其对炎症反应机制。LPS诱导细胞4 h,与正常组相比,模型组均可升高细胞上清液中TNF-α、IL-6和IL-1β的释放,表明炎症模型造模成功。
TNF-α为一类经典炎症因子,可诱导多种炎症的发生,最终导致细胞凋亡,并处于炎症级联反应的中心,对LPS诱导的RAW264.7巨噬细胞NO合成具有重要意义。IL-1β是机体早期炎症的标志物,可诱导炎症因子IL-8等的产生,其产生在细胞损伤中起决定性作用[11-12]。促炎因子也包括IL-6,有研究表明,IL-6具有抗炎和致炎的双向作用,其作用与其在组织中含量有关,正常水平的IL-6对机体有利,而过多IL-6会引起炎症损伤,同时IL-6在神经病理性疼痛中也发挥重要作用[13-14]。本研究发现根皮素低、中、高浓度组均可下调LPS诱导的RAW264.7巨噬细胞TNF-α、IL-6和IL-1β的表达升高,并呈现良好的浓度依赖性,说明根皮素的抗炎作用与抑制炎症细胞因子有关。
在炎症反应中,促炎症酶(iNOS和COX-2)也起关键作用,其催化产物能显著促进炎症反应进展,大量分泌NO,是炎症反应检测的重要指标[15]。目前,调节NO合成酶及其诱导型合成酶iNOS的表达是治疗炎症疾病的重要手段。通常,组织细胞内COX-2活性极低,在相关因素诱导后得到激活。通过调节前列腺素合成进而介导炎症与疼痛反应。因此,为了探讨根皮素抗炎作用机制,课题组研究了LPS模型组和不同浓度根皮素组iNOS和COX-2的关系。本次研究结果表明,根皮素能显著降低LPS刺激RAW264.7细胞产生的iNOS和COX-2。这些研究表明,根皮素对RAW264.7细胞炎症相关因子的表达具有抑制作用,并呈浓度依赖性。同时,HUANG等[16]的研究表明,根皮素能显著抑制脂肪细胞慢性炎症性疾病的炎症反应。
NF-κB是一类由P50和P65组成蛋白家族。其中P65是促炎基因表达的重要调节因子[17-18]。NF-κB通过控制TNF-α、IL-6和IL-1β的表达在炎症反应中发挥重要作用[19]。Akt是NF-κB的上游分子,对NF-κB的活化具有重要作用[20-21]。为了探讨根皮素在炎症反应中的作用,课题组在LPS刺激的RAW264.7细胞中检测了Ak/tNF-κB相关蛋白的表达。结果表明,根皮素显著减弱LPS诱导的Ak/t NF-κB相关蛋白的磷酸化。MAPK信号通路也参与炎症细胞因子的调节[22-23]。因此,课题组同时检测了根皮素对P38、ERK1/2和JNK1/2磷酸化的影响。结果表明,根皮素能显著下调ERK1/2和P38磷酸化。有研究表明,在急性肺损伤模型中,根皮素能显著抑制JNK1/2的磷酸化[24]。该结果与本研究并不一致,因此课题组认为不同细胞的根皮素抑制炎症的机制可能不同。
综上,根皮素可抑制LPS诱导的RAW264.7巨噬细胞的炎症反应,其抗炎作用与抑制炎症因子TNF-α、IL-6和IL-1β的生成,下调iNOS和COX-2蛋白表达,介导激活Ak/tNF-κB、ERK1/2和P38蛋白表达的调控有关。这可能是其防治各种慢性炎症疾病重要作用机制。为后续临床开发用药提供理论依据。

