环状RNA的生物学特性及其在膀胱癌的研究进展
牟泽中 杨 宸 姜昊文
1 研究历史
膀胱癌是发病率全球排名第九的癌症,且膀胱癌患者所在地区、性别、年龄差异较大,约75%的高危膀胱癌患者在术后10年内复发、进展或死亡[1]。研究[2]表明,环状RNA(circular RNA,circRNA)与膀胱癌的发生、发展和预后有着一定联系。1976年,Sanger等[3]研究高等植物病毒时利用电子显微镜发现了一类内源性非编码双链闭合RNA,并将其命名为circRNA。但由于当时技术所限和认知的局限性,并未引起重视[4]。近年来,随着高通量测序技术和分子生物学技术的发展,研究者对circRNA有了新的认识。与此同时,由于circRNA在哺乳动物细胞中有着极高的丰富度、稳定性,以及高度保守性,使其成为当下研究的热点。1991年,Nigro等[5]在研究潜在肿瘤抑制基因DCC基因时首次发现人体内源性circRNA。随后的研究[6-7]结果显示,circRNA在糖尿病、高血压、类风湿关节炎、胃癌、肝癌、乳腺癌和膀胱癌中有着广泛的表达。但circRNA在膀胱癌中研究的深度和广度尚显不足。
2 生物结构特征
Braun等[8]研究结果表明,剪切机制可以使外显子环化。而大多数的circRNA来源于编码蛋白的基因,这使得大多数circRNA也会含有完整的外显子,因此可以推测circRNA主要是通过RNA聚合酶Ⅱ(pol Ⅱ)转录而成且受剪切机制的调控[9]。线性RNA同样来源于编码蛋白的基因,且受剪切机制影响。与线性RNA不同,circRNA通过将3’和5’末端结合在一起并进行独特的反向剪接使circRNA分子环化[9]。正是由于circRNA是一个闭环结构,无游离的5’帽端和 3’Poly A尾端[10];相比线性RNA,circRNA受核酸外切酶的影响较小,故其保守性和稳定性也更强。
3 分类与形成方式
circRNA可被分为4类:仅包含外显子的circRNA(EcircRNA),仅包含内含子的circRNA(ciRNA),同时包含外显子和内含子的circRNA(EIciRNA),以及由转移RNA(tRNA)、小核RNA(snRNA)、核糖体RNA(rRNA)环化而形成的circRNA[11]。目前公认有3种合成方式:外显子套索驱动环化、内含子驱动环化、RNA结合蛋白介导环化。外显子套索环化机制依赖于“外显子跳跃”机制,通过外显子的跳跃使得RNA长链折叠,3’剪接供体与5’剪接受体的共价剪接并形成同时包含环状和线性产物的套索结构,通过剪接体去除内含子,形成一个只有外显子的环状RNA。内含子配对环化机制主要依赖于RNA的结构序列特异性,一些RNA的外显子两端的内含子是互补配对的,反向互补配对的内含子直接结合使得RNA环化,去除内含子形成circRNA[12]。Jeck等[13]在后续的研究中发现,内含子配对环化机制的发生概率高于套索驱动环化机制的发生概率。RNA结合蛋白(RBP)主要通过RBP结合到circRNA侧翼的内含子上进而调控环化。RBP Quaking (QKI)可以调控circRNA的生物合成。目前,关于膀胱癌中的circRNA的环化机制尚无足够、确切的研究结论以明确提示circRNA在膀胱癌发生、发展中的机制可作为今后研究的切入点。
4 circRNA在膀胱癌中的生物学功能
4.1 作为竞争性内源RNA(ceRNA)调控微RNA(miRNA)活性 ceRNA假说是目前研究最为深入,且得到广泛公认的作用机制。circRNA含有大量的miRNA靶点,使其能够竞争性地与miRNA结合,使有活性的miRNA减少,进而影响信使RNA(mRNA)的作用表达。Hansen等[14]的研究证明,有着70多个miRNA结合靶点的circRNA ciRS-7可充当miRNA-7海绵,并强烈抑制miRNA-7活性,导致miRNA-7的表达水平降低。circRNA的海绵吸附机制在膀胱癌中也有体现,Sun等[15]研究发现circ_0058063可以充当miRNA-145-5p的海绵,通过调节周期蛋白依赖性激酶(CDK)6表达来加速膀胱癌的进展。
4.2 与RBP反应 circRNA不仅可以作为miRNA海绵,还可以作为RBP海绵。研究[9]证明circMbl可以与甘露糖结合凝集素(MBL)直接相互作用,使circMbl通过与线性剪接竞争而在基因调控中发挥作用。但目前此功能尚未有膀胱癌方面的记录报道。
4.3 circRNA编码蛋白质翻译 早期研究发现,circRNA可以通过海绵作用吸附miRNA来影响mRNA的表达进而影响蛋白质的翻译,但circRNA对蛋白质的调控远远不止这些。Mo等[16]利用内含子增强体系技术(IME)检测到了翻译蛋白质的circRtn4。Legnini等[17]发现了circ-ZNF609可以编码控制肌细胞增殖的蛋白质,为真核生物circRNA编码蛋白质又提供了一个证据。该发现使得在circRNA生物学功能方面的研究进入新的领域。
5 环状RNA在膀胱癌中的研究进展
5.1 在膀胱癌中表达上调的circRNA circRNA对于膀胱癌的发生、发展有着重要的作用。一些circRNA会加速膀胱癌的进展,通过研究了解这些促癌circRNA的作用机制,可以为膀胱癌的临床治疗和早期筛查提供新思路。Liu等[18]发现,circDOCK1在膀胱癌组织和细胞系中表达上调。通过抑制circDOCK1可以降低膀胱癌细胞活力,抑制细胞增殖和膀胱癌细胞的迁移能力。其通过进一步实验证明,circDOCK1调节膀胱癌细胞中circDOCK1/hsa-miRNA-132-3p/Sox5途径发挥作用,而通过体内异种移植肿瘤实验进一步发现circDOCK1可以抑制肿瘤的生长,进而为膀胱癌的治疗提供了潜在的生物学标志物和治疗靶点。Bi等[19]通过对膀胱癌和癌旁组织的对比分析发现,circRNA染色质重塑因子(circ-BPTF)在膀胱癌中表达增加,其通过海绵吸附miRNA-31-5p来调节膀胱癌的进展;研究还证实,miRNA-31-5p可以直接与致癌基因RAS癌基因家族成员RAB27A结合使其表达下调。通过抑制circ-BPTF的表达可以有效延缓癌症的进展,因而circ-BPTF对于膀胱癌的临床诊治有着重要的作用与影响。而Yang等[20]则利用生物信息学分析的方法,首先预测了可以与circRNA紫外线抵抗相关基因(circ-UVRAG)潜在结合的miRNA-223,然后再利用生物信息学分析工具预测miRNA-223的下游靶基因成纤维生长因子受体2(FGFR2)基因,并同时利用癌症组图谱(TCGA)数据库对膀胱癌患者FGFR2表达进行生存预后分析,最后通过细胞实验、动物实验等方式证明了通过抑制circ-UVRAG可以降低FGFR2的表达,延缓膀胱癌的进展。该文从生物信息学方法入手,提供了一个新的研究思路与方法。此外,还有很多关于circRNA在膀胱癌进展中的研究报道,这些高表达的环状RNA可以不同程度地促进肿瘤的增殖和侵袭[21-26]。同时,也有诸多将生物信息学分析与实验相结合的研究[24,27-28];这些研究充分利用生物信息学在基因表达量和预后生存时间等临床信息的数据,将生物信息学分析的数据结果与其研究中的测序结果相结合,利用基因芯片数据平台(Gene Expression Omnibus,GEO)、TCGA等公共数据库对膀胱癌的芯片、测序样本进行差异分析,选取差异表达的circRNA;再根据临床信息进一步筛选有临床意义的circRNA,即在临床预后或病理分期等有显著差异的circRNA。在膀胱癌中表达上调的circRNA及其调控的miRNA和mRNA见表1。
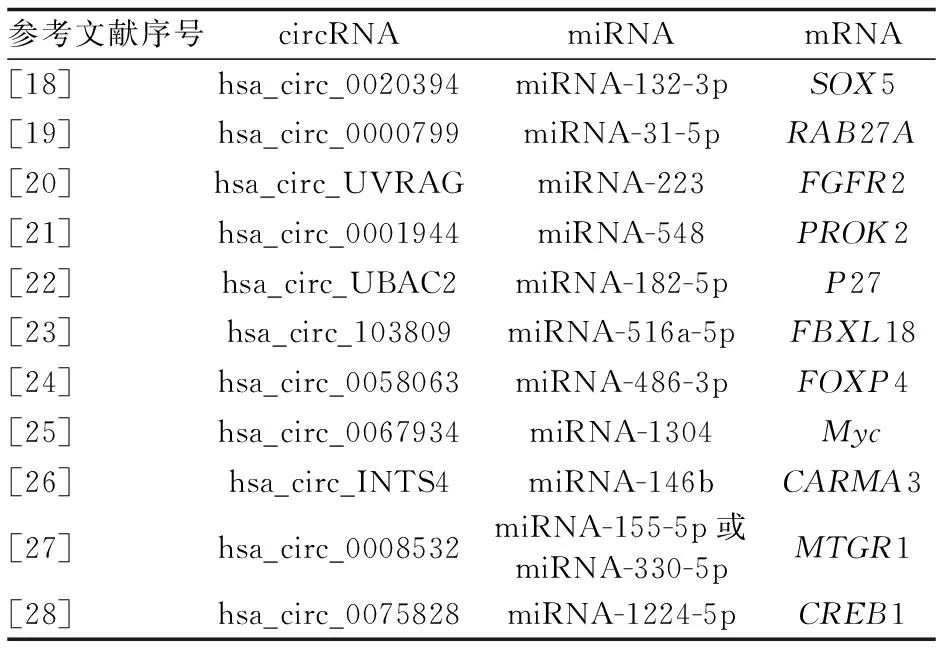
表1 在膀胱癌中表达上调的circRNA
UBAC2为泛素相关结构域蛋白2,SOX5为SYN转录因子5,PROK2为植物表达载体2,FOXP4为叉头框蛋白4,CARMA3为凋亡蛋白募集结构域和膜相关鸟苷酸激酶样结构域蛋白3,MTGR1为髓易位基因相关蛋白1,CREB1为环磷酸腺苷效应元件结合蛋白1
5.2 在膀胱癌中表达下调的circRNA 另一些circRNA在膀胱癌中表达下调。Sun等[29]证明了circRNA CEP128可以通过调控miRNA-145-5p/Myd88信号通路来加速膀胱癌的进展。miRNA-145-5p在膀胱癌中表达是降低的,而circCEP128可以与miRNA-145-5p靶向结合,miRNA-145-5p又可与Myd88 靶向结合,所以敲除circCEP128可使miRNA-145-5p的表达升高,进而促进丝裂原活化蛋白激酶(MAKP)信号通路和相关蛋白质的表达来加速肿瘤的进展。 同一个circRNA在不同的组织或细胞中发挥的作用有时也是不一样的。研究[30]证实circRNA-小脑变性相关蛋白1反义RNA (Cdr1as)在肝细胞癌中会加速肿瘤的生长,但是在膀胱癌中circRNA-Cdr1as却起到抑癌作用。Li等[31]证明,circRNA-Cdr1as可以抑制膀胱癌细胞的增殖、迁移和侵袭,其在膀胱癌中表达下调。circRNA-Cdr1as可以同时吸附多个miRNA,包括miRNA-7、miRNA-135a和miRNA-1290,尤其是miRNA-7和miRNA-135a[31]。circRNA对于进展性膀胱癌的抑制作用也有报道。Bi等[32]通过研究不同侵袭性的膀胱癌后发现,circ-ZKSCAN1对于膀胱癌细胞的生长、增殖和迁移起到了显著抑制作用,并发现circ-ZKSCAN1的低表达与膀胱癌的缓解率低、复发率高和肿瘤转移呈正相关,通过促进circ-ZKSCAN1的表达,可以有效地抑制膀胱癌的侵袭和转移。然而,并非所有低表达的circRNA都能延缓膀胱癌进展,Su等[33]的研究结果提示,hsa_circ_RIP2可以通过靶向吸附miRNA-1305并提高TGF-β2的表达来促进肿瘤的上皮-间质转化(EMT)过程。但hsa_circ_RIP2在肿瘤患者中呈低表达,且表达量越低的患者预后越差。通过检测免疫相关分子对这种相互矛盾的现象进一步探究发现,患者趋化因子CCL2、CCL3、CXCL5、CXCL17、CXCL20,以及细胞因子IL-6、IL-13、IL-17均发生了显著的变化。此外还发现,在hsa_circ_RIP2高表达的患者体内,有更多的CD3+/CD8+T淋巴细胞浸润,提示circRNA对于肿瘤的调控有着更深层次的分子机制,即在个体水平上,促癌的circRNA可能通过与肿瘤免疫微环境互相调控最终发挥一个动态调控肿瘤的作用。此外,膀胱癌的侵袭和远处转移是膀胱癌患者预后和生存期的主要影响因素,而肿瘤的侵袭和转移的基础是细胞向肌肉内的增殖和侵袭[34],而目前这种机制尚未有确切的研究报道,因而circRNA对于肿瘤侵袭的作用将是未来研究的一个新思路,诸如circFUT8、circFOXO3等在膀胱癌中差异低表达的circRNA对于肿瘤的侵袭和转移有着抑制作用,这些低表达circRNA可以作为未来研究的一些潜在的治疗靶点[35-36]。在膀胱癌中表达下调的circRNA及其调控的miRNA和mRNA见表2。

表2 在膀胱癌中表达下调的circRNA
TGFBR2为TGF-β2受体,CCNE1为细胞周期蛋白E1,PIK3Cd为磷酸肌醇-3激酶催化亚基δ肽,KLF为kruppel样因子
6 生物信息学分析
生物信息学技术的发展与应用进一步推动了circRNA的深入研究与探索。通过肿瘤本体(Gene Ontology,GO)分析和京都基因与基因组百科全书(Kyoto Encyclopedia of Gens and Genomes,KEGG)通路分析等技术可以预测circRNA在通路表达的差异,再利用蛋白质-蛋白质相互作用网络(PPI)构建技术可以预测差异表达的circRNA可能参与的通路,这些生物信息学技术分析的结果为后续的深入研究提供了指导方向。但关于circRNA在不同分期的膀胱癌中表达的信息仍然非常有限,这也提示应对不同临床病理分期的膀胱癌开展进一步研究,提高膀胱癌的诊断准确率、治疗效果,以及改善预后。Li等[37]利用对circRNA进行测序并进行GO和KEGG分析来探索circRNA的生物学功能,通过R包富集分析富含circRNA的基因的生物学过程,并利用STRING构建PPI,初步确定了hsa_circ_0137606与miRNA-1231的相互作用,再通过后续分子实验进行验证,最后得出结论:hsa_circ_0137606通过海绵作用吸附miRNA-1231来抑制膀胱癌细胞的增殖和转移。生物信息学分析也同样可以应用于预测circRNA与膀胱癌预后的关系,Liu等[38]通过生物信息学分析发现了7 282组差异表达的circRNA,并建立了12组circ-RNA 的差异表达网络,通过进一步的预后分析,得出与hsa-miRNA-106b、hsa-miRNA-145 和hsa-miRNA-214相互作用的circRNA与膀胱癌患者的总体存活率有关,而hsa_circ_0076704、hsa_circ_0081963 和hsa_circ_0001361与膀胱癌患者的中位总生存期有关。
7 总 结
近年来,众多研究尤其是膀胱癌的研究都是基于其通过海绵作用吸附miRNA抑制mRNA 的表达来调控肿瘤进展的这一机制进行的。但是其作为编码蛋白质翻译及其与RNA结合蛋白质直接结合的作用方式的研究结果较少。对于膀胱癌来说,未来的研究不仅要基于海绵吸附这一机制,更要探索在编码蛋白质翻译等生物学功能等方面的研究,寻找潜在的调节靶点和通路。

